植物源天然产物协同抗生素抗MRSA的研究进展
2022-05-30王宗朝张洁丁超月郭银辉潘源虎
王宗朝 张洁 丁超月 郭银辉 潘源虎

摘要:耐甲氧西林金黃色葡萄球菌(MRSA)在世界各地感染率和分离率不断升高,常用抗菌药物的治疗作用逐渐减弱甚至无效,因此迫切需要一种新的治疗MRSA感染的手段。植物源天然产物因其新颖复杂的化学结构表现出广泛的生物活性,作为增效剂协同抗生素对抗MRSA的作用已有大量报道。本文主要综述了自2016年来的植物源天然产物协同抗生素对抗MRSA的作用及机制,以期为进一步的研究提供参考。
关键词:天然产物;耐甲氧西林金黄色葡萄球菌;抗生素;协同作用;机制
中图分类号:R978.1 文献标志码:A
Research progress of synergistic anti-MRSA effects of plant-derived natural products combined with antibiotics
Wang Zong-chao, Zhang Jie, Ding Chao-yue, Guo Yin-hui, and Pan Yuan-hu
(National Reference Laboratory of Veterinary Drug Residues (HZAU) and MOA Key Laboratory for the Detection of Veterinary Drug Residues in Foods, College of Animal Science and Technology, Huazhong Agricultural University, Wuhan 430070)
Abstract The infection and isolation rates of methicillin-resistant Staphylococcus aureus (MRSA) are increasing all over the world, and the therapeutic effects of commonly used antibiotic have gradually weakened or even become ineffective. Therefore, new approaches for the treatment of MRSA infection are urgently needed. Plant-derived natural products exhibit a wide range of biological activities due to their novel and complex chemical structures, and their effects as antibiotic adjuvants against MRSA have been reported in large numbers. This article mainly reviews the effects and mechanisms of plant-derived products combined with antibiotics against MRSA since 2016, hoping to provide a reference for further research.
Key words Natural products; MRSA; Antibiotics; Synergistic effects; Mechanisms
MRSA是一种重要的人畜共患病原菌,可导致多种临床感染性疾病,如浅表皮肤感染、菌血症、心内膜炎、肺炎、脓肿和软组织或骨组织感染等[1]。据统计,在2014—2019年我国全国门诊患者分离的总菌株数中,MRSA的检出率为25.1%~27.8%[2]。临床MRSA的多重耐药问题给临床治疗的选择用药带来了困难,特别是耐万古霉素的金黄色葡萄球菌(VRSA)在2002年被首次报道[3-4]。因此,寻找新的药物或者方法控制MRSA感染引起了众多学者的关注。
植物源天然产物协同抗生素抗耐药菌的研究在国内外均有报道。Hemaiswarya等[5]根据其不同抗菌增效方式进行了详细的综述;曹珍等[6]综述了分别针对临床多种耐药菌具有抗菌增效作用的植物源天然产物。具有协同抗生素抗MRSA活性的植物源天然产物也有大量文献报道,韩宗其等[7]在2012年对其进行了综述。本文总结了自2016年来国内外报道的具有协同抗生素对抗MRSA的植物源天然产物的作用及其机制,为进一步研究提供参考。
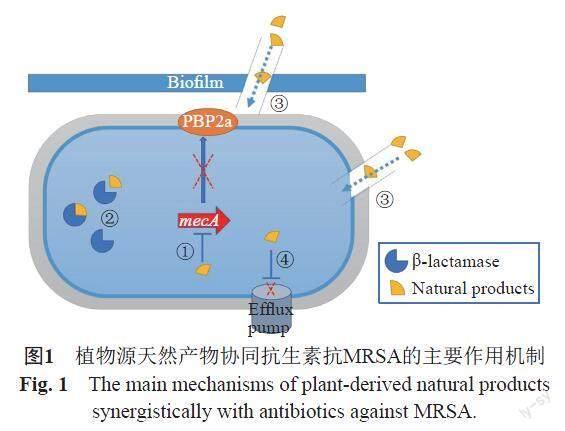
1 植物源天然产物协同抗生素抗MRSA的主要作用机制
1.1 影响PBP2a蛋白的表达与活性
研究表明,MRSA主要耐药性机制是由于其获得的葡萄球菌盒式染色体SCCmec上的一个基因 mecA编码合成一种新的青霉素结合蛋白PBP2a,它与β-内酰胺类抗生素亲和力较低,在较高浓度的β-内酰胺抗生素的存在下,PBP2a可代替PBPs继续进行细胞壁的生物合成[8]。植物源天然产物可通过影响细菌PBP2a的表达与活性(图1-①)而提高β-内酰胺类抗生素的抗菌作用。Catteau等[9]发现了熊果酸(23)/齐墩果酸(24)与氨苄西林/苯唑西林的协同抗MRSA作用,荧光显微镜下观察到经药物孵育MRSA的PBP2a蛋白从间隔分裂位点离域,从而干扰肽聚糖的合成。Mun等[10]通过免疫印迹法发现桑色素与苯唑西林的联合显著降低了PBP2a蛋白的表达量,而两种药物的单独使用结果均与阴性对照组无明显差异。孙丰慧[11]等通过转录组测序研究发现香叶醇(22)能够降低mecA基因的表达,推测香叶醇增强β-内酰胺类抗生素的抗MRSA活性可能是通过下调了mecA基因的表达。
1.2 抑制β-内酰胺酶的活性
細菌产生β-内酰胺酶是其对多数β-内酰胺类抗生素产生耐药的重要原因之一,这种酶通过催化β-内酰胺环的水解使抗生素失活[12]。通过抑制β-内酰胺酶活性(图1-②)恢复抗生素对MRSA的杀菌作用是植物源天然单体产物的作用机制之一。Zhou等[13]发现五环三萜的熊果酸(23)和齐墩果酸(24)抑制活细菌对硝基头孢(一种β-内酰胺酶底物)的水解,但在细菌裂解物中不起作用,表明两种化合物可间接抑制β-内酰胺酶的活性。Teng等[14]发现茶黄素-3,3-二氨基甲酸酯(theaflavin-3,3'-digallate)没有抗菌活性,但是可以通过抑制金属β-内酰胺酶(MBLs)对抗生素的水解而增强β-内酰胺类抗生素对MRSA的活性;通过分子动力学模拟方法发现其可与Gln242和Ser369结合从而限制MBLs的活性。
1.3 影响生物被膜或细胞膜
细菌生物被膜(biofilm,BF)通常指细菌吸附于生物材料或机体腔道表面,分泌多糖基质、纤维蛋白和脂蛋白等,将其自身包绕其中形成多层细胞簇的膜状物,可保护细菌逃逸宿主免疫和抗菌药物的杀伤作用,使细菌对药物产生高度耐药性导致治疗的困难[15]。天然产物可通过抑制BF的形成和清除成熟的BF(图1-③)产生抗生素协同作用。严一舟等[16]采用结晶紫染色法和菌落计数法评估百里香酚(17)和苯唑西林单用和联用对MRSA标准菌株USA300的BF形成抑制和清除作用,结果表明在亚抑菌浓度下,百里香酚与苯唑西林对USA300的BF的形成具有一定的抑制作用;在较高浓度下百里香酚对BF有良好的清除作用,与抗生素联用对BF的抑制和清除作用进一步增强。
细胞膜作为保护细菌的一道天然屏障,能够阻挡部分包括抗生素在内的有害物质进入细胞内。天然产物通过增大细菌细胞膜的通透性,引起细菌内容物的泄露和加快抗生素进入菌体(图1-③)。Aelenei等[17]通过荧光和微分干涉相差显微镜和扫描电镜观察发现,在MRSA暴露于桑辛素(1)、桑黄酮G(2)后,细菌细胞膜通透性增加导致细胞内容物大量渗漏,桑辛素恢复了MRSA对苯唑西林的敏感性。研究发现木犀草素[18](10)、芹菜素[19](14)均可增加MRSA细胞膜通透性,与抗生素协同抑制MRSA的生长。
1.4 抑制外排泵的活性
通过细菌细胞膜上的外排泵将抗生素排出细胞外,是临床上固有耐药和获得性多药耐药性的主要机制。外排泵的膜转运蛋白可将进入胞内的药物直接泵出细胞外,使细胞内抗菌药物浓度降低而产生耐药[20]。天然产物能通过减少细菌外排泵的表达和抑制外排泵活性(图1-④),从而增加菌体内抗生素浓度,达到更好的杀菌效果。邹丹等[21]发现鹰嘴豆芽素A可显著提高MRSA41577对环丙沙星的敏感性,经鹰嘴豆芽素A处理的MRSA菌株的体内环丙沙星的蓄积量随着药物处理时间的增加而增加。RT-PCR结果鹰嘴豆芽素A和环丙沙星作用MRSA16h后,norA 的表达量相对于阴性对照组降低了65%,其抑制效果优于阳性对照利血平的48%。进一步SDS-PAGE电泳结果显示其中与外排系统相关的蛋白除NorA蛋白明显减少外,ABC 转运体 ATP 结合蛋白也明显减少。
2 协同抗生素对抗MRSA的植物源天然产物
2.1 黄酮类
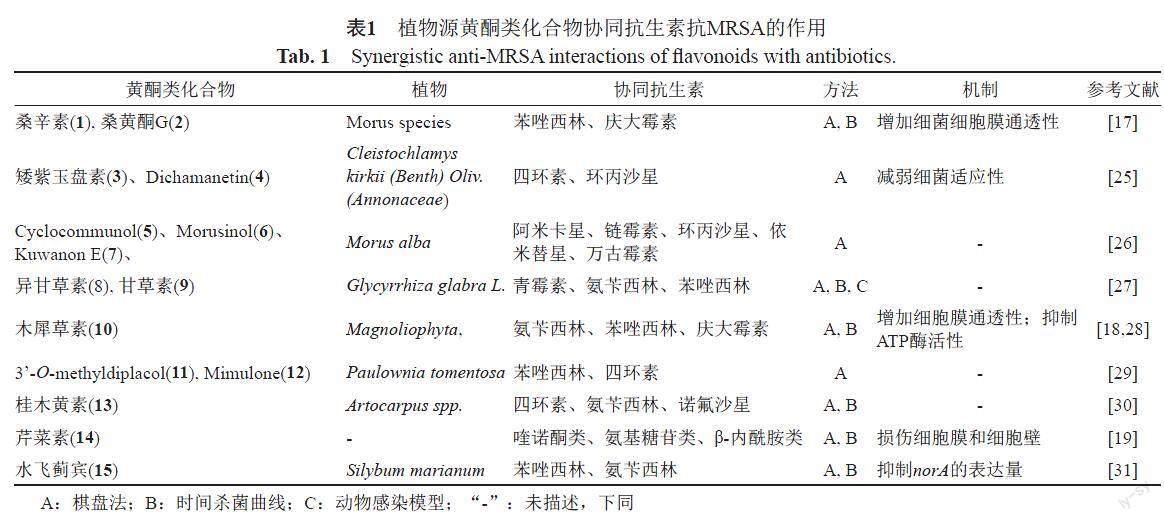
黄酮类化合物多在自然界高等和蕨类植物中发现,2个具有酚羟基的苯环通过中央三碳原子相互连接而成的C6-C3-C6结构单元为黄酮类化合物的重要特征,因其活性好、易获得、副作用小的优点得到研究者们的广泛关注。黄酮类化合物同时具有亲水与疏水结构的分子特点是其具有抗菌活性的重要条件[22],异戊烯基、烷基链和含氮或含氧杂环等疏水性基团可增强其抗菌活性,改善生物利用度与药物代谢和药物动力学特性[23];酚羟基的存在可增强查尔酮类化合物结合蛋白质和穿透细胞质膜的能力,增强杀菌活性的同时也产生了安全性问题[24]。文献报道具有协同抗MRSA活性的植物源黄酮类化合物结构式及其作用机制分别见图2和表1。
2.2 萜类
萜类化合物在自然界中分布广泛,具有庞杂的骨架结构与多样的生物活性,是天然产物中数量最多的一类化合物。从化学结构来看,根据分子骨架中基本结构异戊二烯单元的数目可分为单萜、倍半萜、二萜、二倍半萜、三萜等;其中五环三萜类化合物因具有包括抗炎、抗菌、抗病毒、免疫调节、调节血糖、降血压和抗肿瘤活性等药理作用,成为目前天然药物化学研究的一个热点。在五环三萜类α-香树脂醇、白桦脂酸和白桦醛酸对MRSA的抗菌作用的研究中,全基因组转录组学分析阐明了其通过多个途径对细菌起抑制作用,包括细胞分裂、双组分调节系统、ABC转运体、脂肪酸生物合成、肽聚糖生物合成、氨酰-tRNA合成酶等[32-34]。图3和表2分别列举了具有协同抗生素对抗MRSA作用的萜类化合物结构式与作用机制。
2.3 苯丙素类
苯丙素类指苯环与3个直链碳连在一起具有结构单元(C6-C3)的化合物,包括苯丙烯及其氧化程度不同的衍生物、香豆素和木脂素等,香豆素类化合物因其抗病毒、抗肿瘤、抗菌、抗凝血等多种生物活性成为近年来的研究热点,大量的全新的香豆素衍生物被合成研究。Kayser等[48]通过对一系列简单香豆素类进行抗菌活性测试,发现C6、C7、C8位被不同极性的基团取代影响了其抗菌谱与抗菌活性。Qin等[49]对大量香豆素类衍生物进行构效关系分析,结果表明含有杂环且与香豆素母体相连的给电子/吸电子取代基的存在对其抗菌活性有重要影响。图4列举了具有协同抗生素对抗MRSA作用的植物源苯丙素类化合物的结构式。Zhang等[50]从丹参中提取出了一种未被报道的丹酚酸Ⅴ(29)和已知的丹酚酸B(30),通过体外联合实验发现两者均可增强左氧氟沙星与硫酸黏菌素的抗MRSA活性。Ekambar等[51]发现迷迭香酸(31)与万古霉素联用在体外显示出显著的杀菌活性,通过SDS-PAGE对菌体表面蛋白进行分析,发现MSCRAMMs(一种细菌表面的毒力蛋白)在迷迭香酸的作用下被明显抑制。Zuo等[52]发现4种香豆素类化合物——5-香叶氧基-7-甲氧基香豆素(32)、artanin(33)、异茴芹内酯(34)、珊瑚菜素(35)可增强多种抗生素对抗MRSA的活性,使抗生素的MIC降低至原来的1/4~1/2。
2.4 醌类
醌类化合物在高等植物中分布比较广泛,是指具有不饱和环二酮结构或容易转变为这种结构的天然有机化合物,主要分为苯醌、萘醌、菲醌和蒽醌4种类型。图5列举了具有协同抗生素对抗MRSA作用的植物源醌类化合物的结构式。Periasamy等[53]将提取自白花丹的白花丹素(36)分别进行单独与联合的抗菌实验,发现其对多株临床MRSA的MIC均在4~8 μg/mL,并且与环丙沙星、哌拉西林联合显示出协同作用;通过透射电镜观察发现经过白花丹素的处理的细菌的细胞壁与细胞质与空白组相比有明显变化。大黄素(37)属于蒽醌化合物,以游离和苷形式存在于蓼科植物掌叶大黄中,在体外可以有效抑制金黄色葡萄球菌生物膜的形成并破坏成熟的生物膜[54],与苯唑西林、庆大霉素联合产生了显著的抗MRSA协同作用[55]。
2.5 生物碱
生物碱是一类重要的天然有机化合物,其多具有生物活性,常为许多药用植物的有效成分;生物碱的杂原子可作为氢键供体或者受体,这促进了其与靶点(蛋白质、受体、酶等)的相互作用[56]。生物碱的性质在现代抗菌药物的发展中有着广泛的应用,对生物碱的研究促进了喹诺酮类和硝基咪唑类药物的发现,利奈唑胺、甲氧苄啶等药物也具有生物碱结构的骨架。图6列举了具有协同抗生素对抗MRSA作用的植物源生物碱类化合物的结构式。Ahirrao等[57]发现荜澄茄果实的甲醇提取物具有抑制金黄色葡萄球菌MrsA外排泵的作用,4种化合物被分离出来并与红霉素进行体外联合实验,发现墙草碱(38)使红霉素的MIC降低至原来的1/8,进一步实验证明其可抑制外排泵和ATP的产生。Guay等[58]发现番茄碱(39)与庆大霉素具有协同对抗MRSA的作用,其类似物FC04-100同样能协同多种抗生素对抗MRSA,并且显示出抗生物被膜的作用。Zhou等[59]从止泻木子中分离出的N-formylconessimine(40)和锥丝亚胺(41)具有协同青霉素和万古霉素对抗MRSA与MSSA的活性。陈广灿等[60]采用棋盘稀释法对小檗碱(42)与几种 β-内酰胺类抗生素的联合抗菌作用进行了研究,结果发现,亚抑菌浓度的小檗碱能使苯唑西林、头孢唑林及氨苄西林的MIC值显著降低;进一步研究发现[61]小檗碱可以通过影响PSMs'聚集成淀粉样纤维来抑制MRSA生物膜的形成,从而增强抗生素的杀菌活性。
2.6 其他
图7列举了未能归于以上几类的具有协同抗生素抗MRSA作用的植物源天然产物的化合物结构式。Cleistochlamys kirkii (Benth) Oliv.属于番荔枝科的一种常见于非洲的药用植物,Pereira等[62]发现提取自其中的甾体化合物——polycarpol(43)可显著增强阿莫西林和苯唑西林对MRSA的活性。大蒜素(44)是从葱科葱属植物中提取的一种有机硫化合物,有研究显示大蒜素与苯唑西林、头孢唑啉、万古霉素具有协同对抗MRSA作用[63]。Ahmad等[64]发现(+)松醇(45)与青霉素显示出最强的协同作用,使青霉素对所有受试临床分离菌的 MIC 降低至原来的 1/8~1/4,(+)松醇与其他β-内酰胺如氨苄西林、苯唑西林和头孢西丁的联合应用对所有受试临床分离MRSA的MIC 减少至原来的 1/4~1/2。Chang等[65]发现多酚化合物 tellimagrandin II(46)在体外实验中增强了苯唑西林对抗MRSA的能力,实验证明两者联合可以抑制mecA基因的表达影响PBP2a蛋白的合成和亲和力,同期实验发现了细菌细胞壁的损伤。
3 结语与展望
抗生素的滥用导致细菌耐药性进程的加快,许多广谱耐药菌和“超级细菌”出现;另一方面新型抗生素的开发状况也不容乐观,将来是否会出现无药可用的问题已成为世界密切关注的焦点之一。目前已发现许多天然产物具有抗菌活性,据统计[66],2016—2019年间共有256个包括植物、微生物、海洋生物来源的具有良好活性的天然化合物被报道,其MIC均低于10 μg/mL或10 μmol/mL。同時天然产物与抗生素联合使用可产生显著的协同作用,甚至能够逆转细菌对某些抗生素的耐药性,为耐药菌感染的治疗提供了新的思路。
尽管已有大量研究报道了天然产物协同抗生素抗耐药菌,但是大多数都只是通过体外联合抑菌试验来表征协同作用,对抗菌机制的研究也不深入。为了进一步阐明协同作用及机制,笔者认为,可以从以下3个方面开展研究:①药物相互作用实验模型的选择。动物模型最能综合反映药物在生物体中的作用模式,高通量的动物模型方法的建立允许多个化合物分子通过单个动物模型确定协同作用[67],但不同种属和个体之间的结果可能并不适用。基于细胞的筛选方法可以相对高效地表征化合物分子之间的相互作用,而正确选择合适的细胞系统来模拟不同的生理情况则极为重要[68-69]。②药物相互作用数学模型的选择。Bliss independence模型和Loewe additivity模型是模拟剂量-效应曲线,并量化两种或两种以上化合物之间协同作用水平的常用模型[68];ZIP模型(zero interaction potency model)结合了以上两个模型的优点,具有识别不同浓度范围内可能发生的多种联合效应的潜力,在高通量药物联合筛选方面表现出巨大的前景[70]。FICI(fractional inhibitory concentration index)在模型解读方面被广泛应用并被不断的进行完善,最近的一篇报道对其进行了更为合适的解读,将FICI小于0.5定义为协同作用,0.5~1为相加作用,1~4为无关作用,大于4为拮抗作用[71]。③药物相互作用的机制研究。化学基因组学通过发现基因与功能、药物与基因表达之间的联系,在确定活性化合物靶点的方面取得了巨大的进步[72];通过构建基因组过表达和缺失株进行抗菌剂筛选,利用这种方法可以将药物敏感表型的变化快速定位到特定的基因上[73-74]。特征性靶标鉴定方法“细菌细胞特征性分析”(BCP),使用最新的显微镜技术来快速有效鉴定受抑菌化合物影响的分子途径,Nonejuie等[75]利用荧光显微镜技术成功发现了天然产物spirohexenolide A通过扰乱MRSA的质子动力系统(PMF)起杀菌作用。
参 考 文 献
[1]Cusumano Z T, Klein R D, Hultgren S J. Innovative solutions to sticky situations: Antiadhesive strategies for treating bacterial infections[J]. Microbiol Spectr, 2016, 4(2).
[2]全国细菌耐药监测网2014—2019年门诊患者临床分离细菌耐药监测报告[J]. 中国感染控制杂志, 2021, 20(1): 32-43.
[3]Chang S, Sievert D M, Hageman J C, et al. Infection with vancomycin-resistant Staphylococcus aureus containing the vanA resistance gene[J]. N Engl J Med, 2003, 348(14): 1342-1347.
[4]Zarfel G, Krziwanek K, Johler S, et al. Virulence and antimicrobial resistance genes in human MRSA ST398 isolates in Austria[J]. Epidemiol Infect, 2013, 141(4): 888-892.
[5]Hemaiswarya S, Kruthiventi A K, Doble M. Synergism between natural products and antibiotics against infectious diseases[J]. Phytomedicine, 2008, 15(8): 639-652.
[6]曹珍, 薛璇玑, 张新新, 等. 临床常见耐药细菌及其天然抗生素增效剂的研究进展[J]. 中草药, 2020, 51(22): 5868-5876.
[7]韩宗其, 左国营, 郝小燕, 等. 中药成分联合抗生素抗MRSA作用的研究进展[J]. 中草药, 2012, 43(1): 187-195.
[8]Guignard B, Entenza J M, Moreillon P. Beta-lactams against methicillin-resistant Staphylococcus aureus[J]. Curr Opin Pharmacol, 2005, 5(5): 479-489.
[9]Catteau L, Reichmann N, Olson J, et al. Synergy between ursolic and oleanolic acids from Vitellaria paradoxa leaf extract and β-Lactams against methicillin-resistant Staphylococcus aureus: In vitro and in vivo activity and underlying mechanisms[J]. Molecules, 2017, 22(12): 2245.
[10]Mun S H, Lee Y S, Han S H, et al. In vitro potential effect of morin in the combination with β-lactam antibiotics against methicillin-resistant Staphylococcus aureus[J]. Foodborne Pathog Dis, 2015, 12(6): 545-550.
[11]孫丰慧, 龙娜娜, 王雪梅, 等. 香叶醇体外抗MRSA活性研究[J]. 中国抗生素杂志, 2018, 43(7): 921-926.
[12]Peacock S J, Paterson G K. Mechanisms of methicillin resistance in Staphylococcus aureus[J]. Annu Rev Biochem, 2015, 84: 577-601.
[13]Zhou T, Li Z, Kang O-H, et al. Antimicrobial activity and synergism of ursolic acid 3-O-α-L-arabinopyranoside with oxacillin against methicillin-resistant Staphylococcus aureus[J]. Int J Mol Med, 2017, 40(4): 1285-1293.
[14]Teng Z, Guo Y, Liu X, et al. Theaflavin-3, 3-digallate increases the antibacterial activity of β-lactam antibiotics by inhibiting metallo-β-lactamase activity[J]. J Cell Mol Med, 2019, 23(10): 6955-6964.
[15]王洪彬, 朱利霞, 于秀剑, 等. 细菌生物被膜研究进展[J]. 动物医学进展, 2019, 40(9): 74-79.
[16]严一舟, 袁中伟, 何泾正, 等. 百里香酚联合苯唑西林对耐甲氧西林金黄色葡萄球菌(MRSA)生物被膜的影响[J]. 微生物学通报, 2020, 47(12): 4205-4218.
[17]Aelenei P, Rimbu C M, Horhogea C E, et al. Prenylated phenolics as promising candidates for combination antibacterial therapy: Morusin and kuwanon G[J]. Saudi Pharm J, 2020, 28(10): 1172-1181.
[18]Joung D-K, Lee Y-S, Han S-H, et al. Potentiating activity of luteolin on membrane permeabilizing agent and ATPase inhibitor against methicillin-resistant Staphylococcus aureus[J]. Asian Pac J Trop Med, 2016, 9(1): 19-22.
[19]Akilandeswari K, Ruckmani K. Synergistic antibacterial effect of apigenin with β-lactam antibiotics and modulation of bacterial resistance by a possible membrane effect against methicillin resistant Staphylococcus aureus[J]. Cell Mol Biol (Noisy-le-grand), 2016, 62(14): 74-82.
[20]Blair J M A, Richmond G E, Piddock L J V. Multidrug efflux pumps in Gram-negative bacteria and their role in antibiotic resistance[J]. Future Microbiol, 2014, 9(10): 1165-1177.
[21]鄒丹, 谢鲲鹏, 王海婷, 等. 鹰嘴豆芽素A对耐甲氧西林金黄色葡萄球菌外排系统的抑制作用[J]. 微生物学报, 2014, 54(10): 1204-1211.
[22]Echeverría J, Opazo J, Mendoza L, et al. Structure-activity and lipophilicity relationships of selected antibacterial natural flavones and flavanones of Chilean flora[J]. Molecules, 2017, 22(4): 608.
[23]Xie Y, Yang W, Tang F, et al. Antibacterial activities of flavonoids: Structure-activity relationship and mechanism[J]. Curr Med Chem, 2015, 22(1): 132-149.
[24]Liu X L, Xu Y J, Go M L. Functionalized chalcones with basic functionalities have antibacterial activity against drug sensitive Staphylococcus aureus[J]. Eur J Med Chem, 2008, 43(8): 1681-1687.
[25]Kincses A, Varga B, Csonka ?, et al. Bioactive compounds from the African medicinal plant Cleistochlamys kirkii as resistance modifiers in bacteria[J]. Phytother Res, 2018, 32(6): 1039-1046.
[26]Zuo G-Y, Yang C-X, Han J, et al. Synergism of prenylflavonoids from Morus alba root bark against clinical MRSA isolates[J]. Phytomedicine, 2018, 39: 93-99.
[27]Gaur R, Gupta V K, Singh P, et al. Drug resistance reversal potential of isoliquiritigenin and liquiritigenin isolated from Glycyrrhiza glabra against methicillin-resistant Staphylococcus aureus (MRSA)[J]. Phytother Res, 2016, 30(10): 1708-1715.
[28]Joung D K, Kang O H, Seo Y S, et al. Luteolin potentiates the effects of aminoglycoside and β-lactam antibiotics against methicillin-resistant Staphylococcus aureus in vitro[J]. Exp Ther Med, 2016, 11(6): 2597-2601.
[29]Navrátilová A, Ne?uta O, Van?atová I, et al. C-Geranylated flavonoids from Paulownia tomentosa fruits with antimicrobial potential and synergistic activity with antibiotics[J]. Pharm Biol, 2016, 54(8): 1398-1407.
[30]Septama A W, Panichayupakaranant P. Synergistic effect of artocarpin on antibacterial activity of some antibiotics against methicillin-resistant Staphylococcus aureus, Pseudomonas aeruginosa, and Escherichia coli[J]. Pharm Biol, 2016, 54(4): 686-691.
[31]袁琳慧, 王迪, 谢鲲鹏, 等. 穿心莲和水飞蓟抑制MRSA41577外排系统的作用机制[J]. 中国生化药物杂志, 2016, 36(11): 27-29.
[32]Chung P Y, Chung L Y, Navaratnam P. Potential targets by pentacyclic triterpenoids from Callicarpa farinosa against methicillin-resistant and sensitive Staphylococcus aureus[J]. Fitoterapia, 2014, 94: 48-54.
[33]Chung P Y, Chung L Y, Navaratnam P. Identification, by gene expression profiling analysis, of novel gene targets in Staphylococcus aureus treated with betulinaldehyde[J]. Res Microbiol, 2013, 164(4): 319-326.
[34]Chung P Y, Chung L Y, Navaratnam P. Transcriptional profiles of the response of methicillin-resistant Staphylococcus aureus to pentacyclic triterpenoids[J]. PLoS One, 2013, 8(2): e56687.
[35]Dettweiler M, Melander R J, Porras G, et al. A clerodane diterpene from Callicarpa americana resensitizes methicillin-resistant Staphylococcus aureus to β-lactam antibiotics[J]. ACS Infect Dis, 2020, 6(7): 1667-1673.
[36]Gr?dinaru A C, Trifan A, ?pac A, et al. Antibacterial activity of traditional spices against lower respiratory tract pathogens: Combinatorial effects of Trachyspermum ammi essential oil with conventional antibiotics[J]. Lett Appl Microbiol, 2018, 67(5): 449-457.
[37]張璐璐, 包梅, 杨伟峰, 等. 穿心莲内酯联合头孢西丁对耐甲氧西林金黄色葡萄球菌的协同抑制作用[J]. 世界科学技术-中医药现代化, 2020, 22(7): 2556-2562.
[38]Aelenei P, Rimbu C M, Guguianu E, et al. Coriander essential oil and linalool-interactions with antibiotics against Gram-positive and Gram-negative bacteria[J]. Lett Appl Microbiol, 2019, 68(2): 156-164.
[39]Sinha S, Gupta V K, Kumar P, et al. Usnic acid modifies MRSA drug resistance through down-regulation of proteins involved in peptidoglycan and fatty acid biosynthesis[J]. FEBS Open Bio, 2019, 9(12): 2025-2040.
[40]孙丰慧, 龙娜娜, 王雪梅, 等. 柠檬醛体外抗MRSA活性及其对β-内酰胺类抗生素的增效作用[J]. 应用与环境生物学报, 2018, 24(1): 7-12.
[41]Gupta P, Patel D K, Gupta V K, et al. Citral, a monoterpenoid aldehyde interacts synergistically with norfloxacin against methicillin resistant Staphylococcus aureus[J]. Phytomedicine, 2017, 34: 85-96.
[42]Wang C M, Chen H T, Wu Z Y, et al. Antibacterial and synergistic activity of pentacyclic triterpenoids isolated from Alstonia scholaris[J]. Molecules, 2016, 21(2): 139.
[43]Lavoie S, Brumley D, Alexander T S, et al. Iodinated meroditerpenes from a red alga Callophycus sp[J]. J Org Chem, 2017, 82(8): 4160-4169.
[44]Gupta V K, Tiwari N, Gupta P, et al. A clerodane diterpene from Polyalthia longifolia as a modifying agent of the resistance of methicillin resistant Staphylococcus aureus[J]. Phytomedicine, 2016, 23(6): 654-661.
[45]Gupta V K, Verma S, Pal A, et al. In vivo efficacy and synergistic interaction of 16α-hydroxycleroda-3, 13 (14) Z-dien-15, 16-olide, a clerodane diterpene from Polyalthia longifolia against methicillin-resistant Staphylococcus aureus[J]. Appl Microbiol Biotechnol, 2013, 97(20): 9121-9131.
[46]Ojeda-Sana A M, Repetto V, Moreno S. Carnosic acid is an efflux pumps modulator by dissipation of the membrane potential in Enterococcus faecalis and Staphylococcus aureus[J]. World J Microbiol Biotechnol, 2013, 29(1): 137-144.
[47]Vázquez N M, Fiorilli G, Cáceres Guido P A, et al. Carnosic acid acts synergistically with gentamicin in killing methicillin-resistant Staphylococcus aureus clinical isolates[J]. Phytomedicine, 2016, 23(12): 1337-1343.
[48]Kayser O, Kolodziej H. Antibacterial activity of simple coumarins: Structural requirements for biological activity[J]. Zeitschrift für Naturforschung C, 1999, 54(3-4): 169-174.
[49]Qin H-L, Zhang Z-W, Ravindar L, et al. Antibacterial activities with the structure-activity relationship of coumarin derivatives[J]. Eur J Med Chem, 2020, 207: 112832.
[50]Zhang J, Zhang X, Zhang J, et al. Minor compounds of the high purity salvianolic acid B freeze-dried powder from Salvia miltiorrhiza and antibacterial activity assessment[J]. Nat Prod Res, 2018, 32(10): 1198-1202.
[51]Ekambaram S P, Perumal S S, Balakrishnan A, et al. Antibacterial synergy between rosmarinic acid and antibiotics against methicillin-resistant Staphylococcus aureus[J]. J Intercult Ethnopharmacol, 2016, 5(4): 358-363.
[52]Zuo G Y, Wang C J, Han J, et al. Synergism of coumarins from the Chinese drug Zanthoxylum nitidum with antibacterial agents against methicillin-resistant Staphylococcus aureus(MRSA)[J]. Phytomedicine, 2016, 23(14): 1814-1820.
[53]Periasamy H, Iswarya S, Pavithra N, et al. In vitro antibacterial activity of plumbagin isolated from Plumbago zeylanica L. against methicillin‐resistant Staphylococcus aureus[J]. Lett Appl Microbiol, 2019, 240: 105.
[54]陳琦, 楼秀芹, 刘涛, 等. 大黄素对金黄色葡萄球菌生物膜抑制作用的体外研究[J]. 中华微生物学和免疫学杂志, 2020, 40(9): 703-708.
[55]Joung D-K, Joung H, Yang D-W, et al. Synergistic effect of rhein in combination with ampicillin or oxacillin against methicillin-resistant Staphylococcus aureus[J]. Exp Ther Med, 2012, 3(4): 608-612.
[56]Kittakoop P, Mahidol C, Ruchirawat S. Alkaloids as important scaffolds in therapeutic drugs for the treatments of cancer, tuberculosis, and smoking cessation[J]. Curr Top Med Chem, 2014, 14(2): 239-252.
[57]Ahirrao P, Tambat R, Chandal N, et al. MsrA efflux pump inhibitory activity of Piper cubeba L.f. and its phytoconstituents against Staphylococcus aureus RN4220[J]. Chem Biodivers, 2020, 17(8): e2000144.
[58]Guay I, Boulanger S, Isabelle C, et al. Tomatidine and analog FC04-100 possess bactericidal activities against Listeria, Bacillus and Staphylococcus spp[J]. BMC Pharmacol Toxicol, 2018, 19(1): 7.
[59]Zhou L N, Ge X L, Dong T T, et al. Antibacterial steroidal alkaloids from Holarrhena antidysenteriaca[J]. Chinese J Nat Medic, 2017, 15(7): 540-545.
[60]陈广灿, 周树勤, 刘淑慧, 等. 小檗碱与β-内酰胺类抗生素对耐甲氧西林金黄色葡萄球菌的协同抗菌作用[J]. 广东医学, 2011, 32(14): 1812-1814.
[61]Chu M, Zhang M B, Liu Y C, et al. Role of berberine in the treatment of methicillin-resistant Staphylococcus aureus infections[J]. Sci Rep, 2016, 6: 24748.
[62]Pereira F, Madureira A M, Sancha S, et al. Cleistochlamys kirkii chemical constituents: Antibacterial activity and synergistic effects against resistant Staphylococcus aureus strains[J]. J Ethnopharmacol, 2016, 178: 180-187.
[63]李曄, 张寅英, 叶金艳. 大蒜素与不同抗菌药物联用对耐甲氧西林金黄色葡萄球菌的体外抗菌活性研究[J]. 中华医院感染学杂志, 2016, 26(24): 5545-5547.
[64]Ahmad F, Misra L, Gupta V K, et al. Synergistic effect of (+)-pinitol from Saraca asoca with β-lactam antibiotics and studies on the in silico possible mechanism[J]. J Asian Nat Prod Res, 2016, 18(2): 172-183.
[65]Chang Y W, Huang W C, Lin C Y, et al. Tellimagrandin II, a type of plant polyphenol extracted from Trapa bispinosa inhibits antibiotic resistance of drug-resistant Staphylococcus aureus[J]. Int J Mol Sci, 2019, 20(22).
[66]Dai J, Han R, Xu Y, et al. Recent progress of antibacterial natural products: Future antibiotics candidates[J]. Bioorg Chem, 2020, 101: 103922.
[67]Worthington R J, Melander C. Combination approaches to combat multidrug-resistant bacteria[J]. Trends Biotechnol, 2013, 31(3): 177-184.
[68]Pemovska T, Bigenzahn J W, Superti-Furga G. Recent advances in combinatorial drug screening and synergy scoring[J]. Curr Opin Pharmacol, 2018, 42: 102-110.
[69]Borisy A A, Elliott P J, Hurst N W, et al. Systematic discovery of multicomponent therapeutics[J]. Proc Natl Acad Sci USA, 2003, 100(13): 7977-7982.
[70]Yadav B, Wennerberg K, Aittokallio T, et al. Searching for drug synergy in complex dose-response landscapes using an interaction potency model[J]. Comput Struct Biotechnol J, 2015, 13: 504-513.
[71]Van Vuuren S, Viljoen A. Plant-based antimicrobial studies--methods and approaches to study the interaction between natural products[J]. Planta Med, 2011, 77(11): 1168-1182.
[72]Roemer T, Davies J, Giaever G, et al. Bugs, drugs and chemical genomics[J]. Nat Chem Biol, 2011, 8(1): 46-56.
[73]Pathania R, Zlitni S, Barker C, et al. Chemical genomics in Escherichia coli identifies an inhibitor of bacterial lipoprotein targeting[J]. Nat Chem Biol, 2009, 5(11): 849-856.
[74]Li X, Zolli-Juran M, Cechetto J D, et al. Multicopy suppressors for novel antibacterial compounds reveal targets and drug efflux susceptibility[J]. Chem Biol, 2004, 11(10): 1423-1430.
[75]Nonejuie P, Burkart M, Pogliano K, et al. Bacterial cytological profiling rapidly identifies the cellular pathways targeted by antibacterial molecules[J]. Proc Natl Acad Sci U S A, 2013, 110(40): 16169-16174.
