艾地苯醌联合丁苯酞软胶囊治疗脑梗死的临床研究
2022-05-26冯国平
冯国平,黑 雁
陕西省延安市宜川县人民医院:1.内二科;2.呼吸与危重症科,陕西延安 716200
脑梗死是由于脑组织血液灌注障碍引起局部脑组织缺氧缺血性坏死的临床综合征,其病理机制包括氧化应激反应、线粒体功能障碍、非感染性炎性反应、兴奋性氨基酸毒性等[1]。丁苯酞具有较强的抗脑缺氧作用,能阻断脑梗死的多个病理环节,能增加缺血区的血液灌注,降低神经细胞损伤[2]。艾地苯醌属于线粒体保护剂,具有较强的抗氧化作用,能清除氧化自由基,改善脑出血能量代谢水平,对神经系统具有保护作用[3]。本研究对50例脑梗死患者在给予丁苯酞软胶囊治疗的基础上联合艾地苯醌治疗,现将结果总结如下。
1 资料与方法
1.1一般资料 选择2019年7月至2021年5月在宜川县人民医院就诊的100例脑梗死患者作为研究对象。其中男39例,女61例;年龄41~79岁,平均(59.19±6.11)岁;病程9~37 h,平均(20.51±5.82)h;梗死部位分为基底节34例,脑叶43例,脑干23例。按照随机数字表法将所有患者分为治疗组和对照组,各50例。治疗组男18例,女32例;年龄41~79岁,平均(59.32±6.14)岁;病程9~37 h,平均(20.84±5.76)h;梗死部位:基底节16例,脑叶23例,脑干11例。对照组男21例,女29例;年龄42~77岁,平均(59.04±6.03)岁;病程9~36 h,平均(20.09±5.93)h;梗死部位:基底节18例,脑叶20例,脑干12例。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经宜川县人民医院伦理委员会批准(批准号:LL20190508)。
1.2纳入和排除标准 纳入标准:(1)满足脑梗死的诊断标准[4],经影像学检查确诊;(2)首次发病;(3)患者签订知情同意书;(4)依从性良好,可配合完成整个研究。排除标准:(1)严重心、肝、肺、肾等功能不全;(2)对本研究使用的药物过敏;(3)有活动性出血或出血倾向;(4)精神异常、无法正常交流;(5)近14 d有相关药物治疗史;(6)脑肿瘤、脑外伤、颅内占位病变;(7)参与其他临床试验。
1.3方法 对照组:口服丁苯酞软胶囊(恩必普药业有限公司,规格0.1 g,国药准字H20050299,批号:20190617、20200809、20210111),每天3次,每次0.2 g,连续治疗14 d。治疗组:在对照组基础上口服艾地苯醌片(深圳海王药业有限公司,规格30 mg,国药准字H10970363,生产批号:20190605、20200912、20210121),每天3次,每次30 mg,连续治疗14 d。采集两组患者治疗前后空腹时的外周静脉血4~6 mL,在CS21型全自动生化分析仪(上海寰熙医疗器械有限公司)上应用化学比色法检测血清谷胱甘肽过氧化物酶(GSH-PX)、丙二醛(MDA)水平,应用酶联免疫吸附试验测定血清脂质过氧化物(LPO)的水平。采用彩色多普勒超声仪(瑞华DU8-M6型)检测患者中央脑动脉血流动力学水平,包括平均血流速度、阻力指数、搏动指数。采用静力触探试验检测患者治疗前后缺血低灌注区面积。由3名影像学医师共同分析脑灌注参数图,取3名医生分析结果的平均值。对比两组的药物安全性,记录药物相关不良反应的发生情况,包括恶心、转氨酶升高、皮疹、腹部不适、失眠等。
1.4疗效标准 采用美国国立卫生研究院卒中量表(NIHSS)评分评估患者治疗前后神经功能的变化,包括意识水平、视野、上肢运动、下肢运动、感觉等内容,分值45分,评分越低则神经功能缺损程度越轻[5]。疗效指数=(治疗前NIHSS评分-治疗后NIHSS评分)/治疗前NIHSS评分×100%。(1)基本痊愈,病残0度,疗效指数>90%~100%;(2)显著进步,病残1~3度,疗效指数>45%~90%;(3)进步,疗效指数18%~45%;(4)无变化,疗效指数<18%。总有效率=(进步例数+显著进步例数+基本痊愈例数)/总例数×100%。

2 结 果
2.1两组治疗效果对比 治疗组的总有效率(84.00%)明显高于对照组(66.00%),差异有统计学意义(P<0.05)。见表1。
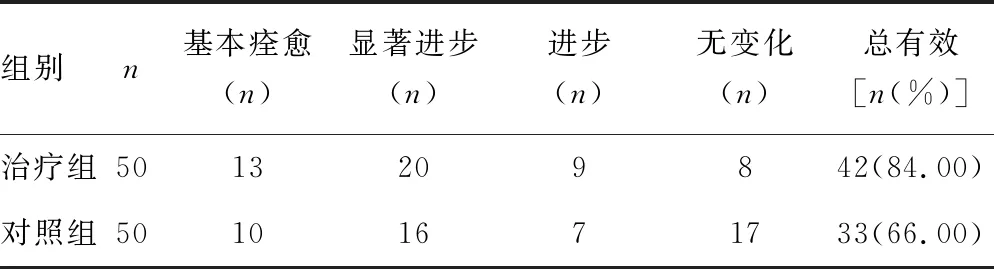
表1 两组治疗效果对比
2.2两组神经功能比较 两组治疗后的NIHSS评分均较治疗前明显降低,治疗组较对照组降低更明显,差异均有统计学意义(P<0.05)。见表2。

表2 两组NIHSS评分对比分)
2.3两组氧化反应指标对比 治疗前,两组GSH-PX、MDA、LPO水平比较,差异无统计学意义(P>0.05);两组治疗后GSH-PX水平明显上升,MDA、LPO水平明显下降,差异有统计学意义(P<0.05);治疗组的GSH-PX高于对照组,MDA、LPO水平低于对照组,差异有统计学意义(P<0.05)。见表3。

表3 两组GSH-PX、MDA、LPO对比
2.4两组血流动力学参数对比 治疗前,两组平均血流速度、阻力指数、搏动指数比较,差异无统计学意义(P>0.05);两组治疗后平均血流速度明显升高,阻力指数、搏动指数明显降低,差异有统计学意义(P<0.05);治疗组治疗后平均血流速度比对照组高,阻力指数、搏动指数比对照组低,差异有统计学意义(P<0.05)。见表4。

表4 两组血流动力学参数对比
2.5两组的缺血低灌注区面积对比 治疗前,两组的缺血低灌注区面积比较,差异无统计学意义(P>0.05);治疗后,两组的缺血低灌注区面积明显降低,治疗组较对照组降低更明显,差异有统计学意义(P<0.05)。见表5。
表5 两组缺血低灌注区面积对比
2.6两组药物安全性对比 两组药物相关总不良反应发生率比较,差异无统计学意义(P>0.05)。见表6。
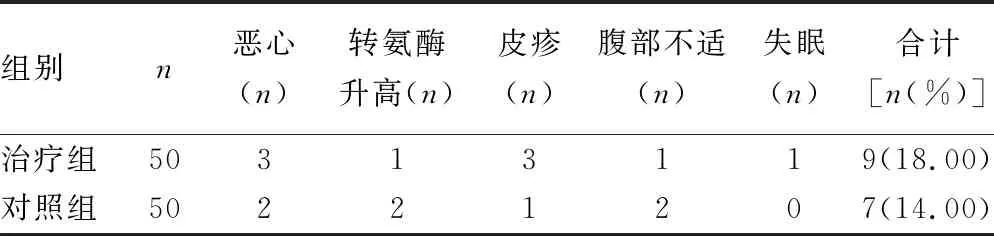
表6 两组药物安全性对比
3 讨 论
脑梗死是临床常见的脑血管病变,具有较高的发病率、致残率、病死率[6]。随着老龄化加剧和诊断技术的进步,脑梗死的患病率呈升高趋势,其中约60%的患者脑梗死后,有不同程度的偏瘫、失语、吞咽困难等并发症,给家庭和社会带来沉重负担[7]。临床治疗脑梗死的关键在于挽救濒死缺血半暗带区受损的脑细胞,控制病情发展,减轻脑组织损伤[8]。丁苯酞可以通过提高线粒体膜流动性、膜电位、呼吸链功能等途径,对线粒体发挥全面的保护作用,明显减轻脑缺血引起的线粒体功能异常症状,抑制半暗带区神经元凋亡,提高脑组织血流量和微血管数量,保护血管内皮细胞和神经功能[9]。
脑梗死患者由于脑血管狭窄或闭塞引起局部脑组织处于缺氧缺血状态,可产生大量的氧化自由基[10]。而脑组织中含有大量的不饱和脂肪酸,在脑梗死发病时,易受到氧化自由基攻击,引起脂质过氧化连锁反应,造成脑组织细胞凋亡和坏死,形成半暗带区[11]。艾地苯醌能促使细胞线粒体产生能量,可顺利通过血脑屏障,激活脑细胞线粒体,改善缺血区域脑组织的能量代谢水平,提高葡萄糖利用率,减轻神经元的氧化应激损伤,抑制膜脂质过氧化反应,加快线粒体的能量合成,减轻和修复脑损伤[12]。本研究结果显示,治疗后,治疗组临床疗效优于对照组,缺血低灌注区面积小于对照组,NIHSS评分低于对照组,差异均有统计学意义(P<0.05),提示艾地苯醌联合丁苯酞软胶囊治疗脑梗死的疗效确切,能有效减小缺血灌注区面积,改善神经功能。
在健康状态下,机体抗氧化和氧化反应处于相对平衡的状态,当脂质过氧化反应增加时,大量的氧化自由基可攻击神经系统的不饱和脂肪酸,改变神经组织膜的通透性,引起组织水肿、细胞溶解和溶酶体破裂,导致神经细胞损伤[13]。GSH-PX属于过氧化物分解酶,能清除氧化自由基水平,抑制脂质过氧化反应,降低神经细胞的过氧化损伤[14]。MDA是脂质氧化损伤的重要敏感指标,与脑梗死的病情严重程度密切相关[15]。LPO是氧自由基与不饱和脂肪酸形成的产物,机体脂质过氧化反应提高后可引起LPO的升高,引起细胞膜结构和功能损伤[16]。本研究结果显示,治疗后,治疗组GSH-PX水平高于对照组,MDA、LPO水平低于对照组(P>0.05)。提示艾地苯醌联合丁苯酞软胶囊能进一步调节脑梗死患者氧化反应,有助于降低神经组织的氧化损伤。
脑梗死存在脑组织血流灌注不足,血流动力学水平存在障碍,平均血流速度能间接反映脑组织的血流量,阻力指数可反映血管阻力,搏动指数可反映血管舒缩功能[17]。本研究结果显示,治疗组治疗后的平均血流速度比对照组高,阻力指数、搏动指数比对照组低(P<0.05)。提示艾地苯醌联合丁苯酞软胶囊能进一步改善脑梗死患者脑组织的血流动力学水平,增强脑组织血液灌注量,减轻神经功能损伤。本研究还发现,两组药物相关总不良反应发生率比较,差异无统计学意义(P>0.05),提示艾地苯醌联合丁苯酞软胶囊治疗脑梗死的安全性良好。
综上所述,艾地苯醌联合丁苯酞软胶囊治疗脑梗死的疗效确切,可改善血流动力学水平,降低缺血低灌注区面积,且安全性较好。
