血浆外泌体A1BG-AS1对原发性肝癌诊断及预后评估价值*
2022-05-26曾雅莉
曾雅莉,唐 静
华中科技大学同济医学院附属梨园医院检验科,湖北武汉 430077
原发性肝癌(PHC)是临床常见的恶性肿瘤,主要发生在肝细胞或胆管细胞,其主要病理类型为肝细胞癌(HCC),其患病率在我国恶性肿瘤位列第四位,死亡率居第三位,严重威胁患者生命健康[1]。长链非编码RNA(lncRNA)可参与肝癌细胞的增殖、侵袭、转移等过程,外泌体是直径40~100 nm的小囊泡,内含蛋白质、miRNA、lncRNA等,可参与调节细胞信号传导,其中外泌体lncRNA可参与基因调控、细胞增殖等,同时也参与肝癌的发生、发展[2]。郭静等[3]研究表明,高表达lncRNA H19的外泌体可明显促进肝癌细胞的增殖、迁移和侵袭能力。A1BG反义RNA 1(A1BG-AS1)为lncRNA的一种,已有研究显示,A1BG-AS1在HCC组织明显低表达,与微血管侵犯、肿瘤分级高、肿瘤分期晚期和患者预后不良有关,过表达A1BG-AS1可明显抑制HCC细胞的增殖、迁移与侵袭[4]。但是关于A1BG-AS1在肝癌患者血浆外泌体中表达及意义的报道较少。本研究通过检测PHC患者血浆外泌体A1BG-AS1水平变化,探讨A1BG-AS1与患者临床病理特征及预后的关系。
1 资料与方法
1.1一般资料 选取2016年12月至2018年6月在本院进行治疗的75例PHC患者作为PHC组。其中男43例,女32例;年龄37~73岁,平均(55.60±8.70)岁。收集PHC患者肿瘤大小、肿瘤分期、肝功能分级、淋巴结转移、肝硬化及甲胎蛋白(AFP)水平等临床病理特征资料。纳入标准:(1)符合《原发性肝癌诊治规范(2011)》标准[5];(2)病理诊断为HCC;(3)临床资料完整。排除标准:(1)合并其他恶性肿瘤或转移性肝癌;(2)合并心、肺、肾等严重基础疾病;(3)失访及未按规定定期随访。选取单纯肝硬化患者26例作为肝硬化组,均符合肝硬化诊断标准[6],其中男15例,女11例;年龄37~75岁,平均(56.4±8.90)岁。选取50例同期体检健康者作为对照组,其中男29例,女21例;年龄38~76岁,平均(56.1±8.50)岁。各组性别、年龄等一般资料比较,差异均无统计学意义(P>0.05)。本研究获得本院医学伦理委员会批准,患者或其家属均知情同意,并自愿签署知情同意书。
1.2仪器与试剂 ExoQuick exosome提取试剂盒购自美国System Biosciences公司,热休克蛋白70(HSP70)抗体和CD63抗体购自Abcam公司,RNA提取试剂盒购自Thermo Fisher Scientific公司;逆转录试剂盒及SYBR Green PCR Master Mix Kit购自TaKaRa公司;JEM-2100透射电子显微镜购自日本电子株式会社,ABI 7500荧光定量PCR仪购自美国赛默飞世尔科技公司。
1.3方法
1.3.1血浆外泌体提取与鉴定 所有入组人员抽取静脉血6 mL,装入含乙二胺四乙酸(EDTA)抗凝管后,3 000 r/min,离心10 min,收集血浆,使用ExoQuick exosome提取试剂盒提取外泌体,使用2%磷钨酸染色后用透射电子显微观察,蛋白质印迹法检测外泌体标志蛋白HSP70和CD63表达。
1.3.2血浆外泌体A1BG-AS1检测 采用实时荧光定量PCR(RT-qPCR)检测血浆外泌体A1BG-AS1相对表达量。RNA提取试剂盒(Thermo Fisher Scientific)提取血清外泌体总RNA,使用逆转录试剂盒合成cDNA后,使用SYBR Green PCR Master Mix Kit(TaKaRa)进行RT-qPCR扩增。A1BG-AS1上游引物序列为5′-CTTACTGGGCAGCATTG-3′,下游引物序列为5′-GAACATGTCTGCGTATCTC-3′;GAPDH上游引物序列为5′-CTCGCTTCGGCAGCACA-3′,下游引物序列为5′-AACGCTTCACGAATTTGCGT-3′。以GAPDH为内参,采用2-ΔΔCt法计算血浆外泌体A1BG-AS1相对表达量。
1.3.3随访 PHC患者治疗后,对所有患者进行随访,统计患者生存情况,随访日期截至2021年6月30日,总随访时间为36个月,所有患者完成随访,随访率为100%。

2 结 果
2.1血浆外泌体的鉴定 透射电镜观察提取的血浆外泌体,可见30~100 nm大小圆形或椭圆形囊泡,外泌体可特异性表达HSP70、CD63。见图1。
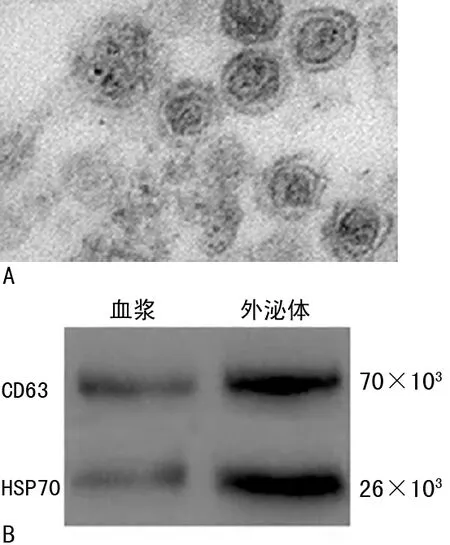
注:A为透射电镜下血浆外泌体形态,放大倍数为50 000倍;B为Western blotting检测外泌体标志蛋白HSP70和CD63表达。
2.2PHC组、肝硬化组、对照组血浆外泌体A1BG-AS1表达水平比较 对照组、肝硬化组、PHC组血浆外泌体A1BG-AS1表达水平分别为1.13±0.24、0.75±0.18、0.43±0.11,3组间比较差异有统计学意义(F=240.812,P<0.01);两两比较显示,肝硬化组、PHC组血浆外泌体A1BG-AS1表达水平明显低于对照组(P<0.01),PHC组血浆外泌体A1BG-AS1表达水平明显低于肝硬化组(P<0.01)。
2.3血浆外泌体A1BG-AS1、AFP单独和联合检测对PHC的诊断价值 ROC曲线分析显示,血浆外泌体A1BG-AS1单独检测诊断PHC的曲线下面积(AUC)为0.842(95%CI:0.774~0.896),约登指数为0.722,截断值为0.61,灵敏度为89.33%,特异度为82.89%;AFP单独检测诊断PHC的AUC为0.829(95%CI:0.759~0.885),约登指数为0.523,截断值为208.62 ng/mL,灵敏度为76.00%,特异度为76.32%;A1BG-AS1、AFP联合检测诊断PHC的AUC为0.898(95%CI:0.839~0.941),约登指数为0.657,灵敏度为90.67%,特异度为75.00%。见图2。

图2 血浆外泌体A1BG-AS1、AFP单独和联合检测诊断PHC的ROC曲线
2.4PHC患者血浆外泌体A1BG-AS1表达水平与临床病理特征关系 根据PHC患者血浆外泌体A1BG-AS1表达水平的均值,将PHC患者分为高表达组(38例)和低表达组(37例),χ2检验显示,不同肿瘤分期、肝功能分级和有无淋巴结转移PHC患者血浆外泌体A1BG-AS1表达情况差异有统计学意义(P<0.05)。见表1。

表1 PHC患者血浆外泌体A1BG-AS1表达水平与临床病理特征关系
2.5PHC患者血浆外泌体A1BG-AS1水平与预后关系 Kaplan-Meier生存曲线分析显示,A1BG-AS1高表达PHC患者的3年生存率明显高于A1BG-AS1低表达PHC患者,差异有统计学意义(χ2=6.857,P=0.009)。见图3。
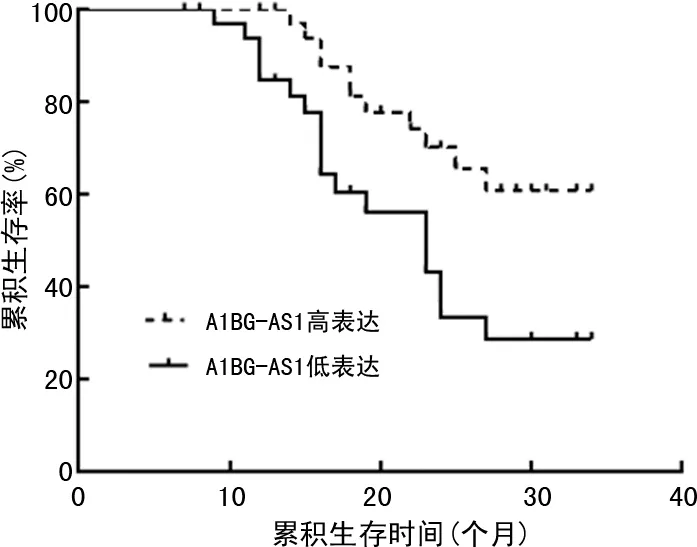
图3 不同血浆外泌体A1BG-AS1表达水平的PHC患者生存曲线
2.6影响PHC患者预后的危险因素分析 Cox回归模型单因素分析结果显示,肿瘤分期为T3~T4、有淋巴结转移、A1BG-AS1低表达是影响PHC患者预后的危险因素(P<0.05);多因素分析结果显示,肿瘤分期为T3~T4、有淋巴结转移、A1BG-AS1低表达是影响PHC患者预后的独立危险因素(P<0.05)。见表2。

表2 影响PHC患者预后的危险因素分析结果
3 讨 论
PHC是临床常见恶性肿瘤之一,因其有生长活跃、侵袭性强等特点,早期易发生转移,术后易复发,进而影响患者生存。血清AFP是诊断肝癌的标志物,但是灵敏度不高,因此,寻找其他肿瘤标志物,以及对肝癌患者进行早期筛查和预后判断对肝癌患者的治疗有重要意义[7]。
细胞在正常状态与病理条件下均可分泌外泌体,外泌体中含有蛋白质、lncRNA等,可在细胞间进行信息传递,并影响靶细胞中的信号通路,进而参与机体的病理生理过程。lncRNA是一类非编码RNA,通过调控相关基因表达参与细胞周期、细胞迁移等多种生理过程,有研究报道,多种lncRNA与肝癌复发、诊断、预后、疾病进展和耐药性有关[8]。lncRNA可通过调节肿瘤血管生成、免疫系统活性、上皮间质转化及竞争性内源miRNA等多种机制参与肝癌的发生、发展及转移。吴锋等[9]研究显示,lncRNA ZFAS1在HCC患者血清外泌体中高表达,与HCC患者肿瘤分期、Child-pugh分级、AFP水平、淋巴转移及预后有关,检测血清外泌体lncRNA ZFAS表达水平对诊断HCC有一定参考价值,可作为HCC患者诊断及预后判断的参考指标。A1BG-AS1为lncRNA的一种,有研究显示,A1BG-AS1通过海绵miRNA-485-5p调控脂阀结构蛋白1的表达,调控乳腺癌细胞增殖、凋亡、迁移与侵袭[10]。关于A1BG-AS1在其他肿瘤外泌体中的表达的报道较少。本研究结果显示,PHC组患者血浆外泌体A1BG-AS1表达水平明显低于肝硬化组,肝硬化组血浆外泌体A1BG-AS1表达水平明显低于对照组,提示A1BG-AS1可能与PHC的发生有关。目前,A1BG-AS1在乳腺癌组织与HCC组织中呈异常表达,而本研究发现其在PHC患者血浆外泌体也存在异常表达,但本研究临床样本量较小,可能存在一定局限性,其在PHC中是否具有特异性有待进一步验证。进一步分析血浆外泌体A1BG-AS1表达水平与PHC患者临床病理特征关系显示,PHC患者血浆外泌体A1BG-AS1表达水平与肿瘤分期、肝功能分级和淋巴结转移有关,与BAI等[4]研究结果一致,提示血浆外泌体A1BG-AS1低表达促进PHC进展与淋巴结转移,推测A1BG-AS1在肝癌的发生、发展中发挥抑癌作用。本研究结果显示,本研究血浆外泌体A1BG-AS1诊断PHC的AUC为0.842(95%CI:0.774~0.896),灵敏度为89.33%,特异度为82.89%,提示检测血浆外泌体A1BG-AS1对PHC具有一定诊断价值,A1BG-AS1、AFP联合检测诊断PHC的AUC为0.898(95%CI:0.839~0.941),灵敏度为90.67%,特异度为75.00%,表明A1BG-AS1、AFP联合检测诊断PHC的诊断效能较高,有一定临床应用价值。
本研究结果显示,A1BG-AS1高表达PHC患者的3年生存率明显高于A1BG-AS1低表达PHC患者,提示血浆外泌体A1BG-AS1低表达患者生存率较低,检测血浆外泌体A1BG-AS1表达水平可预测PHC患者预后。进一步Cox回归模型单因素和多因素分析结果显示,肿瘤分期为T3~T4、有淋巴结转移、A1BG-AS1低表达是影响PHC患者预后的独立危险因素,提示血浆外泌体A1BG-AS1表达水平可影响患者预后,其可能作为判断PHC患者预后情况的分子标志物。
综上所述,PHC患者血浆外泌体A1BG-AS1低表达,其与患者临床病理特征和预后有关,且血浆外泌体A1BG-AS1、AFP联合检测对PHC有较高诊断价值,可作为PHC诊断与判断预后的标志物,但具体机制尚不清楚,仍需做进一步研究。
