miR-27a在原发性痛风关节炎患者中的表达水平及生物信息学分析*
2022-05-26苟海梅李九龙郭晓兰钟晓武
苟海梅,陈 莹,徐 磊,李九龙,郭晓兰,,钟晓武,△
1.川北医学院附属医院检验科,四川南充 637000;2. 川北医学院检验系,四川南充 637000; 3.川北医学院转化医学研究中心,四川南充 637000;4.南充市第五人民医院检验科,四川南充 637100
痛风是机体嘌呤代谢紊乱、血尿酸水平持续升高而导致单钠尿酸盐(MSU)晶体析出并沉积于组织或器官而引起反复发作性炎性疾病[1]。近年来,随着生活水平不断提高,痛风的发病率逐年呈上升趋势,已成为临床常见病、多发病,且痛风发病年龄有向低龄化发展趋势[2]。MSU晶体的沉积是痛风发生的重要物质基础,但痛风发病机制及炎症自限的确切分子机制尚未完全阐明,仍是目前亟待解决的问题。
微小RNA(miRNA)是一类由22~24 个核苷酸组成的高度保守性内源性非编码小RNA,它通过与mRNA的3′非翻译区(3′UTR)特异性结合降解靶mRNA和(或)抑制靶mRNA的表达及翻译,进行转录后调控[3]。多项研究表明,miRNA在痛风发病机制中有关键性调控作用[4-6]。miR-27a在骨性关节炎[7]及系统性红斑狼疮[8]中均表达异常呈下调趋势,提示miR-27a与炎性反应负调控相关。已有研究表明,miR-27a在痛风患者中存在异常表达,其可能作为炎症负性调控因子参与痛风的炎症免疫反应[9],但其与痛风发生相关的确切靶分子机制尚不清楚。本研究运用生物信息学分析方法预测miR-27a作用的靶基因,对其靶基因进行GO富集分析、KEGG信号通路富集分析,为痛风炎症免疫反应研究提供理论依据及数据支持。
1 资料与方法
1.1一般资料 将川北医学院附属医院风湿免疫科就诊的20例男性原发性痛风性关节炎(PGA)患者纳入PGA组,将20例体检健康男性纳入健康对照组。其中,PGA组平均年龄(44.30±13.27)岁,健康对照组平均年龄(47.70±12.65)岁,两组年龄比较,差异无统计学意义(P>0.05)。
1.2方法
1.2.1miRNA检测 采用人外周血淋巴细胞分离液(天津灏洋公司)对人外周血单个核细胞(PBMC)进行分离,并用Trizol试剂盒(美国 Invitrogen公司)一步法提取人外周血单个核细胞总RNA,同时用紫外分光光度仪进行浓度测定。采用TaqMan MicroRNA Assays 试剂盒(美国Life Technologies公司)将miR-27a逆转录为 cDNA,并采用实时荧光定量PCR进行扩增及荧光检测,以 U6为内参,严格按照说明书指示完成检测操作。采用2-ΔΔCt法分析miRNA的相对表达量。
1.2.2miR-27a在人类基因组中的位置及保守性分析 应用UCSC基因组在线软件工具(http://genome.ucsc.edu/)分析miR-27a在人类基因组中的位置,查找不同物种间的成熟序列并分析其保守性。
1.2.3miR-27a靶基因筛选 应用TargetScan (http://www.targetscanorg/)数据库,miRDB(http://mirdb.org/)数据库和RNA22(https://cm.jefferson.edu/rna22/precomputed/)数据库分别预测 miR-27a 靶基因,同时运用GeneCards数据库(http://www.genecards.org/)查询与痛风发病相关的疾病基因。为了增加预测结果的可靠性,将4种数据库的预测结果取交集作为与痛风发病相关的miR-27a靶基因。
1.2.4miR-27a靶基因的功能注释 应用DAVID数据库(https://david.ncifcrf.gov/)对miR-27a预测靶基因集合进行GO富集分析和KEGG通路富集分析。GO富集分析包括生物过程、细胞组分和分子功能。

2 结 果
2.1miR-27a在人类基因组中的位置及保守性分析 应用UCSC基因组在线软件获取miR-27a在人类基因组中的位置(图1),miR-27a定位于人类19q13.12染色体上chr19:13 836 440-13 836 517位置,长度共78 bp,其核苷酸序列在人、黑猩猩、大猩猩、猕猴、狒狒、小鼠、狗、大象物种中呈高度保守。

图1 miR-27a 在基因组中的位置和保守性分析
2.2miR-27a 在PGA患者中的表达 应用实时荧光定量PCR法检测PGA组和健康对照组PBMC中miR-27a的相对表达水平,结果显示,miR-27a在PGA组患者中的相对表达水平明显低于健康对照组,差异有统计学意义(P<0.05)。见图2。
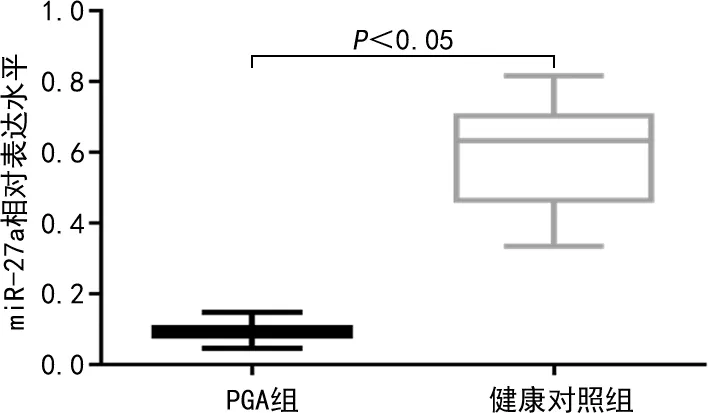
图2 miR-27a 在PGA组和健康对照组中的表达水平
2.3筛选与痛风发病相关的miR-27a靶基因 应用TargetScan、miRDB和RNA22数据库分别预测miR-27a的靶基因,然后对miR-27a靶基因结果取交集,共得到 585个潜在调控靶基因。此外,在GeneCards数据库中查询与痛风发病相关基因共980个基因。将GeneCards数据库所得基因与585个潜在调控靶基因再次取交集,最终得到MAPK14、RFX3、ABCA1、HS2ST1、ENPEP和CACNA2D3等共33个与痛风发病相关的miR-27a靶基因。见图3。
2.4预测靶基因的GO富集分析 对与痛风发病相关的miR-27a靶基因进一步进行GO富集分析,GO富集分析结果显示:miR-27a的靶基因显著富集到生物过程调节、细胞过程调节、有机物代谢过程、多细胞生物过程、生物过程正调控、对外界刺激的反应、主要代谢调节等多个生物学过程中;富集到质膜的外侧、细胞表面、血影蛋白细胞骨架及细胞膜的细胞组分;富集有机环化合物结合、蛋白结合、催化活性、离子结合等分子功能。见表1。

图3 miR-27a靶基因预测
2.5预测靶基因的KEGG信号通路分析 对与痛风发病相关的miR-27a靶基因进一步进行KEGG功能富集分析,KEGG信号通路分析显示,miR-27a的靶基因显著富集于MAPK信号通路、癌症相关通路、Rap1信号通路、细胞因子-细胞因子受体相互作用、干细胞多能性调节信号通路、青少年成人起病型糖尿病通路和醛固酮控制的钠盐重吸收通路。见表2。

表1 miR-27a 预测靶基因 GO 富集分析结果

续表1 miR-27a 预测靶基因 GO 富集分析结果
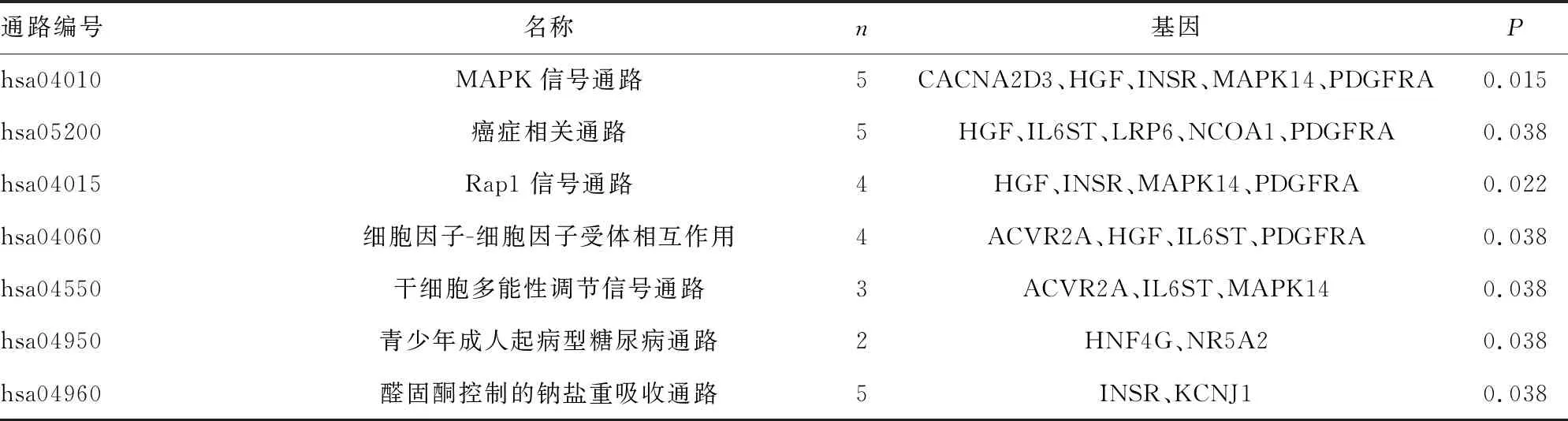
表2 miR-27a预测靶基因 KEGG 信号通路分析
3 讨 论
miRNA作为调控分子,可同时调节多个靶基因,参与生物体细胞信号转导通路调节,从而对细胞特定功能和表型进行有效调控,发挥生物学功能[3]。现有研究表明,miRNA与免疫功能失调、多种慢性炎症或自身免疫病等相关[10-11]。通过UCSC基因组在线软件分析,miR-27a核苷酸序列在多个物种中呈高度保守,提示其发生突变的概率低,有潜在的重要生物学功能。本研究对PGA组和健康对照组中miR-27a基因表达进行了检测,发现在PGA组中miR-27a基因表达水平较健康对照组明显降低,与李宁宁等[9]研究结果一致,进一步提示miR-27a可能作为炎症负性调控因子在痛风的炎症免疫反应过程中起到重要作用。
为进一步分析miR-27a参与痛风炎症免疫反应相关的靶分子机制,准确预测其靶基因,本研究运用TargetScan、RNA22和miRDB 3个使用较多的靶基因预测软件,取3个软件共同预测的靶基因作为结果,利用不同软件、不同算法从多角度分析,以增强预测结果的可靠性。本研究再将生物信息学方法预测的靶基因和 GeneCards数据库中与痛风相关的基因联合分析,取交集最终得到MAPK14、RFX3、ABCA1、HS2ST1、ENPEP、CACNA2D3等33个潜在的靶基因。MAPK14(即p38α)是p38MAPK最重要的亚型之一,p38MAPK信号通路与炎性反应调控密切相关。有研究显示,p38MAPK信号通路参与调控MSU诱导的单核细胞IL-8表达,进而参与痛风性关节炎的炎性反应[12]。在中国人群全基因组关联分析(GWAS)研究中发现,RFX3是中国人群特有的原发性痛风易感基因[13]。RFX3由胰岛β细胞分泌,可结合到葡萄糖激酶基因的启动子区域,调控其表达,从而影响胰岛β细胞的功能[14]。胰岛β细胞主要参与血糖的调节,糖代谢的紊乱不仅直接影响嘌呤的代谢及尿酸的合成,而且影响尿酸的排泄[15]。因此,RFX3突变可能引起胰岛β细胞功能缺陷,从而直接或间接引起高尿酸血症和痛风。
GO富集分析表明,miR-27a靶基因存在细胞代谢调节及对外界刺激的反应等多种生物学功能。痛风属于代谢性风湿病范畴,与嘌呤代谢紊乱及尿酸排泄减少所致的高尿酸血症相关,高尿酸血症所致的MSU沉积可作为外界刺激反复引起炎性反应。KEGG通路富集分析显示,miR-27a可能通过调控MAPK信号通路、细胞因子-细胞因子受体相互作用和醛固酮控制的钠盐重吸收通路等发挥生物学功能。MAPK信号通路是一类苏氨酸蛋白激酶,可以被细胞外信号或刺激等激活,包括ERK1/2 MAPK、JNK MAPK、p38MAPK等活化途径。目前研究发现,ERK1/2 MAPK、JNK MAPK和p38MAPK通路可诱导前炎症细胞因子IL-8的产生,且参与调控MSU诱导的单核细胞IL-8表达[14,16-17]。在体外MSU诱导的单核细胞模型中发现,中性粒细胞趋化活性90%来自IL-8,而大量中性粒细胞浸润到关节腔并介导炎性反应是痛风性关节炎的核心病理机制[14]。MAPK14是miR-27a预测靶基因,故笔者推测痛风性关节炎经MSU刺激后,miR-27a基因表达水平降低,且作为炎症负性调控因子靶向作用于MAPK14,MAPK14在痛风性关节炎呈高表达,MAPK14经p38MAPK通路诱导单核细胞IL-8表达,IL-8激活中性粒细胞并浸润到关节腔介导痛风炎性反应。近年来的研究发现,IL-1、IL-8、IL-10等细胞因子在痛风性关节炎的发生、发展过程中发挥重要作用[14],miR-27a参与细胞因子-细胞因子受体相互作用,因此miR-27a可能通过细胞因子-细胞因子受体相互作用参与痛风性关节炎的发病机制。醛固酮控制的钠盐重吸收系统失衡会引起肾脏的损伤,进而影响嘌呤的代谢及尿酸的合成,而且影响尿酸的排泄,miR-27a也可能通过参与醛固酮控制的钠盐重吸收直接或间接引起高尿酸血症和痛风。
本研究通过生物信息学分析挖掘miR-27a在痛风炎症免疫反应相关的靶分子机制,结果表明miR-27a可能通过调控多个与痛风发病相关的靶基因,影响多条信号通路的网络调节,从而参与痛风炎症免疫反应机制,进一步为miR-27a调控痛风炎症免疫反应机制及痛风治疗靶点提供了新的依据。
