安罗替尼单药在晚期食管鳞癌患者后线治疗中的疗效及安全性
2022-05-24王静杨雅阁郑晓永郭长青
王静 杨雅阁 郑晓永 郭长青
1河南省直第三人民医院消化内科(郑州 450006);2郑州大学第一附属医院消化内科(郑州 450052)
食管癌是常见的消化系统恶性肿瘤,在我国每年新发病例为32.4 万,死亡病例为30.1 万[1]。在组织学类型方面,东西方存在较大的差异,西方国家主要以食管腺癌为主,而我国的食管癌患者95%左右都是食管鳞癌(esophageal squamous cell carcinoma,ESCC)[2]。目前对于颈段食管鳞癌患者首选放疗,对于可切除的其他类型的食管鳞癌患者,手术切除仍然是最主要的治疗方式。然而,对于无手术切除机会的食管鳞癌患者,同步放化疗和化疗方案也可为患者带来了一定的生存获益[3]。对于转移性的食管鳞癌患者,放疗的作用已经非常有限,目前临床上主要是顺铂联合5-FU 或紫杉醇的化疗方案[4]。一线化疗方案中的顺铂联合5-FU 的方案在转移性食管鳞癌中可以取得33%左右的客观缓解率(objective response rate,ORR),5.5 个月左右的中位无进展生存期(progression free survival,PFS)和10个月左右的中位总生存期(overall survival,OS)[5]。而紫杉醇和顺铂的方案在转移性食管鳞癌患者中ORR 约为42.5%,中位PFS 为7 个月左右,中位OS 为13 个月左右[6]。虽然靶向治疗药物比如尼妥珠单抗等也在一线治疗中联合化疗取得一定的结果,但是较高级别的循证医学尚且有限[7]。
晚期食管鳞癌一线治疗进展后标准治疗为单药化疗方案。伊立替康、多西他赛或紫杉醇均为二线可用的化疗方案。这些单药方案的有效率为7.4%左右,中位PFS 为3 个月左右,中位OS 为7.1 个月左右[8]。此外,免疫检查点抑制剂在二线中也取得了阳性的结果,其中pembrolizumab、nivolumab 和卡瑞利珠单抗均在晚期食管鳞癌二线治疗中进一步给患者带来生存获益[9]。然而,在晚期食管鳞癌后线治疗中目前尚无标准的治疗方案,患者既往接受前线治疗进展后急需有效的治疗药物。盐酸安罗替尼作用于VEGFR、PDFGR、FGFR 和c-Kit 等靶点的抗血管生成小分子TKI,于2018年上市用于晚期非小细胞肺癌患者三线治疗。此外,ALTER1102 研究结果表明安罗替尼在晚期食管鳞癌二线治疗中可以取得7.34%的ORR,3.02个月的中位PFS 和6.11 个月的中位OS[10]。因此,在免疫治疗数据公布之前,安罗替尼可以成为晚期食管鳞癌患者后线治疗的可选方案。然而,目前真实世界中安罗替尼在晚期食管鳞癌患者后线治疗中的疗效及安全性数据尚且缺乏。
因此,本研究旨在探讨真实世界中安罗替尼单药在晚期食管鳞癌患者中的疗效及安全性。另外,针对安罗替尼治疗过程中出现的不良反应和预后进行关联性分析。
1 对象与方法
1.1 研究对象 本研究设计为回顾性分析。整理随访了从2018年6月至2020年10月在郑州大学第一附属医院消化科和肿瘤科接受治疗的晚期食管鳞癌患者。纳入标准:(1)组织学或细胞学确诊的食管鳞癌,为转移性或复发的食管鳞癌患者;(2)东部肿瘤协作组(eastern cooperative oncology group,ECOG)评分在0 ~2 分;(3)按照RECIST 1.1 标准具有可测量的病灶;(4)既往接受过至少一次系统性的治疗方案出现疾病进展或不耐受,包括同步放化疗或系统化疗方案;(5)接受安罗替尼单药的治疗。排除标准:(1)伴有症状或症状控制时间少于3 个月的脑转移患者;(2)原发病灶2 个月内有活动性出血的食管鳞癌患者;(3)吞咽功能障碍的患者;(4)合并其他的恶性肿瘤或者严重疾病的患者。本研究的研究流程图见图1,最终符合研究筛选标准的食管鳞癌患者63 例。研究的主要终点为PFS,次要终点为ORR,DCR,OS和针对不良反应的PFS 预后分析。本研究已获郑州大学第一附属医院伦理委员会批准。

图1 安罗替尼单药在晚期ESCC 患者后线治疗的回顾性分析研究流程图Fig.1 The flow chart of the retrospective study of anlotinib monotherapy as the further line treatment for patients with advanced esophageal squamous cell carcinoma
1.2 治疗方案 纳入研究的晚期食管鳞癌患者均为安罗替尼单药治疗,不过可以接受非靶病灶的局部治疗。安罗替尼的用法用量为:根据患者的体质状态由研究者综合决定患者的安罗替尼的起始剂量,大部分为12 mg,另一小部分为10 mg,早餐前口服,每日1 次,连续用药两周,停药一周,三周为一治疗周期。直至出现疾病进展或不可耐受的不良反应。结合治疗过程中出现的血液学或者非血液学不良反应下调安罗替尼的用药剂量。
1.3 疗效评价 采用RECIST(1.1 版本)进行疗效评估[11]。每两个周期或者根据患者实际的临床症状通过影像学的计算机断层扫描(CT)或核磁共振成像(MRI)方法对靶病灶的变化进行评价。ORR为患者治疗中出现的最佳疗效中的完全缓解(CR)和部分缓解(PR)的比例。DCR 为最佳疗效中的CR 和PR 及疾病稳定(SD)患者的比例。接受安罗替尼单药治疗过程中出现的药物相关不良反应通过美国国立癌症研究所的常见毒性反应标准(CTCAE v4.02 版本)进行评价。记录高血压的发生情况,根据治疗过程中是否出现高血压将患者分为高血压组和非高血压组。
1.4 随访 患者接受安罗替尼治疗进展后的随访主要通过电话方式进行,每1 个月和患者进行一次电话访视获取患者出现疾病进展及后续的治疗情况,电话随访主要获取患者的死亡状态及死亡发生的具体日期。最后一次随访时间为2020年12月28日。PFS 定义为患者开始接受安罗替尼治疗的日期到出现肿瘤进展或者死亡的日期,OS 定义为患者开始接受安罗替尼治疗的日期到因任何原因导致死亡的日期。
1.5 统计学方法 用SPSS 25.0 进行统计分析。计数资料表示为例(%),比较用χ2检验。不符合正态分布的计量资料表示为M(P25,P75),比较用Mann-WhitneyU检验。利用Stata 软件(14.0 版本)绘制Kaplan-Meier 曲线展示患者的PFS 和OS 数据。高血压对PFS 影响的分析采用Log-rank 的方法进行比较。研究最后一次随访日期时尚未出现疾病进展或死亡的,则按照删失数据进行处理。P<0.05 为差异有统计学意义。
2 结果
2.1 晚期食管鳞癌患者的基线临床资料 入组患者的中位年龄为61 岁(范围25 ~81 岁)。其中男46 例,女17 例。ECOG 评分为0 分41 例,1 ~2 分22 例。发生远处转移的患者57 例(90.5%)。既往只接受了一线系统治疗的患者8 例,后线治疗的患者55 例。既往接受过手术治疗的44 例,接受过靶向药物治疗的患者只有8 例。然而,既往接受过免疫治疗(PD-1 抑制剂)的患者11 例。大部分患者未接受过靶向治疗和免疫治疗。安罗替尼的起始剂量为12 mg 的患者48 例(76.2%),10 mg 的患者15 例(23.8%)。治疗过程中35 例出现高血压,28 例未出现高血压。高血压组和非高血压组患者的基线临床资料差异无统计学意义(P>0.05)。见表1。

表1 根据高血压发生状态的63 例晚期ESCC 患者的基线临床资料Tab.1 Baseline characteristics of the 63 patients with ESCC according to hypertension status 例(%)
2.2 安罗替尼单药后线治疗晚期食管鳞癌患者的疗效 63 例食管鳞癌患者的最佳疗效中无CR 患者,PR 患者6 例,SD患者35例,疾病进展(PD)患者22 例。接受安罗替尼单药治疗的晚期食管鳞癌患者的ORR 为9.5%(95%CI:3.6%~19.6%),疾病控制率(DCR)为65.1%(95%CI:52.0%~76.7%)。针对靶病灶大小的最佳百分比变化的瀑布图见图2。此外,其中1 例典型的食管鳞癌伴肝转移和淋巴结转移的患者接受安罗替尼单药治疗4 个周期后的肝部靶病灶和淋巴结靶病灶CT 变化见图3,患者接受安罗替尼治疗后效果较为明显,肝转移靶病灶和淋巴结靶病灶显著缩小。

图2 63 例接受安罗替尼单药治疗的晚期ESCC 患者靶病灶的最大变化的瀑布图(靶病灶直径总和的变化)Fig.2 The waterfall plot of best change(reductions in sum of target lesion diameters)from baseline in the 63 patients with advanced ESCC who received anlotinib monotherapy

图3 食管鳞癌伴肝转移和淋巴结转移患者接受4 个周期安罗替尼治疗后的肝部和淋巴结靶病灶CT 变化图Fig.3 The CT scan results of the changes for target lesions at liver and lymph nodes in one patient with advanced ESCC after 4 cycles of treatment with anlotinib
2.3 安罗替尼单药后线治疗晚期食管鳞癌患者的预后 入组患者从纳入研究到最后一次随访的中位随访时间为7.1 个月(随访时间范围:0.3 ~25 个月)。有54 例患者出现PFS 事件,PFS 数据成熟度为85.7%。63 例接受安罗替尼治疗的晚期食管鳞癌患者的中位PFS 为3.6 个月(95%CI:2.45 ~4.75)。有45 例患者出现OS 事件,OS 数据成熟度为71.4%。63 例患者的中位OS 为7.5 个月(95%CI:5.05 ~9.95)。见图4。
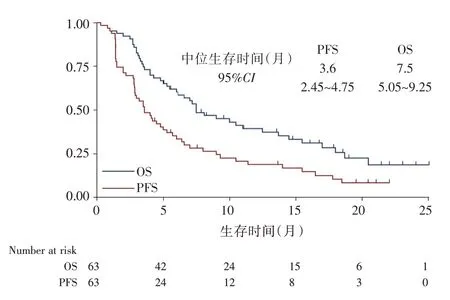
图4 63 例接受安罗替尼单药治疗的晚期ESCC 患者的无进展生存期和总生存期Fig.4 The progression-free survival and overall survival of the 63 patients with advanced ESCC who received anlotinib monotherapy
2.4 安罗替尼单药后线治疗晚期食管鳞癌患者的不良反应情况 安罗替尼单药的治疗整体安全可控,研究过程中未观察到5 级不良反应的发生。安罗替尼单药引起的常见的不良反应主要有高血压、疲劳、食欲下降、手足综合征(HFS)、AST∕ALT升高、腹泻、蛋白尿、恶心呕吐、血液学毒性和出血。其中,3 ~4 级的不良反应有高血压、乏力、食欲下降、HFS、AST∕ALT 升高、蛋白尿、血液学毒性和出血,发生率分别为14.3%、3.2%、4.8%、7.9%、4.8%、6.3%、3.2%和1.6%。
63 例患者接受安罗替尼治疗过程中,共有9 例(14.3%)患者由于高血压等不良反应进行了剂量下调。此外,也有3例(4.8%)患者分别因为高血压、AST∕ALT 升高和血液学毒性导致治疗中断。治疗过程中,共35 例患者出现安罗替尼引起的高血压,其中既往有高血压病史的患者22例(62.9%),无高血压病史患者9 例(25.7%),无法评价的患者4 例(11.4%)。见表2。

表2 接受安罗替尼单药治疗的63 例晚期ESCC 患者中不良反应发生情况Tab.2 The safety profile of the 63 patients with advanced ESCC who received anlotinib monotherapy 例(%)
2.5 高血压组和非高血压组的PFS 高血压组合非高血压组的中位PFS 分别为4.8 个月(95%CI:3.2 ~7.0)和2.8 个月(95%CI:1.41 ~3.6),差异有统计学意义(χ2=4.70,P=0.03)。见图5。

图5 63 例接受安罗替尼单药治疗的晚期食管鳞癌患者中根据高血压发生情况的无进展生存期对比Fig.5 The Progression-Free Survival of the 63 patients with advanced ESCC who received anlotinib monotherapy according to hypertension status
2.6 Cox 回归分析PFS 影响因素 高血压、ECOG评分是PFS 的独立影响因素(HR=1.67、1.51,P=0.035、0.021)。

表3 针对PFS 的多变量Cox 回归分析Tab.3 Multivariate Cox Regression Analysis for PFS
3 讨论
近年来在晚期食管鳞癌领域相关的研究进展不算太多,经典的铂类联合5-FU 或紫杉醇的方案在临床上已经使用超过20年,靶向药物在晚期食管鳞癌中的探索均未取得阳性结果[12-13]。不过从2019年开始免疫检查点抑制剂在晚期食管鳞癌中逐步取得了突破性研究进展。最早的Keynote181研究和Attraction 3 研究分别奠定了pembrolizumab和nivolumab 在晚期食管鳞癌患者二线治疗中的地位,不过这两个研究纳入的并不完全是食管鳞癌患者,价值相对有限[14]。ESCORT 研究则在中国食管鳞癌患者中开展,证实了卡瑞利珠单抗在晚期食管鳞癌患者二线治疗中的地位[9]。然而,在晚期食管鳞癌后线治疗中目前尚无标准方案。安罗替尼作为小分子TKI 逐步填补了这方面的空白[10]。
本研究中63 例接受安罗替尼治疗的晚期食管鳞癌患者的ORR 为9.5%,DCR 为65.1%,中位PFS为3.6 个月。研究结果和HUANG 等[10]的Alter1102研究结果基本一致。HUANG 等[10]纳入109 例二线或后线接受安罗替尼治疗的转移性食管鳞癌患者,结果表明安罗替尼组患者的ORR 为7.3%,DCR为64.2%,中位PFS 为3.02 个月。此外,邵岚等[15]入组了22 例复发转移性食管鳞癌患者接受安罗替尼单药的治疗[15],结果表明ORR 为9.1%,DCR 为77.3%,该研究的结果和本研究的结果基本一致。然而,邵岚等[15]发现22 例食管鳞癌患者的中位PFS 为4.13 个月,高于本研究的中位PFS。原因可能和邵岚等[15]的研究样本量相对较小有关,PFS数据可能存在一定的偏倚,而且由于随访时间不够,未能评价患者的OS。然而,由于本研究为回顾性分析,在真实世界中患者失访比例相对较高,本研究的PFS 数据成熟度为85.7%,而Alter1102 研究中数据成熟度超过90%,这在一定程度上也会影响患者预后的数据[16]。由于随访时间相对较长,本研究也进行了OS的评价。研究结果表明63 例接受安罗替尼单药治疗的晚期食管鳞癌患者的中位OS 为7.5 个月。这要长于Alter1102 研究中的中位OS(安罗替尼组OS=6.1 个月)。可能的原因是近两年来随着免疫治疗药物陆续上市,更多的食管鳞癌患者在前线或后线治疗中都可以有机会接受PD-1∕PD-L1 抑制剂的治疗。本研究中有11例患者既往曾接受过免疫抑制剂的治疗。此外,也有患者接受其他的抗血管生成小分子TKI 比如阿帕替尼的治疗。这也可以给晚期食管鳞癌患者带来生存获益[17]。实际上,本研究中的部分患者在安罗替尼治疗进展后又接受了免疫药物和其他的抗血管生成小分子药物的治疗,这在一定程度上都给患者带来了生存获益。
安全性分析方面,本研究结果表明安罗替尼单药治疗过程中常见的不良反应主要有高血压、疲劳、食欲下降、手足综合征(HFS)、AST∕ALT 升高、腹泻、蛋白尿、恶心呕吐、血液学毒性和出血,没有出现非预期的不良反应。这和之前Alter1102研究中的常见不良反应类型基本一致[10]。不过整体的发生率要略低于Alter1102 研究,另外本研究记录到的不良反应大部分是不需要进行实验室检查的不良反应。需要生理生化检查的包括AST∕ALT 升高以及血液学毒性发生率也略低于临床研究中的发生率。CHENG 等[18]的安罗替尼在晚期NSCLC 肺癌中的回顾性研究的结果也发现了真实世界中记录到的不良反应发生率低于Ⅲ期研究的情况。主要是因为回顾性分析对于不良反应的记录相对简单。此外,Alter1102 研究发现有20%左右的患者在接受12 mg 安罗替尼治疗后需要调整为10 mg 或8 mg。因此,本研究中有23.8%的患者经过研究者的综合评估将安罗替尼的起始剂量定为10 mg。起始剂量的差异是否会影响到患者后续的疗效差异尚需要大样本临床研究进一步证实。此外,本研究结果表明安罗替尼引起的高血压的患者PFS 优于未出现高血压的患者,这和之前SONG 和CHENG 团队的研究结果基本一致,他们也发现了安罗替尼引起的高血压和手足综合征可以预测患者的PFS[18-19]。高血压是抗血管生成药物治疗中常见的不良反应,高血压的出现也提示了抗血管生成药物治疗的有效性[20]。
本研究也存在一定的局限性。首先,研究入组的患者相对较少,结果尚需要在大样本的研究中进行验证。此外,回顾性分析中一些PFS 及OS数据的成熟度相对不高,不良反应的记录也相对较差,这造成了一些研究的偏倚。不过,本研究总体上探讨了安罗替尼单药在晚期食管鳞癌患者中的疗效及安全性,研究结论对于晚期食管鳞癌患者标准治疗方案失败后的药物选择具有一定的临床指导意义。
