聚苯乙烯微塑料和纳米塑料对萼花臂尾轮虫有性生殖的毒性影响
2022-05-19徐晓平李彬彬陶开燕黄志鹏
陈 涛,徐晓平,2*,李彬彬,陶开燕,谢 安,黄志鹏
1. 安徽工程大学建筑工程学院,安徽 芜湖 2410002. 皖江流域退化生态系统的恢复与重建省部协同创新中心,安徽 芜湖 241000
塑料制品已成为人类生活不可或缺的一部分,特别是近年来,随着快递、外卖等行业的迅猛发展,塑料制品的使用频次急剧上升造成了大量塑料垃圾. 研究[1]表明,全球范围内估计每年有4.80×106~1.27×107t塑料垃圾流入水环境中. 这些排入水体中的塑料在水解、风化、光降解和生物降解等作用下会形成粒径更小的微米级和纳米级塑料微粒[2-3]. 这些粒径较小的塑料微粒在自然作用以及人类活动的影响下进入全球不同的水域中,在全球范围内不同水环境中均发现了微塑料污染的现象[4-6]. 我国长江三峡大坝上游地表水中也检测到每平方公里含有1.925×102~1.36175×104个微塑料颗粒[7];此外,在天津市北塘排污河表层沉积物中测得微塑料平均丰度为202.17个/kg[8]. 这些流入自然水体中的塑料微粒不仅会进一步加重水体的污染程度,甚至可能通过食物链富集等形式进入人体并危害人类健康.
微塑料(粒径为0.1~5000 μm)和纳米塑料(粒径为1~100 nm)已经被证明比普通塑料毒性作用更大,且它们在水体中分布广泛,种类繁多[9-12]. 研究[13-17]表明,微塑料和纳米塑料能被水生生物吸入体内并在体内残留,会对许多生物产生不利影响. 微米尺寸的塑料会给生物肠道造成物理损伤[18],而纳米尺寸的塑料由于其粒径小、比表面积大,甚至可能通过生物屏障,穿过生物膜,对生物的功能和健康产生负面作用[19].Pitt等[20]研究发现,聚苯乙烯纳米粒子在斑马鱼处于胚胎时期起在卵黄囊中积累,并在整个发育过程中迁移到胃、肠道、肝脏、胰腺和心脏等部位,导致幼鱼的行为受到影响. 田莉莉等[21]采用荧光和C-14同位素法研究了微塑料对海水青鳉的影响,发现青鳉摄食微塑料72 h后肠道内仍有微塑料残留. 此外,当大型溞暴露于微塑料中会促进其体内超氧化物歧化酶、过氧化氢酶等活性的升高,对机体造成氧化损伤[22].暴露于3种不同粒径的聚苯乙烯微粒中会使褶皱臂尾轮虫的生长速度减慢、生殖力下降、寿命缩短以及繁殖时间延长,并且诱导机体产生氧化应激反应[16].目前,关于微塑料和纳米塑料对水生生物的毒理学研究[23-25]发现,水体中存在的塑料微粒会对多数水生生物产生危害.
轮虫作为水生态系统中的初级消费者,在维持整个生态系统正常的物质循环和能量流动中发挥着重要作用. 由于轮虫分布广泛、世代周期短、对毒物敏感和试验室易于培养等特点,其被视为水生态系统中测试有毒物质的模式生物. 此外,轮虫存在两种生殖方式,它们在外界条件良好时进行孤雌生殖,而当外界条件发生改变且不利于轮虫种群正常生存时,它们会转而进行有性生殖,通过产休眠卵的方式来抵御外界环境的变化[26]. 研究[26-29]发现,轮虫种群有性生殖参数可以作为毒性测试的良好指标. 目前,关于聚苯乙烯微塑料和纳米塑料对轮虫有性生殖的影响尚不清楚. 因此,该研究以萼花臂尾轮虫(Brachionus calyciflorus)为受试生物,运用24 h急性毒性、168 h慢性毒性试验方法,研究了不同粒径聚苯乙烯微塑料和纳米塑料对萼花臂尾轮虫有性生殖的影响,旨在探明暴露于聚苯乙烯塑料中萼花臂尾轮虫试验种群增长和有性生殖情况,以期为探明聚苯乙烯微塑料和纳米塑料对轮虫类重要浮游生物繁殖和种群增长的影响提供理论参考.
1 材料与方法
1.1 轮虫的来源和培养
试验选用的萼花臂尾轮虫是从芜湖市镜湖水体沉积物中挑选出的萼花臂尾轮虫休眠卵孵化所得. 采用EPA作为轮虫培养基[30],斜生栅藻(Scenedesmus obliquus)作为轮虫的唯一食物. 斜生栅藻采用HB-4培养基[31]培养,经离心浓缩后置于4 ℃下保存使用. 试验开始前,将一定数量的萼花臂尾轮虫置于(25±1) ℃的恒温培养箱中预培养,培养时间需超过7 d. 预培养期间,每天更换萼花臂尾轮虫培养基,并投喂密度为2.0×106cells/mL的斜生栅藻.
1.2 聚苯乙烯微塑料和纳米塑料的性能和配制
试验所用的两种粒径的聚苯乙烯微塑料(0.5 μm、1 μm)和一种粒径的聚苯乙烯纳米塑料(100 nm)是由大鹅(天津)科技有限公司生产. 使用Malvern Zetasizer Nano ZS90和 Malvern Instruments Z (马尔文帕纳科公司,英国)两种仪器检测3种粒径聚苯乙烯塑料粒子在蒸馏水中的平均粒径、分散性指数和ζ-电位等指标,每种指标重复检测3次. 聚苯乙烯微塑料和纳米塑料原液在4 ℃下避光保存. 为了减小聚苯乙烯塑料粒子的聚集作用,在每次使用前进行超声处理(15 min). 试验开始前,用蒸馏水配制1000 mg/L的聚苯乙烯微塑料或纳米塑料母液,置于4 ℃下保存. 试验中不同浓度测试液均采用稀释的方法配制,为了减少藻对聚苯乙烯微塑料和纳米塑料颗粒的吸附以及塑料粒子自身聚集可能带来的影响,测试液每24 h配制一次.
1.3 聚苯乙烯微塑料和纳米塑料的摄入
为了研究轮虫对聚苯乙烯微塑料和纳米塑料颗粒的摄入情况,从预培养的试管中随机挑选萼花臂尾轮虫(500只左右),暴露在10 mg/L的3种不同粒径的聚苯乙烯微塑料或纳米塑料测试液中(不含藻),并置于(25±1)℃、无光照的恒温培养箱中培养. 24 h后,采用25 μm筛网过滤萼花臂尾轮虫,并用蒸馏水清洗暴露后萼花臂尾轮虫体表的聚苯乙烯微塑料或纳米塑料,重复3次. 清洗后的萼花臂尾轮虫用4%甲醛固定,经离心、干燥后备用. 采用扫描电子显微镜(SEM, Hitachi S-4800型, 日本日立公司)观察萼花臂尾轮虫体内的聚苯乙烯微塑料和纳米塑料. 将干燥后的部分萼花臂尾轮虫样品固定在SEM的样品台上进行喷金,然后进行观察.
1.4 急性毒性试验
为了研究聚苯乙烯微塑料和纳米塑料在短期内对轮虫的毒性作用,进行了24 h急性毒性测试. 根据预试验的结果,将100 nm聚苯乙烯纳米塑料浓度设置为0.01、0.1、1、10和100 mg/L,0.5 μm聚苯乙烯微塑料浓度设置为10、25、50、100和200 mg/L,1 μm 聚苯乙烯微塑料浓度设置为1、10、100、200和400 mg/L,此外均设置1个空白对照组(EPA培养基). 试验在容积为6 mL的小玻璃杯中进行,随机挑选10只龄长在6 h以内的萼花臂尾轮虫幼体于玻璃杯中,并加入5 mL不同浓度的测试液(不含斜生栅藻),置于(25±1)℃、无光照的恒温培养箱中培养,每个浓度设置3个重复. 试验开始24 h后,记录每个玻璃杯中萼花臂尾轮虫存活数目,采用机率单位算法求得急性24 h-LC50(24 h半数致死浓度)值.
1.5 有性生殖试验
根据聚苯乙烯微塑料和纳米塑料对萼花臂尾轮虫的急性毒性试验结果,将100 nm聚苯乙烯纳米塑料以及0.5和1 μm聚苯乙烯微塑料的暴露浓度均设置为0.01、0.1、1、10和20 mg/L,另设置1个空白对照组(EPA培养基),每组设置8个重复.
从预培养的试管中挑选带非混交卵的萼花臂尾轮虫雌体若干,置于培养皿中培养(培养条件与预培养相同),2 h后收集萼花臂尾轮虫幼体. 随机挑选3只轮虫幼体放入6 mL小玻璃杯中,加入5 mL不同浓度的测试液(内含2.0×106cells/mL的斜生栅藻),置于(25±1)℃、无光照的恒温培养箱中继续培养. 试验开始48 h后,观察并记录各玻璃杯中萼花臂尾轮虫存活总数,用于计算萼花臂尾轮虫2 d种群增长率;试验开始96 h后,参考文献[32]的方法,对轮虫雌体进行计数,用于计算轮虫混交率、受精率等指标,计数后的轮虫返回新的测试液中继续暴露,暴露条件不变;试验开始168 h后,记录混交雌体携带以及落入玻璃杯底部的休眠卵数量. 试验期间,每12 h悬浮一次沉积在玻璃杯底部的绿藻,每24 h更换一次测试液并投喂新鲜的藻.
种群增长率(r)计算公式:
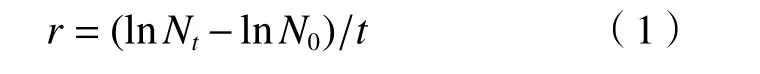
式中:Nt和N0分别为试验结束和试验开始时的轮虫数量;t为时间,该研究中t取2 d;
有性生殖试验包含以下指标:OF/NOF为携卵的雌体数与不携卵的雌体数的比值;MF/AF为携卵的雌体中混交雌体数与非混交雌体数的比值;MR(混交率)为种群中混交雌体数与雌体总数的比值;FR(受精率)为种群中受精的混交雌体数与混交雌体总数的比值;RE(休眠卵产量)为5 mL培养液中轮虫在7 d内所产的休眠卵总数[28];NOEC为最大未观察到效应浓度,mg/L;LOEC为最小观察到效应浓度,mg/L. 根据单因素方差分析结果确定各参数的NOEC和LOEC.
1.6 数据统计与分析
采用SPSS 16.0软件对试验数据进行分析. 利用单因素方差分析(one-way ANOVA)和多重比较(LSD检验)法比较轮虫各浓度组有性生殖指标与对照组间的差异显著性,P<0.05表示显著性差异. 此外,对轮虫有性生殖参数与不同粒径聚苯乙烯微塑料和纳米塑料浓度间的剂量-效应关系进行回归分析.
2 结果与分析
2.1 聚苯乙烯微塑料和纳米塑料特性
100 nm聚苯乙烯纳米塑料以及0.5和1 μm 聚苯乙烯微塑料在蒸馏水中的平均粒径、分散性指数和ζ-电位值如表1所示. 数据显示,与1 μm聚苯乙烯微塑料相比,100 nm聚苯乙烯纳米塑料和0.5 μm聚苯乙烯微塑料在蒸馏水中稳定性更高,聚集程度更低.
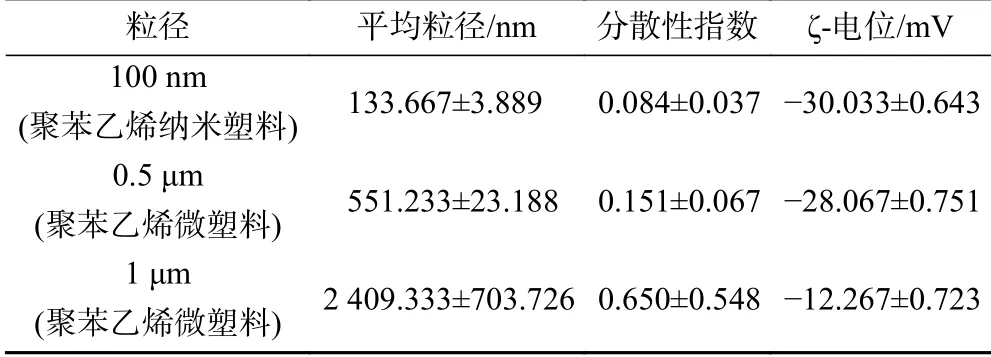
表1 不同尺寸聚苯乙烯微塑料和纳米塑料在蒸馏水中的参数Table 1 Parameters of the different size polystyrene microplastics and nanoplastics in the distilled water
2.2 聚苯乙烯微塑料和纳米塑料的摄入
图1为100 nm聚苯乙烯纳米塑料以及0.5和1 μm聚苯乙烯微塑料原液经过滤、干燥后电镜扫描结果.图2为空白对照组和暴露于10 mg/L的100 nm聚苯乙烯纳米塑料以及0.5和1 μm聚苯乙烯微塑料溶液中24 h后被摄入和沉积在轮虫体内的情况. 由图2可见,暴露24 h后聚苯乙烯微塑料和纳米塑料已被摄入并沉积在轮虫体内.

图1 不同粒径聚苯乙烯微塑料和纳米塑料原液的SEM图Fig.1 SEM images of polystyrene microplastics and nanoplastics with different sizes

图2 萼花臂尾轮虫24 h摄入不同粒径聚苯乙烯塑料的SEM图Fig.2 SEM Images of the polystyrene plastics of different particle sizes ingested by Brachionus calyciflorus in 24 h
2.3 聚苯乙烯微塑料和纳米塑料对轮虫的急性毒性
急性毒性试验结果(见表2)显示,随着聚苯乙烯塑料粒径的增加,100 nm聚苯乙烯纳米塑料以及0.5和1 μm聚苯乙烯微塑料对萼花臂尾轮虫的24 h-LC50值不断升高,表明随着聚苯乙烯塑料粒径的增加,其对轮虫的急性毒性减小.

表2 不同尺寸聚苯乙烯微塑料和纳米塑料对萼花臂尾轮虫的24 h半致死浓度Table 2 The 24 h median lethal concentration for Brachionus calyciflorus exposed to polystyrene microplastics and nanoplastics of different diameters
2.4 聚苯乙烯塑料对轮虫有性生殖的影响
单因素方差分析结果表明,不同粒径的聚苯乙烯塑料对萼花臂尾轮虫2 d种群增长率影响不同. 0.5 μm聚苯乙烯微塑料对轮虫2 d种群增长率有影响,但影响不显著(P>0.05);100 nm聚苯乙烯纳米塑料和1 μm聚苯乙烯微塑料均可引起轮虫种群数量的显著变化(P均小于0.05). 与对照相比,暴露于20 mg/L的100 nm聚苯乙烯纳米塑料以及0.01、0.1、1、10和20 mg/L的1 μm聚苯乙烯微塑料均显著降低了轮虫的种群增长率(P均小于0.05)(见表3).
0.5、1 μm聚苯乙烯微塑料和100 nm聚苯乙烯纳米塑料对轮虫4 d 的OF/NOF值均有显著影响. 与对照组相比,10 mg/L的100 nm聚苯乙烯纳米塑料以及0.01、0.1、1、20 mg/L的0.5 μm聚苯乙烯微塑料均显著降低了OF/NOF值(P均小于0.05);0.01和10 mg/L的1 μm聚苯乙烯微塑料则显著增加了OF/NOF值(P均小于0.05). 10和20 mg/L的1 μm聚苯乙烯微塑料均显著降低了轮虫的MF/AF值(P均小于0.05),其他处理组则无显著变化(见表3).
0.5和1 μm聚苯乙烯微塑料以及100 nm聚苯乙烯纳米塑料对轮虫4 d混交率(MR)均有显著影响(见表3). 与对照组相比,暴露于10和20 mg/L的100 nm聚苯乙烯纳米塑料均显著降低轮虫的混交率(P均小于0.05),且混交率为0. 暴露于0.01、1和20 mg/L的0.5 μm聚苯乙烯微塑料分别显著降低了44.3%、66.2%和41.4%的轮虫混交率(P均小于0.05);而与对照组相比,暴露于0.01、0.1、1和10 mg/L的1 μm聚苯乙烯微塑料分别显著增加了139.7%、55.3%、110.2%和118.6%的轮虫混交率(P均小于0.05).
与对照组相比,暴露于10和20 mg/L的100 nm聚苯乙烯纳米塑料导致轮虫的受精率(FR)显著降低,且受精率均为0 (P均小于0.05);暴露于0.01和0.1 mg/L的0.5 μm聚苯乙烯微塑料分别显著增加了105.0%和79.9%的轮虫受精率(P均小于0.05);0.01、0.1、1、10和20 mg/L的1 μm聚苯乙烯微塑料对轮虫受精率均无显著影响(见表3).
单因素方差分析结果显示,0.5和1 μm聚苯乙烯微塑料和100 nm聚苯乙烯纳米塑料均对轮虫休眠卵产量具有显著影响(P均小于0.05). 暴露于10和20 mg/L的100 nm聚苯乙烯纳米塑料均显著降低轮虫休眠卵产量,休眠卵产量均为0 (P均小于0.05),与纳米塑料对受精率的影响相似. 暴露于0.01、0.1、1、10和20 mg/L的0.5 μm聚苯乙烯微塑料分别显著增加了292.9%、307.1%、290.0%、514.3%和152.9%的轮虫休眠卵产量(P均小于0.05);暴露于0.1 mg/L的1 μm聚苯乙烯微塑料对轮虫休眠卵产量也有显著促进作用(P<0.05),与对照组相比,休眠卵产量增加了50.6%(见表3).
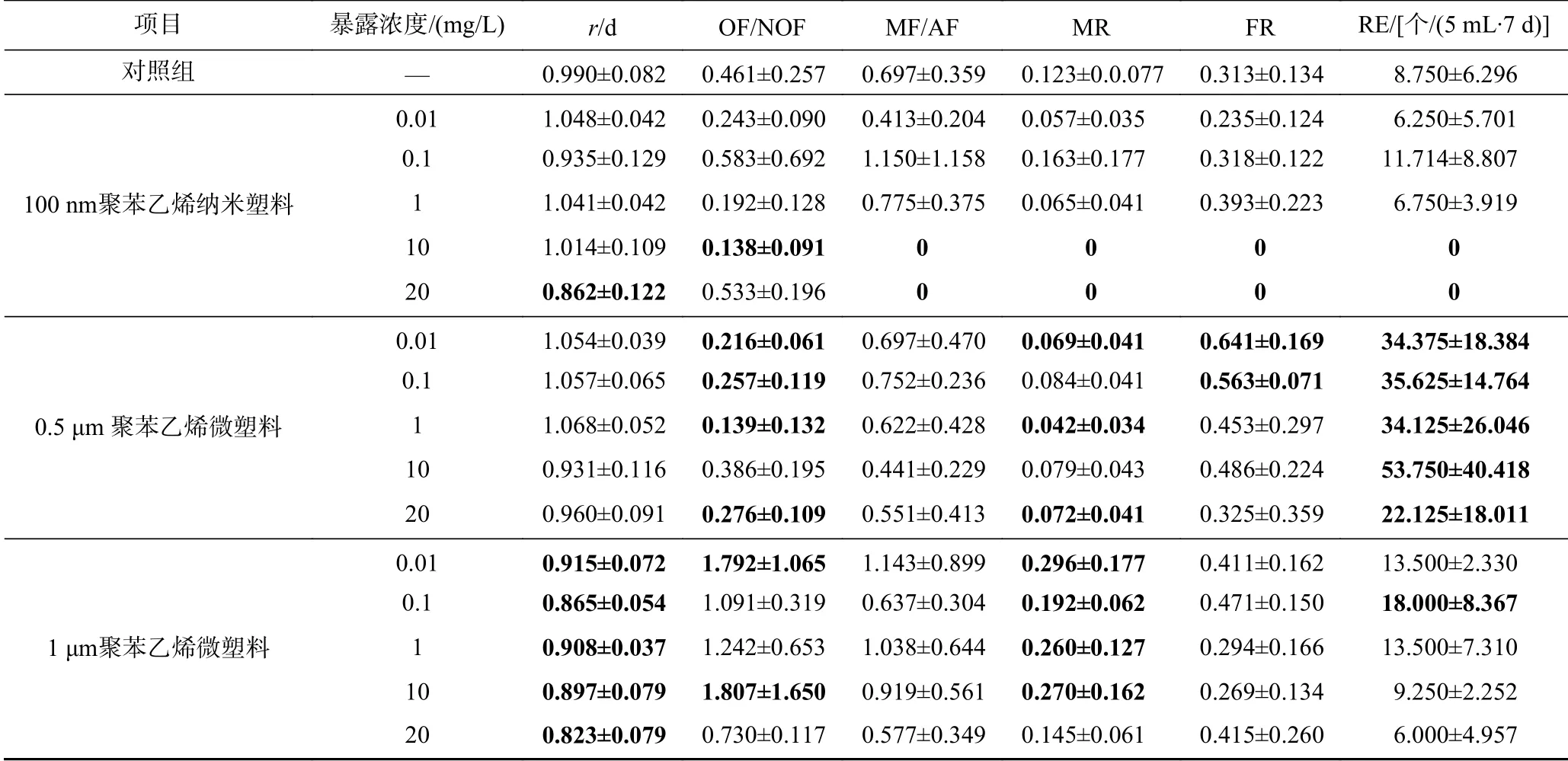
表3 暴露于不同浓度聚苯乙烯微塑料和纳米塑料中萼花臂尾轮虫的有性生殖参数Table 3 The reproductive parameters of Brachionus calyciflorus exposed to different concentrations of polystyrene microplastics and nanoplastics
回归分析结果(见表4)显示,0.5和1 μm聚苯乙烯微塑料以及100 nm聚苯乙烯纳米塑料浓度的对数值均与轮虫有性生殖指标之间存在不同程度的剂量-效应关系,其中,100 nm聚苯乙烯纳米塑料浓度的对数值与轮虫受精率和休眠卵产量之间存在显著的剂量-效应关系,0.5和1 μm聚苯乙烯微塑料浓度的对数值则分别与轮虫种群增长率和休眠卵产量存在显著的剂量-效应关系. 由表5可见,暴露于1 μm聚苯乙烯微塑料中轮虫种群增长率、混交率和休眠卵产量的LOEC值均较低,暴露于0.5 μm聚苯乙烯微塑料中轮虫混交率和休眠卵产量的LOEC值均较低.
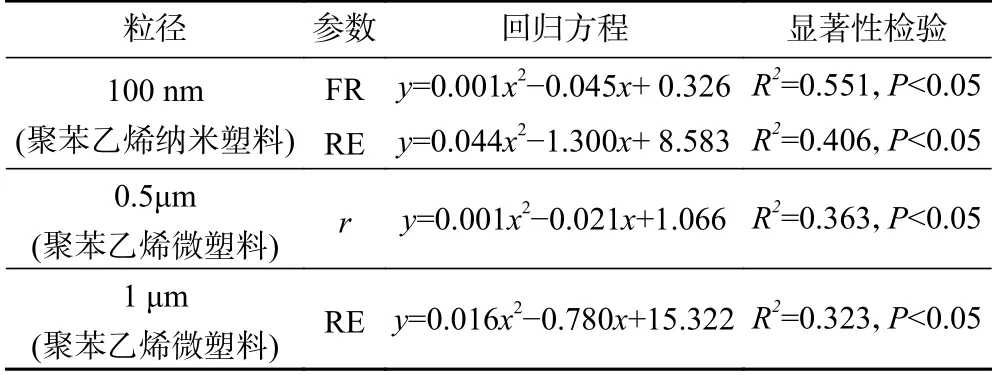
表4 萼花臂尾轮虫有性生殖参数与聚苯乙烯微塑料和纳米塑料浓度对数值之间的关系Table 4 Relationships between the reproductive parameters of Brachionus calyciflorus and logarithm concentration of polystyrene microplastics and nanoplastics
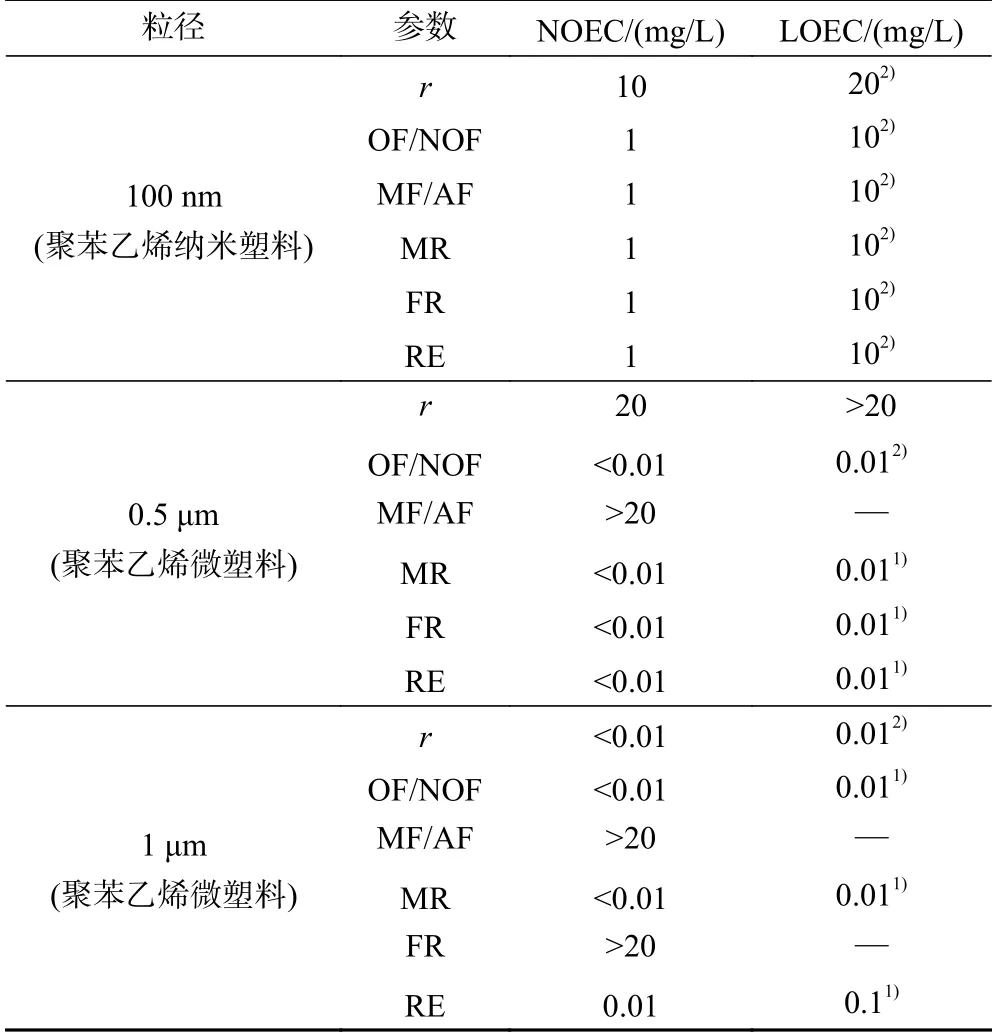
表5 暴露于聚苯乙烯微塑料和纳米塑料中萼花臂尾轮虫有性生殖参数的NOEC、LOEC值Table 5 NOEC and LOEC values of the sexual reproductive parameters of Brachionus calyciflorus exposed to polystyrene microplastics and nanoplastics
3 讨论
3.1 聚苯乙烯塑料对轮虫的急性毒性影响
萼花臂尾轮虫作为水生态系统中的重要组成部分,由于其对毒物十分敏感,在杀虫剂、重金属、抗生素等毒物测试中得到广泛应用[33-36]. 因此,该研究选用萼花臂尾轮虫作为受试生物,探究了不同粒径聚苯乙烯塑料对轮虫繁殖的影响. 急性试验结果显示,分别暴露于100 nm、0.5 μm和1 μm三种粒径的聚苯乙烯塑料24 h后,随着聚苯乙烯塑料粒径的增大,轮虫的24 h-LC50值升高,表明随着塑料粒径的增大,其对轮虫的毒性作用在降低. 研究[16,37]发现,与大粒径的微塑料相比,小粒径的纳米塑料具有更高的生物活性,更易穿透生物膜且毒性更强,对生物机体会造成更大的伤害. 因此,相同浓度下聚苯乙烯微塑料和纳米塑料的粒径越小,颗粒越多,对轮虫的急性毒性更强.
急性试验作为一种标准的毒物测试方法,在毒理学研究领域中得到广泛应用[38]. 但仅依靠急性试验结果来评价毒物的毒性作用,可能会忽视毒物与生物体之间复杂的化学或生物作用,从而影响毒理学评价结果的完整性和准确性. 此外,不同材质的塑料颗粒在水体中分布广泛,且浓度较低,水生生物长期暴露在低浓度的塑料粒子中会产生慢性毒性作用. 因此,该研究还探讨了不同粒径聚苯乙烯微塑料和纳米塑料对萼花臂尾轮虫有性生殖的慢性毒性影响.
3.2 聚苯乙烯塑料对轮虫种群的影响
目前,关于微塑料和纳米塑料污染物对藻类、轮虫和大型溞等水生生物种群增长的影响已有报道[15,16,39-41]. Zhang等[42]研究了微塑料与海洋中肋骨条藻(Skeletonema costatum)之间的相互作用,发现聚氯乙烯微塑料会嵌入微藻细胞壁,对藻类细胞表面造成物理损伤,从而限制细胞与环境之间能量和物质的交换. Jeong等[16]发现,高浓度的0.05 μm聚苯乙烯微球对轮虫的毒性作用显著高于0.5和6 μm聚苯乙烯微球,暴露于6 μm聚苯乙烯微球后轮虫只表现出轻微的生长迟缓. 笔者研究中,萼花臂尾轮虫的生长抑制程度也与聚苯乙烯塑料粒径密切相关. 与Liu等[15]试验结果不同,笔者研究中暴露于100 nm聚苯乙烯纳米塑料后,高浓度的聚苯乙烯纳米塑料显著抑制了轮虫种群增长率,而低浓度的聚苯乙烯纳米塑料对轮虫种群增长率无显著影响;当轮虫暴露于0.5 μm聚苯乙烯微塑料时,种群增长率却无显著变化;暴露于0.01、0.1、1、10和20 mg/L的1 μm聚苯乙烯微塑料均显著抑制轮虫种群增长率. 轮虫作为滤食性动物,其通过自身不断的旋转游动来摄取环境中的食物,而在试验期间由于摄入了大量聚苯乙烯微塑料和纳米塑料,导致其从绿藻中摄入营养不足,从而影响轮虫的存活与繁殖,这与Lisbeth等[43]研究结果类似. 研究[16,41]表明,轮虫能摄入粒径较小的微塑料,并且在胃、肠道等消化器官中积累. 当轮虫暴露在浓度较高的100 nm聚苯乙烯纳米塑料中,由于相同浓度的小粒径纳米塑料的数量更多,纳米塑料更有可能透过生物膜进入组织和细胞内,对轮虫产生了氧化损伤;而暴露于粒径相对较大的0.5 μm聚苯乙烯微塑料时,微塑料进入组织和细胞的可能性较小,可能只在轮虫肠道内残留,并不会对机体产生较大的影响;而轮虫暴露于1 μm聚苯乙烯微塑料时,轮虫排泄物颗粒较大、呈团状,且在轮虫体表停留时间较长. 研究[7]表明,摄入轮虫体内的聚苯乙烯微塑料可能会影响轮虫的浮力和游泳行为,进而影响轮虫食物的摄入. SEM测试结果也表明,暴露于100 nm聚苯乙烯纳米塑料以及0.5和1 μm聚苯乙烯微塑料24 h后,塑料颗粒在轮虫体内积累,且小粒径的塑料颗粒在体内积累的数量更多,这可能是导致小粒径纳米塑料对轮虫毒性作用更大的原因. 值得注意的是,微塑料和纳米塑料的摄入可能导致其从水体进入生物体和沉积物中,这些微塑料和纳米塑料不仅会对轮虫产生威胁,还会对轮虫所处的食物链或食物网产生较大影响,甚至经食物链传播进入人体,对人类的健康存在一定风险. 因此,关于不同粒径微塑料和纳米塑料在轮虫体内积累和排泄的过程值得关注.
3.3 聚苯乙烯塑料对轮虫有性生殖的影响
单因素方差分析结果显示,0.5和1 μm聚苯乙烯微塑料以及100 nm聚苯乙烯纳米塑料对萼花臂尾轮虫混交率均有显著影响. 100 nm聚苯乙烯纳米塑料和0.5 μm聚苯乙烯微塑料均显著抑制了轮虫混交率,而1 μm聚苯乙烯微塑料则显著增加了轮虫混交率,表明3种塑料粒子对轮虫的生殖已经显示出较高的毒性作用. 与对照组相比,暴露于10和20 mg/L的100 nm聚苯乙烯纳米塑料中轮虫的混交率为0,说明轮虫的混交行为受到抑制,轮虫的有性生殖行为减少. 然而,与其他两种粒径的聚苯乙烯塑料相比,暴露于相同浓度的1 μm聚苯乙烯微塑料中轮虫混交率更高. 推测可能是大颗粒聚苯乙烯微塑料影响了轮虫的正常生命活动,种群增长受到抑制,使得轮虫转变生殖方式,轮虫群体中出现大量混交雌体所致. 一般认为,轮虫在受到毒物胁迫时轮虫亲代会将更多的能量投入到解毒过程中,从而导致子代数量和质量的降低[44]. 3种粒径聚苯乙烯塑料暴露后LOEC结果显示,暴露于较低浓度的聚苯乙烯塑料中即可引起轮虫混交率发生显著变化,表明混交率可以作为评价聚苯乙烯微塑料和纳米塑料对轮虫毒性作用的一个敏感参数. Xi等[32]研究了4种有机氯杀虫剂对轮虫的生殖影响,发现混交率是一个合适的毒性评价测试终点,与笔者试验结果一致.
在评价污染物对轮虫有性生殖毒性时,受精率也是一个重要的监测指标. Tian等[45]研究发现,睾丸酮(testosterone)与不同浓度氟他胺(flutamide)联合暴露时,对轮虫种群混交雌体受精率有显著抑制作用,进而可能影响轮虫休眠卵产量. 当试验系统中轮虫混交雌体数几乎为0时,会导致轮虫受精过程无法完成,从而导致受精率下降,休眠卵无法产生. 笔者研究结果也证实了这一点,试验开始168 h后,暴露于10和20 mg/L的100 nm聚苯乙烯纳米塑料中轮虫的休眠卵产量为0. 而与对照组相比,低浓度的0.5 μm聚苯乙烯微塑料对轮虫的受精率有显著促进作用,高浓度也呈现促进作用但不显著. 推测暴露于低浓度0.5 μm聚苯乙烯微塑料后,轮虫受精作用增强,轮虫休眠卵的产量也随之增加. 暴露于1 μm聚苯乙烯微塑料后,轮虫混交率显著增加,而受精率无显著影响,推测该暴露条件下轮虫受精行为受到影响. 笔者研究发现,轮虫生殖方式的改变与聚苯乙烯塑料粒径之间紧密相关.
休眠卵作为轮虫有性生殖的最终产物,被认为是轮虫的“种子”,轮虫通过转变生殖方式产生休眠卵来躲避外界不利的条件,以保证轮虫种群的延续性.在毒理学试验中,休眠卵产量是比轮虫其他种群参数对污染物更为敏感的指标[46]. 笔者研究中暴露于10和20 mg/L的100 nm聚苯乙烯纳米塑料后,轮虫休眠卵产量、混交率和受精率均受到显著抑制;暴露于0.5 μm聚苯乙烯微塑料中轮虫的混交率受到一定程度的抑制,受精率受到一定程度的促进,而休眠卵产量表现出显著的促进作用,可能与微塑料暴露后,轮虫的受精作用加强有关;暴露于不同浓度(除20 mg/L外)的1 μm聚苯乙烯微塑料中,轮虫混交率均显著增加,意味着试验体系中混交雌体数量增加,轮虫受精概率增大,但各处理组中轮虫受精率无显著变化,且休眠卵产量只在0.1 mg/L下显著增加. 由此可见,轮虫休眠卵的产生是多种因素共同作用的结果,单一指标的变化并不能决定最终休眠卵的产量. Tian等[45,47]研究发现,暴露于几种不同内分泌干扰素中轮虫有性生殖指标也会发生改变. 推测聚苯乙烯微塑料和纳米塑料暴露导致轮虫体内某些激素含量的变化可能是轮虫生殖方式发生改变的一个原因,关于轮虫生殖方式发生转变的内在机制还需进一步研究.
该研究在评价聚苯乙烯微塑料和纳米塑料对轮虫各有性生殖指标影响时,低浓度的聚苯乙烯微塑料和纳米塑料即可引起轮虫休眠卵产量的显著变化,说明可以选用轮虫休眠卵产量来评价自然水体中聚苯乙烯微塑料和纳米塑料对轮虫的有性生殖毒性. 然而,由于污染物自身性质和轮虫品系不同,在评价聚苯乙烯微塑料和纳米塑料对轮虫各指标的敏感性时可能存在一定差异,还需要进一步研究. 轮虫在整个淡水生态系统中扮演着非常重要的作用,当轮虫转变生殖方式进行有性生殖时,必然导致短期内整个轮虫种群数量的变化,进而影响整个水生态系统的物质循环和能量流动[48-49]. 因此,如何正确、全面地评价水中聚苯乙烯微塑料和纳米塑料对轮虫种群的影响及其带来的生态风险还有待进一步研究.
4 结论
a) 聚苯乙烯微塑料和纳米塑料对萼花臂尾轮虫的急性毒性与聚苯乙烯塑料粒径有关,暴露于粒径较小的聚苯乙烯纳米塑料后轮虫的24 h-LC50值较低,急性毒性较大.
b) 暴露于20 mg/L的100 nm聚苯乙烯纳米塑料和0.01、0.1、1、10和20 mg/L的1 μm聚苯乙烯微塑料中,轮虫种群增长率均显著降低.
c) 暴露于聚苯乙烯微塑料和纳米塑料均会导致轮虫有性生殖增加,产生更多的休眠卵,使整个轮虫种群结构发生改变,可能对整个水生态系统存在一定的环境风险.
d) 在评价聚苯乙烯微塑料和纳米塑料对芜湖水体萼花臂尾轮虫有性生殖参数影响时,各参数的敏感性不同,低浓度的聚苯乙烯微塑料和纳米塑料暴露即可引起轮虫混交率和休眠卵产量的显著变化,表明轮虫混交率和休眠卵产量可以作为合适的测试指标.
