镉暴露对斑马鱼胚胎发育的毒性效应研究
2022-05-19罗紫蝶郭少娟张元元王睿虹杨立新
罗紫蝶,郭少娟,曾 晨,张元元,王睿虹,杨立新
中国环境科学研究院,环境基准与风险评估国家重点实验室,北京 100012
镉是环境中具有极强毒性的重金属污染物之一,属于人体非必需的微量金属,被广泛用于金属冶炼、塑料制造、涂料及电池等行业[1-2]. 联合国环境规划署把镉列为重点环境污染物[3]. 镉通常以离子形式广泛存在于生产和生活环境中. 工业生产是镉人为排放的主要来源,电子拆解地PM10中污染物的致癌风险大部分由镉引起[4]. 我国土壤镉污染较严重[5-6],长江流域及东南沿海地区的水稻田镉含量平均值为0.52 mg/kg[7],超过GB 15618—2018《农用地土壤污染风险管控标准(试行)》标准限值(0.30 mg/kg). 镉不易被降解,会随废水、废气不断释放到环境中,导致环境负担不断增加,并可进入食物链.
镉一般通过呼吸、皮肤吸收和饮食进入生物体并产生累积[8],从而对生物体产生毒性效应. 长期暴露于镉可导致肝毒性[9]、肾毒性[10]、骨骼毒性[11]及癌症[12]. 研究表明,孕期接触镉不但影响胎盘的发育和功能,还会通过胎盘进入胎儿体内,干扰胎儿的正常发育[13],影响语言和认知能力[14]. 低剂量的镉导致小鼠肠道微生物群改变,加速肝脏脂质代谢,造成终生代谢异常[15]. 长期镉溶液暴露将激活玉米螟幼虫金属硫蛋白基因Mtn的表达,抑制抗氧化基因Cat和GPx的表达;同时显著提高幼虫的脂质过氧化水平,降低幼虫的发育速度和成活率[16]. 镉暴露导致黑腹果蝇幼虫体长缩短、体重减少,抑制baz和tj等与发育相关基因的表达,这些影响会传递给未暴露的后代[17].
斑马鱼胚胎具有体外发育、发育速度快和胚胎透明等优点[18],广泛用于研究污染物对生物体的发育毒性[19]. 斑马鱼胚胎对镉的敏感性较强,暴露于3.00 mg/L镉96 h导致斑马鱼胚胎孵化延迟、小头、心率降低、体节缺失,且对外界刺激不敏感等[20]. 镉暴露抑制斑马鱼胚胎atp2b1a、pth1、stc1等与Ca2+调节相关基因的表达,影响胚胎的耳石发育,导致游泳活动受损[21]. 镉暴露影响斑马鱼胚胎中后脑发育,抑制ngn1、zash1a、zash1b和NeuroD的表达,影响神经元分化,最终产生神经毒性[22]. 暴露于35.60 μmol/L镉会抑制nanos、piwi、dazl等生殖调控基因的表达,影响早期生殖细胞的数量和迁移,造成生殖毒性[23-24].
镉具有胚胎发育毒性,然而镉产生发育毒性的关键因素尚不明晰. 因此,该研究在前期试验[25]基础上,用5个不同镉浓度暴露的斑马鱼胚胎分析镉暴露的浓度-效应关系. 选取与氧化应激、转录翻译和早期神经发育相关的prdx1、gstp1.2、atf3、jdp2b、hsp70l、hsp90aa1.1、eif4a1b和fabp7a基因,结合原位杂交和定量PCR方法,探究暴露于7.50 mg/L镉对上述基因在斑马鱼胚胎组织和器官表达的影响,揭示镉影响早期胚胎发育过程的分子事件,以期为阐明镉产生胚胎发育毒性的机制提供依据.
1 材料与方法
1.1 斑马鱼
野生AB型斑马鱼购于中国国家斑马鱼研究中心,培养于中国环境科学研究院循环养殖系统(北京佰安智能科技有限公司). 培养条件:温度为(28.5±0.5) ℃;pH为7.0±0.5;光暗循环为14 h/10 h;早晚喂食丰年虾两次. 产卵前一天,将雄鱼和雌鱼以2∶1的比例置于产卵盒中收集受精卵. 胚胎用ISO15088标准配制的水溶液(294.00 mg/L CaCl2·2H2O, 123.30 mg/L MgSO4·7H2O, 63.30 mg/L NaHCO3, 5.50 mg/L KCl)培养. 斑马鱼胚胎发育阶段按照斑马鱼胚胎发育分期[26]进行区分.
1.2 仪器与试剂
仪器包括体视显微镜(日本尼康公司,SMZ 745型)、荧光显微镜(德国徕卡显微系统有限公司,M165 FC型)、常规PCR仪(美国BIO-RAD)、荧光定量PCR仪(美国Thermo,7300 Plus型). 试剂包括CdCl2(西亚试剂)、限制性内切酶CeuⅠ/SacⅠ/SacⅡ及T7/SP6转录酶(美国Sigma)、DNA聚合酶和定量PCR试剂盒(美国Promega)、TRLzol(美国Ambion)、DIG-RNA及anti-DIG-AP、硝基蓝四氯唑(NBT)、4-氯-3-酰磷酸溴(BCIP,瑞士Roche).
1.3 镉暴露对斑马鱼胚胎的影响研究
1.3.1 基因克隆
用NCBI引物设计方法获取扩增prdx1、gstp1.2、atf3、jdp2b、hsp70l、hsp90aa1.1、eif4a1b、fabp7a基因的引物. 引物由北京金唯智测序公司制备. 将上述基因扩增、回收DNA,克隆到T-载体上(参照Promega的标准方法). 挑选并培养阳性细菌,提取质粒,测序验证目的基因.
1.3.2 胚胎暴露
按照OECD236标准方法,设置5个浓度,计算镉的半致死浓度(LC50). 根据LC50数据,设置暴露组CdCl2浓度为7.50 mg/L,该浓度能产生可观察的发育异常,同时导致胚胎死亡率低于5%. 胚胎于生物培养箱28.5 ℃下培育2~4 h后,挑选发育正常的胚胎进行暴露试验,暴露时间为4~48 hpf (hours post fertilization, 受精后小时).
1.3.3 原位杂交
按照实验室建立的方法[27]进行原位杂交试验,即用限制性内切酶酶切回收目的基因,用SP6/T7转录酶合成插入地高辛标记的RNA探针,溶解于50 μL杂交液,并保存于—20 ℃备用.
收集48 hpf的对照和镉暴露斑马鱼胚胎(16~25个),去除绒毛膜,BT-fix溶液固定24 h,经甲醇脱水后,保存于甲醇溶液,—20 ℃保存备用. 固定胚胎经清洗,蛋白酶K处理后,加入制备的探针,65 ℃杂交16 h. 梯度浓度SSC缓冲液清洗,加入anti-DIG-AP后4 ℃培育16 h. 用1×PBST清洗后,使用BCIP/NBT溶液染色. 体视显微镜拍摄染色照片.
1.4 数据处理
1.3.4 定量PCR
收集48 hpf的对照和镉暴露的斑马鱼(每组60个),TRLzol提取总RNA,逆转录成cDNA,每组3个生物学重复,进行定量PCR,反应条件:95 ℃维持2 min;95 ℃维持30 s、55 ℃维持30 s、72 ℃维持1 min,循环30次;72 ℃维持5 min,4 ℃维持30 s.引物序列如表1所示.
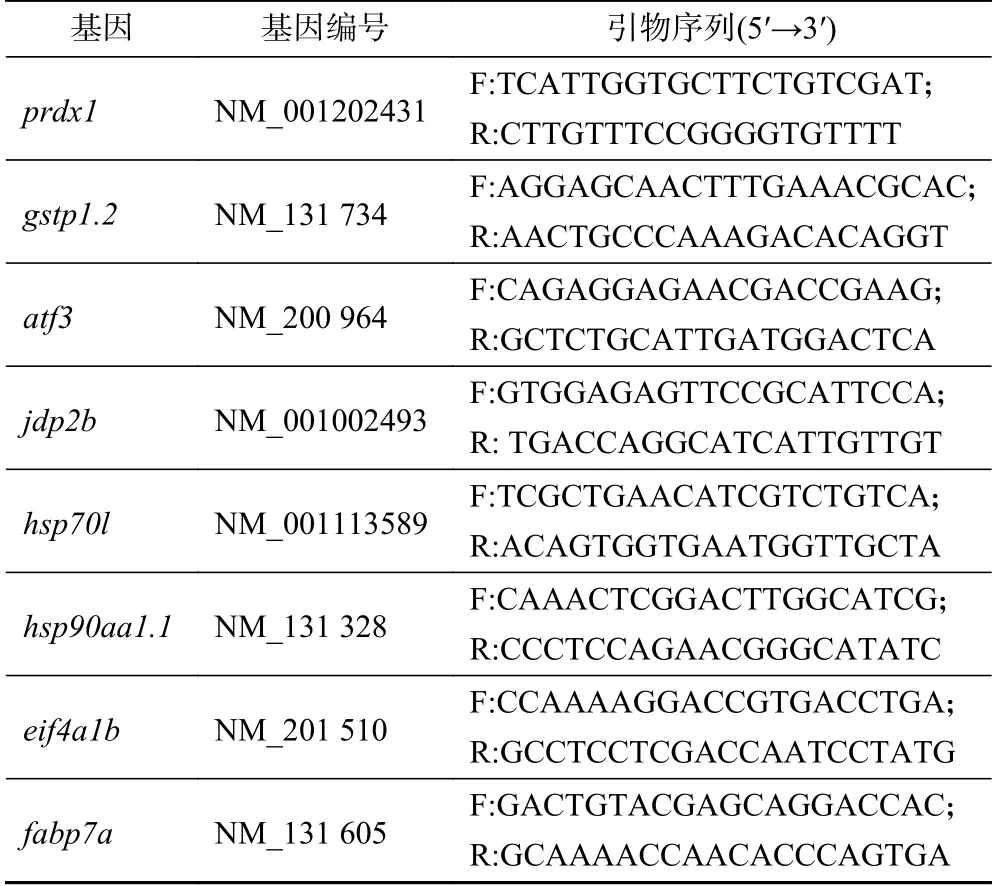
表1 定量PCR引物序列Table 1 Gene quantitative PCR primer sequences
用IBM SPSS 20软件进行统计分析,计算镉的LC50及95%置信区间. 选择在斑马鱼胚胎中表达量稳定的GAPDH基因作为内参基因,用2—△△Ct相对定量计算方法定量分析基因表达差异. 通过GraphPad Prism 8软件,采用One-way ANOVA对目的基因的表达差异进行分析(P<0.05表示差异显著,P<0.01表示差异极显著).
2 结果与讨论
2.1 镉暴露对斑马鱼胚胎的半致死浓度
通过暴露试验,计算得到镉暴露对斑马鱼胚胎120 hpf的半致死浓度,并通过体视显微镜观察到斑马鱼胚胎发育的毒性效应. 根据3次重复试验结果,绘制镉的浓度-效应关系曲线〔见图1(a)〕,当胚胎死亡率达到50%时,对应的镉浓度为15.20 mg/L. 暴露于20.00 mg/L镉4~48 hpf的斑马鱼胚胎存在头部和眼睛变小、体长缩短、躯干弯曲、卵黄囊异常以及心脏发育异常等畸形形态〔见图1(b)(c)〕.
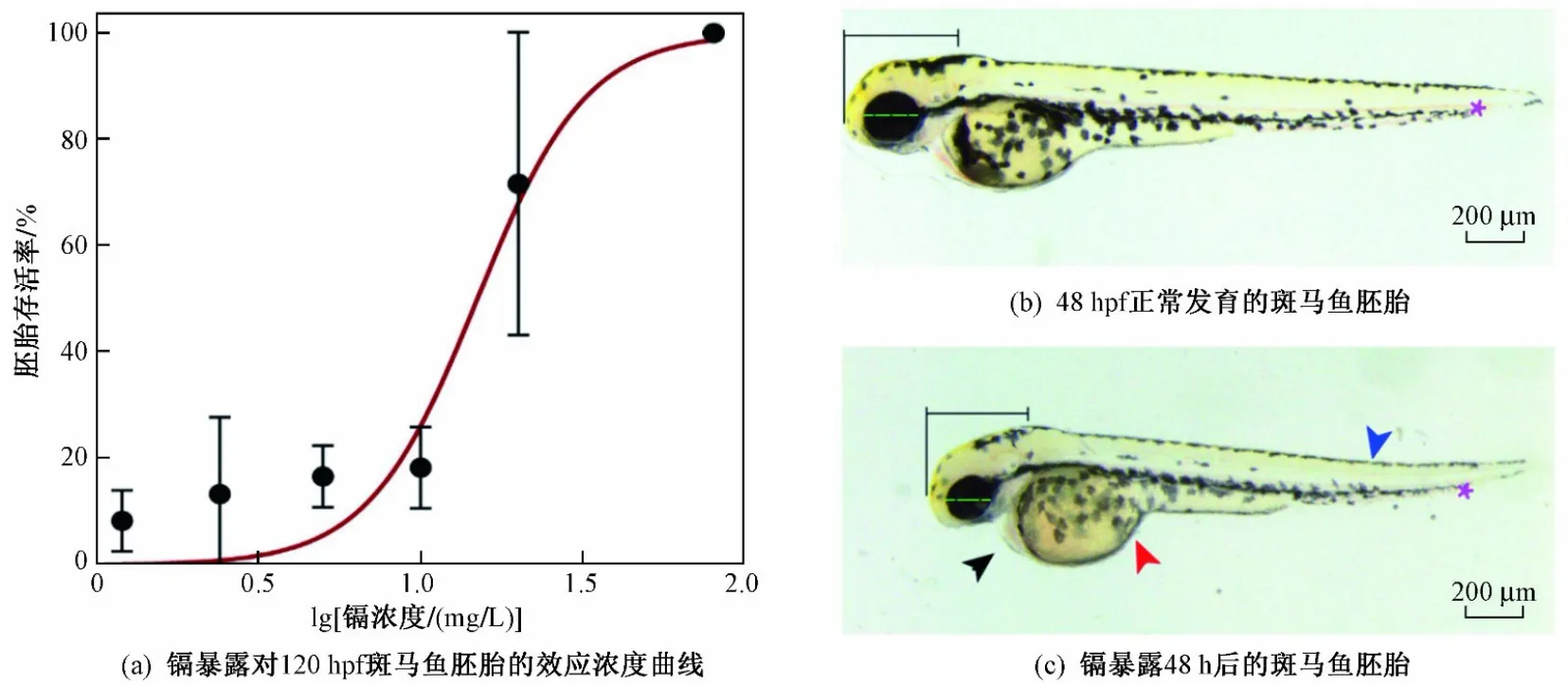
图1 镉暴露对斑马鱼胚胎的影响Fig.1 Effects of cadmium on zebrafish embryos
2.2 镉暴露影响基因在斑马鱼胚胎组织中的表达
选择暴露于7.50 mg/L镉的胚胎分析暴露48 hpf后,基因在斑马鱼胚胎组织和器官中的表达情况,发现镉主要诱导基因在神经组织、视网膜、晶状体,嗅球、侧线、心脏以及皮肤等组织和器官中异常表达 .对照组胚胎prdx1基因主要在下丘脑表达〔见图2和图3(a)〕,镉暴露导致prdx1基因在嗅球、侧线器官和上皮细胞的异常表达〔见图2和图3(a′)〕. 相较于对照,镉导致gstp1.2基因在下颌和侧线及血细胞中表达异常〔见图2和图3(b)(b′)〕. 镉诱导atf3基因在中后脑间隔、心包区域和嗅球异常表达,在胸鳍原基和尾鳍原基中表达量上升〔见图2和图3(c)(c′)〕.jdp2b基因在镉暴露胚胎的上皮细胞、胸鳍原基、心包区域、侧线和尾鳍原基处表达异常〔见图2和图3(d)(d′)〕.镉诱导hsp70l基因在嗅球和体节肌肉异常表达,同时在眼睛晶状体和脊索中表达量上升〔见图2和图3(e)(e′)〕.在镉暴露的胚胎中,hsp90aa1.1基因在胚胎的嗅球、眼睛晶状体和下颌肌肉表达异常,同时在中后脑间隔、胸鳍肌肉和体节肌肉中表达上升〔见图2和图3(f)(f′)〕.镉导致eif4a1b在顶盖、视网膜、晶状体、下颌、胸鳍原基和体节肌肉中异常表达〔见图2和图3(g)(g′)〕.镉诱导fabp7a基因在端脑、中后脑、延髓以及眼睛表达量上升,在脊髓和脊索出现异常表达〔见图2和图3(h)(h′)〕.

图2 对照组和镉暴露组斑马鱼胚胎基因表达情况Fig.2 The gene expression organs of zebrafish embryos in control and exposed to cadmium

图3 镉暴露组斑马鱼胚胎基因头部异常表达现象Fig.3 The changes in gene expression at anterior part of zebrafish embryos
2.3 镉暴露对胚胎基因相对表达量的影响
与对照组相比,镉暴露导致prdx1、gstp1.2、atf3、jdp2b、hsp70l、eif4a1b和fabp7a基因相对表达量显著上调,分别上调2.31、3.58、2.08、3.42、5.27、1.42和2.06倍(见图4).hsp70l基因主要参与应激反应和对金属离子的反应[28],gstp1.2和prdx1基因主要参与抗氧化过程[29],atf3和jdp2b基因具有DNA结合转录因子活性[30],eif4a1b基因具有翻译起始因子活性[30],fabp7a基因在早期神经发育过程中起重要作用[31]. 这些基因相对表达量的显著上调表明,镉影响斑马鱼胚胎的氧化应激、转录翻译和早期神经发育等过程.
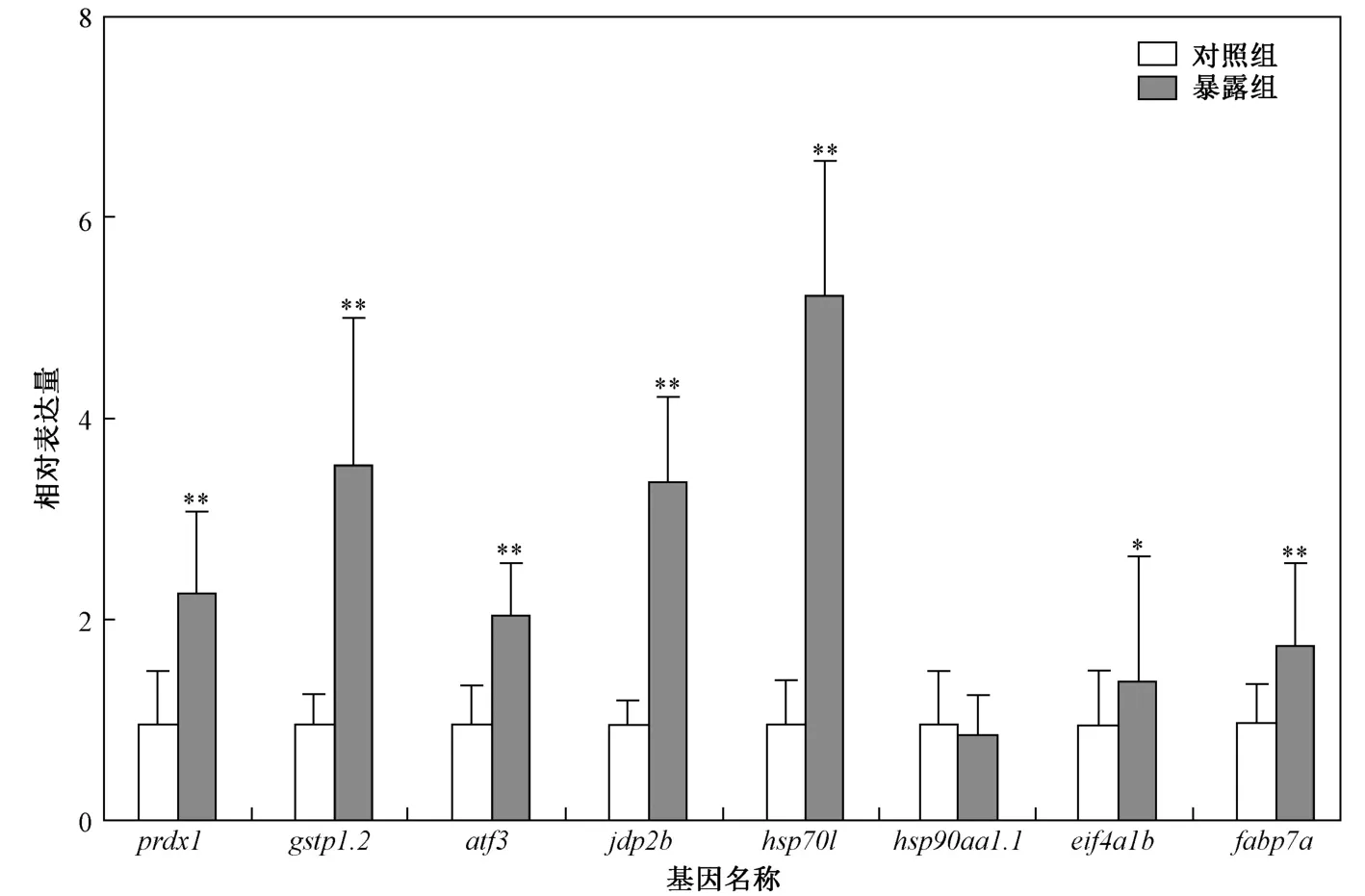
图4 镉暴露对斑马鱼胚胎基因相对表达量的影响Fig.4 The relative expression levels of genes induced by cadmium on zebrafish embryos
2.4 镉暴露对斑马鱼胚胎发育的影响
通过研究镉对8个基因在斑马鱼胚胎组织和器官表达的影响,发现镉不但诱导基因在神经组织、视网膜、晶状体,嗅球、侧线、心脏以及皮肤等组织和器官中异常表达,而且影响基因在相应组织和器官中的表达水平,表明镉影响斑马鱼胚胎的多个组织和器官的发育.
研究表明,镉主要通过芬顿反应置换金属离子,产生多余的ROS,进而造成氧化应激[32],并通过干扰体内钙离子运输,影响蛋白质正常生理功能等[33]产生毒性效应. 笔者研究的8个基因中,有5个基因在镉暴露后的斑马鱼胚胎中于嗅球处异位表达,并且定量PCR结果显示,其中4个基因在镉暴露后表达量显著升高. 这5个基因包括转录调控基因atf3[34],氧化应激反应相关基因atf3[35]、gstp1.2[29]、prdx1[36-37]、hsp70l[38]、hsp90aa1.1[39],免 疫 调 控 相 关 基 因atf3[40]、prdx1[41]及血管形成相关基因prdx1[42].atf3基因属于亮氨酸拉链转录因子家族,哺乳动物中ATF3在受到毒性伤害的组织、癫痫发作后的大脑等细胞应激部位中表达显著[43].gstp1.2基因在多种细胞过程中发挥重要作用,包括亲电子化合物的催化和脱氧、氧化应激调节、细胞信号传导和致癌作用[44],主要参与代谢、解毒并保护细胞免受DNA损伤和癌变[45-46].prdx1基因也是重要的抗氧化基因,其维护基因稳定性及防止突变[36],并且参与细胞生长、增殖、免疫响应及细胞凋亡等过程[37,41].hsp70l介导多种生物过程,参与斑马鱼的热适应、长期存活[47]和低温应激过程[48]. 研究发现,低温刺激显著增加鸡心脏和免疫器官Hsp70 mRNA的表达[49],具有保护脾脏和盲肠受到氧化应激反应和炎症损伤的作用[50].hsp90aa1.1基因属于热休克蛋白家族,参与早期肌肉发育和多种蛋白质的折叠、激活和组装[51],以及对金属离子的反应[52]. 研究[53]发现,镉暴露激活prdx1和hsp70等与氧化应激相关基因的表达,造成斑马鱼嗅觉损伤,导致斑马鱼捕食及抗捕食者的行为缺陷. 镉暴露会破坏嗅觉上皮基底细胞层,降低大脑区域中的膜流动性进而影响嗅觉[54].
atf3、jdp2b基因在斑马鱼胚胎的心包区域异常表达.jdp2b基因具有DNA结合转录因子活性. 哺乳动物中JDP2在抑制由组蛋白乙酰转移酶引起的组蛋白乙酰化过程中具有重要作用,其可以通过形成同型二聚体或招募组蛋白去乙酰化酶CRE,并与TRE DNA元件结合形成异型二聚体来抑制转录[55],也可以通过与CHOP10结合[56]或作为类固醇激素受体[57]激活转录. 转基因小鼠研究[58]发现,JDP2过表达会引起小鼠心房扩张和轻微心室增厚,导致4周龄jdp2转基因小鼠的死亡率明显上升. 作为JDP2同系物的ATF3,其过表达也会引起小鼠心脏肥大和功能障碍. 镉诱导atf3、jdp2b在胸鳍原基和尾鳍原基表达量上升,诱导jdp2b和gstp1.2基因在侧线器官异常表达,说明镉可能影响斑马鱼胸鳍、尾鳍和侧线器官的发育. 斑马鱼的侧线器官主要感受水流变化,由毛细胞和支持细胞组成,Wnt、FGF和Notch信号通路是斑马鱼侧线发育的主要调控因子[59]. 笔者研究中jdp2b与gstp1.2基因在白细胞处出现异常表达,近期研究[60]发现,甲基汞处理的斑马鱼胚胎也存在白细胞异常表达的现象,并且该研究发现白细胞参与侧线发育过程.jdp2b与gstp1.2基因在侧线和白细胞中的异常表达与斑马鱼胚胎侧线发育的关系需进一步研究.
镉诱导eif4a1b、hsp90aa1.1基因在眼睛晶状体异常表达. eIF4A是一种ATPase/RNA解旋酶,参与翻译过程,在新生小鼠的晶状体纤维细胞中高表达[61].研究[62]显示,hsp90α基因参与鱼类发育过程中晶状体细胞的凋亡过程. 已有研究[63-64]证明,镉通过阻断神经嵴的形成、抑制视网膜神经元的分化和破坏视网膜神经节细胞的轴突形成等过程影响斑马鱼胚胎眼睛的发育. 镉诱导eif4a1b和hsp90aa1.1基因在晶状体中的异常表达与斑马鱼晶状体发育和视觉功能的关系需要进一步研究.fabp7a基因在斑马鱼神经系统发育过程中发挥重要作用[31],其在中枢神经系统和视网膜中表达,Notch信号通过维持fabp7a基因的表达来调控神经周围神经胶质细胞的发育[65]. 此外,该基因也一定程度上参与了眼睛发育过程[66]. 镉暴露导致其表达量显著上调,镉是否通过影响fabp7a基因在中枢神经的表达进而影响神经功能,需进一步研究.
3 结论
a) 20.00 mg/L镉暴露导致斑马鱼胚胎出现小头、小眼、躯干弯曲、心包水肿、卵黄囊异常以及死亡等异常,计算得到镉暴露120 hpf后斑马鱼胚胎的LC50浓度为15.20 mg/L.
b) 7.50 mg/L镉诱导prdx1、gstp1.2、atf3、jdp2b、hsp70l、eif4a1b和fabp7a基因的表达量显著上升,说明镉可能影响斑马鱼胚胎的氧化应激、转录翻译和早期神经发育等过程.
c) 7.50 mg/L镉诱导基因在神经组织、视网膜、晶状体、嗅球、侧线、心脏以及皮肤等组织和器官异常表达,说明镉可能通过影响基因的表达区域,干扰斑马鱼胚胎的多个组织和器官的发育,进而造成嗅觉、视觉和运动等功能缺陷.
