婴幼儿配方乳粉中乳清蛋白检测及蛋白热变性的研究进展
2022-05-19徐涛陈璟瑶杨宝雨乔为仓姜铁民陈历俊
徐涛,陈璟瑶,杨宝雨,乔为仓,姜铁民,陈历俊
(1.大连工业大学 生物工程学院,辽宁 大连116033;2.北京三元食品股份有限公司 国家母婴乳品健康工程技术研究中心,北京100163;3.桂林理工大学国家母婴乳品健康工程技术研究中心南亚分中心,广西 桂林541006)
0 引言
乳清蛋白作为配方奶粉一项重要检测指标,在食品安全国家标准GB 10765-2010中规定婴幼儿配方奶粉乳清蛋白的质量分数应大于60%[1]。然而,最新的国标中只规定了含量标准未规定检测方法,其检测仍沿用国标GB/T 5413.2-1997中的乳清蛋白检测方法。由于原料牛乳在加工前后会出现热变性产生交联蛋白,导致生产厂商不能有效对原辅料进行监测把控,相应监管部门也无法实现对终端乳粉产品进行质量监管。因此,明确蛋白受热结构变化进而开发更为准确的乳清蛋白定量检测方法是乳制品行业迫切所需。本文从乳清蛋白热变性和乳清蛋白检测方法两个方面。综述了国内外相关研究进展,旨在为婴幼儿配方乳粉加工前后乳清蛋白含量检测提供参考。
1 乳清蛋白组成与功能
乳清蛋白是乳液中多种可溶性蛋白的总称,必需氨基酸种类齐全,有极高的生物利用效价,主要包括α-乳白蛋白(α-Lactalbumin,α-La)、β-乳球蛋白(βlactoglobulin,β-Lg)、免疫球蛋白(immunoglobulins,Ig)和牛血清白蛋白(Bovine albumin,BSA)等生物活性物质,见表1。

表1乳清蛋白各组分生理功能
2 乳清蛋白热变性对定量检测的影响
乳具有一定的热稳定性,在加热过程中,乳的热稳定性受到乳清蛋白蛋白变性、酪蛋白胶束的解聚及其表面电荷的变化、蛋白之间的共聚合作用和乳中各成分平衡被破坏的影响。其中,乳清蛋白自身结构变性和乳蛋白之间的相互作用能够导致配方乳粉中乳清蛋白的检测出现误差。如赵亭亭等[9]使用聚丙烯酰胺凝胶电泳(SDS-PAGE)分析了不同受热情况对乳粉中乳清蛋白的影响如图1所示,从左到右样品受热温度依次升高。在受热温度低时,乳清蛋白条带清洗且颜色较深;随温度升高,乳清蛋白中β-乳球蛋白与α-乳白蛋白条带颜色变浅。而酪蛋白条带无明显变化。可见使用SDS-PAGE检测乳制品中的乳清蛋白会有一定的限制,受到加工工艺的影响。除SDSPAGE检测外,使用毛细管电泳,超高效液相色谱等在蛋白水平的检测方法也都会受到蛋白变性的影响。与生牛乳相比较,加工后乳制品的检测谱图峰形发生偏移,峰底扭曲,导致检测结果不准确[10-11]。而其他在肽段水平或者氨基酸水平的检测方法,由于蛋白质被进一步分解,其空间结构的变化不会影响到检测结果。

图1 SDS-PAGE对不同受热温度乳蛋白的检测
2.1 乳白蛋白热变性
α-乳白蛋白分子内含有8个半胱氨酸残基,在Cys6-Cys120,Cys60-Cys77,Cys73-Cys90,Cys28-Cys111处能够形成二硫键,由于自身不含游离的巯基,热处理不会使其分子间发生二硫键的交换,受热更稳定。当温度到达一定程度时α-La自身的二硫键才会被破坏,蛋白结构完全展开如图2所示,展开后的α-乳白蛋白能够与含游离巯基的其他蛋白质结合形成蛋白聚合体[12-14]。α-La的热稳定性还与环境中Ca2+浓度有关,α-La上与Ca2+结合的位点是四个带负电的天冬氨酸,在未结合Ca2+时,其自身的静电排斥会影响蛋白二级结构发生变化,进而导致蛋白内的疏水位点更容易接触到外部,降低蛋白稳定性[13]如图3所示。

图2热处理对α-乳白蛋白结构的变化
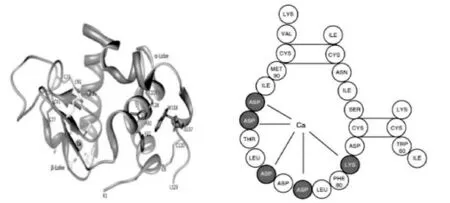
图3α-乳白蛋白与金属离子结合
2.2 乳球蛋白热变性
β-乳球蛋白自身极易受温度与p H值的影响,根据受热温度不同其自身的变化也不同。中性溶液中,温度在30℃以下时β-乳球蛋白以单体和二聚体的形式存在,两者能够相互转化并维持在一个平衡状态;温度达到30℃以上,此时β-乳球蛋白的平衡会向单体形态转变,最终以单体的形式存在[16];在温度60℃以上时,β-乳球蛋白的空间折叠结构逐渐被打开,维持β-乳球蛋白基本结构的二硫键发生交换,发生不可逆的变化;当温度高于85℃时,β-乳球蛋白的螺旋结构消失,巯基暴露,疏水性增强,分子之间通过二硫键与疏水作用折叠成热变性聚合物如图4所示。在高温条件下热变性聚合物的二硫键会发生断裂,β-乳球蛋白会得到进一步伸展[17-19]。

图4热处理前后β-乳球蛋白结构变化
2.3 热处理对蛋白之间相互作用的影响
在乳的加热过程中,β-乳球蛋白的球状结构先被打开,通过二硫键的交换进而形成聚集体;随着温度升高α-乳白蛋白空间结构也被打开与变性的β-乳球蛋白结合形成蛋白聚合体。乳清蛋白在受热变性结构展开的过程中,其中的硫巯化合物与二硫键会与κ-酪蛋白相结合形成乳清蛋白-酪蛋白复合物[20]。
乳中另一部分重要的蛋白是酪蛋白,酪蛋白相较于乳清蛋白具有更高的热稳定性,只有当温度达到140℃时酪蛋白才会发生变性。酪蛋白对乳清蛋白热聚合的保护性影响早在1964年就被发现,Kehoe等[21]发现β-酪蛋白能够改变乳清蛋白在加热过程中的热聚集现象,β-酪蛋白并没有改变乳清蛋白的变性温度也不是通过减缓聚集过程发挥作用,而是以竞争的方式影响乳清蛋白的热聚集,β-酪蛋白形成的聚集体比乳清蛋白自聚集形成的聚集体小。更小的聚集体的形成产生更不浑浊、更可溶的蛋白质溶液[22]。Arzuaga MR等[23]研究中发现在乳清蛋白加热变性聚集过程中,酪蛋白的存在并没有阻止变性行为的发生,但在酪蛋白-乳清蛋白体系中蛋白质的溶解度增加了100%,能够防止蛋白加热时的聚集行为。Liyanaa rachchi等[24]研究不同酪蛋白与乳清蛋白比例对乳清蛋白热凝集的影响,在p H 7.5,酪蛋白与乳清蛋白(30∶70)时乳清蛋白的二级构象受加热过程的影响最小,酪蛋白某个阶段终止了乳清蛋白的变性和聚集过程。
3 乳清蛋白检测方法
研究者针对配方乳粉中乳清蛋白各组分蛋白(α-La,β-Lg和BSA等)展开了一系列的方法研究,虽检测对象略有不同,但乳清蛋白中各组分蛋白之间的检测方法具有通用性。目前主要的检测方法包括十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(Sodium dodecyl sulfate polyacrylamide gel electrophoresis)、氨基酸折算法、毛细管电泳(capillary electrophoresis,CE)、高效液相色谱(High Performance Liquid Chromatography,HPLC)和液相色谱-质谱联用(liquid Chromatograph Mass Spectrometer,LC-MC)等,见表2。

表2乳清蛋白各种检测方法对比
3.1 毛细管电泳
1981年Jorgenson等人首先提出使用高压电作为动力在毛细管中进行样品分析,毛细管电泳技术诞生,由于其在生命科学领域对蛋白质等生物分子分离效果突出,得到迅速发展。最终发展成为在直流高压场中以毛细管作为分离通道根据各检测成分的淌度和分配行为差异进行分离的高效电泳技术[32]。目前解决毛细管吸附问题提高检测准确性的方法主要是在毛细管内施加非共价键合涂层或共价键合涂层抑制内壁对大分子的吸附[33];此外调整电泳缓冲液,也能有效降低毛细管电泳的吸附[34]。
Zhao J等[35]使用带有双C4D/UV检测器的毛细管电泳同时测定牛奶中的主要金属阳离子和乳清蛋白,阳离子检测分析过程中日内和日间的相对标准偏差(RSD%,n=5)分别为0.37%~0.55%和0.46%~0.79%,在乳清蛋白检测分析中,β-Lg和α-La的检测限分别为5 mg/L和3 mg/L,日内和日间相对标准偏差(RSD%,n=5)为0.29%~0.31%,迁移时间在0.43%~0.48%之间,峰面积为2.89%~3.25%和3.29%~4.18%。
Ping Feng等[36-38]将乳清蛋白与酪蛋白看作整体,通过对脱脂奶粉的检测,即可确定乳清蛋白和酪蛋白的面积校正因子,从而建立了快速检测配方奶粉中乳清蛋白和酪蛋白比例的方法。实验对不含蛋白质的配方乳粉进行测定,从而证明在检测配方乳粉时其他成分不会影响检测结果。经过多次验证已被国际标准化组织(ISO)设为检测乳基婴儿配方粉中乳清蛋白的标准检测方法(标准号ISO 23293-2020)。
3.2 SDS-PAGE
1959年Raymond等人利用人工合成的凝胶进行电泳分析,创建了聚丙烯酰胺凝胶电泳。直至今日,聚丙烯酰胺凝胶电泳被广泛应用于生命科学领域中对蛋白质、多肽、核酸等生物大分子的检测鉴定。Robert G.E等[39]在SDS-PAGE过程中,使用阳离子染料结晶紫代替考马斯亮蓝进行染色,染色蛋白可以转移到硝基纤维素上,western染色蛋白用酶偶联抗体检测。实验中结晶紫能够染色到16 ng的蛋白质且无需脱色过程,比考马斯亮蓝染色低5倍,两者具有相同的线性动态范围。贾宏信等[40]在实验过程中,使用成像仪代替检测凝胶条带的光密度计,通过chemiDoc XRS与成像系统的Quantity One图像处理软件根据条带颜色深浅计算蛋白含量,最终检测值的RSD在1.85%~4.35%之间。
3.3 氨基酸折算法
氨基酸折算法是根据牛奶和乳清蛋白含有的独特氨基酸图谱,通过特定的氨基酸的差异来计算乳清蛋白含量的一种方法。Wesley等[41-42]对多种乳制品中乳清蛋白检测的精确度进行检测评估。比对实际值与检测质,其重复性的估计值在0.3%~2.5%之间,平均回收率在97%~100%之间。
由于该方法的氨基酸含量对蛋白含量的计算转化是通过经验总结的,并没有对蛋白进行直接的测定。李爽等[43]对氨基酸折算法计算奶粉中乳清蛋白含量的方法进行评估,对国内外品牌婴幼儿配方粉检测发现,一阶段奶粉中乳清蛋白的检测值高于标示值5%~10%,二、三段的奶粉乳清蛋白也与商品标示值有所偏差。实验另一结果显示,在对添加有大豆分离蛋白的奶粉使用该方法检测时,乳清蛋白的检测结果会发生明显的升高,当配方奶粉中添加20%的大豆蛋白时,乳清蛋白的检测量从27.78%增加至63.99%。
3.4 高效液相色谱
高效液相色谱是根据样品混合物中各组分之间结构和性质的不同,在流动相和固定相之间作用大小不同,从而使各组分形成滞留时间的差异。在1971年由科克兰提出之后,该方法被广泛用于化工,环境,生物,药物和食品等领域。HPLC对配方乳粉中乳清蛋白的检测仅适用于某些蛋白,无法广泛应用于全部乳清蛋白的分析,Xiaojing Ding等[44]在实验过程中发现α-La与乳铁蛋白在检测中峰形会出现重叠从而干扰α-La检测结果,建立了HPLC对乳制品中β-Lg的检测,β-Lg A和β-Lg B的线性系数分别为0.9998和0.9997,浓度范围内的回收率在90.7%至116.8%之间。Farid M等[45]开发了针对配方乳粉中骨桥蛋白检测方法,通过反相色谱原理在HPLC上在214 nm处检测分析,其结果线性大于0.999,检出限与定量限分别为0.14 mg/L和0.41 mg/L,相对标准偏差(RSD)<0.2%。
3.5 液相色谱-质谱联用法
20世纪80年代末,John Fenn发现了电喷雾电离(ESI),使液相色谱-质谱联用(LC-MS)技术获得巨大发展。LC-MS技术将LC的物理分离能力与MS的质量分析能力相结合,以其无与伦比的高灵敏度和高选择性的混合分析能力成为蛋白质组学中最重要的一部分[46-48]。Ke Xing等[49]使用高效液相色谱-串联质谱联用,对以牛乳或羊奶为乳基的配方乳粉中两种乳清蛋白(α-la,β-lg)与4种酪蛋白(αS1-cs,αS1-cs,β-cs,κ-cs)进行定量分析,目标蛋白的定量限为0.01%~0.05%日内和日间精密度的RSD分别为2.8%~6.2%和3.3%~9.8%,回收率范围为82.3%~116.6%,在不同的加标水平下具有很好的重现性(RSD<12%)。Wang Z等[50]使用液相色谱-串联质谱法评估乳清蛋白分析中牛α-La肽及其同位素标记的肽之间的相互干扰。其中α-La肽的浓度对其相应的同位素标记肽段在正电喷雾源(ESI)下的MS响应值有显著影响,而β-Lg对其同位素标记肽段的MS强度影响不大。研究对实验的前处理操作材料(移液器/注射器,过膜材料)进行评估,在经过注射器后α-La肽于其标记肽的信号强度降低了50%,在经过过滤器之后α-La肽与其标记肽信号强度变化不大,β-Lg信号强度降低了50%。
3.6 其他方法
近几年研究者们提出了通过学科交叉开发蛋白检测新技术。王士峰等[51]根据胶体金免疫层析技术,通过胶体金标记的β-Lg单克隆抗体和IgG制成免疫层析试纸,进而完成对配方羊奶粉中β-Lg的快速检测。根据抗原抗体特异性结合的特点检测目的蛋白的酶联免疫吸附技术(ELISA)对乳清蛋白中的牛血清蛋白和乳铁蛋白也具有很好的检测效果[52-53]。
2005年,Indyk等[54-57]将生物感应器与乳清蛋白检测相结合,提出通过光学生物传感器检测乳制品中蛋白的方法,使用表面等离子共振技术(Surface Plasmon Resonance,SPR)检测乳制品中乳铁蛋白和Ig的检测方法。Jagan M.Billakanti等[58]在其之后对SPR检测进一步优化调整,测定原料奶、加工奶和各种奶制品中的蛋白时具有相对较好的准确性。与光学生物传感器检测不同,Eissa等[59]针对乳制品中过敏原β-Lg的实时检测,开发了一种基于适体/石墨烯的电化学生物传感器,能够同步,低成本的检测β-Lg,且具有较高的灵敏度。除此之外,由于单一的检测技术具有各自的优缺点,通过两种或多种技术相结合也是研究者关注的热点。De Carvalho等[60]将分光光度法与多元校正法相结合建立了快速检测乳清蛋白中糖巨肽蛋白的检测方法,实现了对奶粉中乳清掺假的快速、低成本检测。
4 结果与展望
本文结合近几年国内外文献,综述了目前配方乳粉中乳清蛋白定量检测的研究进展,对各检测方法优缺点以及各方法的优化改善研究进行了总结;归纳了乳清蛋白组成与其受热条件下,蛋白空间结构的变化;解释了乳清蛋白变性对其定量检测的影响。以期为婴幼儿配方乳粉加工前后乳清蛋白定量检测提供参考。
当前可用于生产实践中的乳清蛋白检测技术并不多,大多数的检测技术由于其成本,操作和仪器等问题仅能在实验室内进行。各定量方法中质谱检测技术被大多数研究者认可,在其基础上进一步降低成本,简化操作,应是乳清蛋白定量研究的一个方向;另外乳清蛋白作为一个蛋白组,检测过程中往往仅是对其主要的几种子蛋白进行单独定量,最终计算乳清蛋白含量。不定量单个蛋白,直接将乳清蛋白当作整体来进行定量分析(如Ping Feng,毛细管电泳法)或许是种不错的选择;另一方面对乳清蛋白的检测应尽量在肽段或者氨基酸的水平进行,使其能够避免蛋白质自身结构变化对检测结果的影响。以质谱技术为基础,在不使用同位素标记的情况下对乳清蛋白整体进行相对定量,有可能得到我们所期待的方法。
