不同热处理液态牛乳产品中主要活性蛋白质量浓度差异研究
2022-05-19赵笑白沙沙孔凡华徐佳佳柴艳兵张耀广李兴佳李飞李东崔亚娟
赵笑,白沙沙,孔凡华,徐佳佳,柴艳兵,张耀广,李兴佳,李飞,李东,崔亚娟
(1.北京市营养源研究所,北京100069;2.石家庄君乐宝乳业有限公司,石家庄050221;3.河北君乐宝君源乳业有限公司,石家庄050011;4.北京市科学技术研究院,北京100089)
0 引言
乳清蛋白主要含有α-乳白蛋白和β-乳球蛋白等[1]。活性乳清蛋白与一般的乳清蛋白相比,具有更高的营养价值[2]。牛乳加热可促进蛋白质相互作用并形成聚集体[3]。加热温度在70℃以上时,可导致β-乳球蛋白和α-乳白蛋白的变性[4]。目前,加热牛奶时产生的蛋白质变性和结构改变已被广泛研究[5-6],然而面对市场上各式各样的液态乳产品,更多人关注的是牛乳中所含有的活性蛋白质究竟有多少。
高效液相色谱法(HPLC)是测定乳蛋白质量浓度最常用的方法[7-9]。但该方法用时较长且稳定性存在差异[10-11]。因此,本文建立了反相高效液相色谱法(RPHPLC),测定了市售乳中活性蛋白的质量浓度,为液态乳的加工提供理论依据。
1 材料与方法
1.1 材料与试剂
低温存放(2~6℃)的液态乳(编号D1-D 12,D28,D29,D30,其中D 3为高温杀菌乳,D12,D29,D30为灭菌乳,其余为巴氏杀菌乳)和常温存放的液态乳(编号C13-C27,均为高温灭菌乳)购自北京当地超市;原料乳(编号Y31-Y35)由北京当地牧场提供;α-乳白蛋白(α-lactalbumin,α-La,纯度≥85%)、β-乳球蛋白(β-lactoglobulin,β-LgA和β-LgB,纯度≥90%)标准品购自美国Sigma公司;乙腈为液相色谱级;柠檬酸钠、盐酸胍、丙烯酰胺、双丙烯酰胺、巯基乙醇等其他试剂均为分析纯,购自国药集团化学试剂有限公司。
1.2 仪器与设备
数显p H计FE20,梅特利-托利多(上海)仪器有限公司;高速冷冻离心机CR 21Ⅲ,日本HITACHI公司;台式高速离心机5424,德国Eppendorf公司;蛋白电泳系统(Mini-Protean,PowerPac Basic),美国Bio-Rad公司;全自动凝胶成像系统,美国Bio-Rad公司;高效液相色谱(UltiMate 3000),美国Thermo Fisher Scientific公司。
1.3 方法
1.3.1 pH 4.6沉淀乳蛋白
取液态乳样品10 mL,加入30 mL蒸馏水,混匀后用纯乙酸调节p H至4.6。沉淀后的样品经6 000 r/min离心10 min,取上清作进一步研究。
1.3.2 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDSPAGE)
SDS-PAGE是根据Laemmli[12]中叙述的方法进行并有所改动。样品处理液配置为2%SDS,50%甘油,10%SDS和Tris-HCl的混合液,4%巯基乙醇,质量分数0.1%的溴酚蓝。为了使结果对比更简明清晰,减少实验样品量,从随机编号的15个低温乳和15个随机编号的常温乳中各选择5个样品,5个随机编号的原料乳中选择2个样品,即样品D1~D5,C13~C17,Y31,Y32,经p H 4.6沉淀后与样品处理液以3∶1的比例混匀,未经p H 4.6沉淀的样品(D1~D5,C13~C17,Y31,Y32),在4℃条件下,转速为6 000 r/min离心10 min去除上层脂肪后,与样品处理液以3∶1的比例混匀,将上述样品沸水浴5 min,冷却至室温,使用台式高速离心机室温条件下转速5 000 r/min离心5 min,离心后取上清直接上样,上样量为5μL。浓缩胶质量分数为4.5%,分离胶质量分数为12.5%。电压程序的设定如下:将电压保持恒定在70 V,直到样品到达浓缩胶和分离胶之间的交界处,然后降低到50 V,直到样品到达分离胶结束前1.5 cm的位置。取下蛋白凝胶用质量浓度为0.1 g/L考马斯亮蓝R 250染色20 min,并配置甲醇∶冰醋酸∶去离子水比例为250∶70∶680(体积比)的洗脱液,进行脱色处理,使用全自动凝胶成像系统对凝胶进行扫描和软件分析。
1.3.3 液相色谱样品前处理
取1.3.1中经pH 4.6沉淀后的液态乳样品上清液,经0.45μm滤膜过滤,打入液相小瓶后直接上样。
1.3.4 仪器条件
Waters ACQUITY UPLC 300 Protein BEHC4色谱柱(2.1 mm×100 mm,1.7μm);检测波长为280 nm;柱温为60℃;进样量为10μL;流速为0.45 m L/min。
1.3.5 色谱条件
流动相分为A液和B液:A液为0.1%TFA水溶液,B液为0.1%TFA乙腈溶液,进行梯度洗脱。梯度洗脱程序如下:0~1.5 min,5%B;1.5~2.5 min,5%~38%B;2.5~6.5 min,38%~41%B;6.5~7.6 min,41%~95%B;7.6~8.0 min,保持95%B;8.0~8.1 min,95%~5%B;8.1~10.0 min,5%B。
1.3.6 精密度和稳定性实验
根据SDS-PAGE结果和预实验测定,选择α-La,β-LgA和β-LgB质量浓度中等,具有代表性的样品D4,进行精密度、稳定性和回收率的实验。
精密度实验设计:选取D4样品,将样品按照
1.3.1 处理后,精密吸取10μL样液,在1.3.5条件下平行测定6次,计算α-La,β-LgA,β-LgB质量浓度和相对标准偏差。
稳定性实验设计:选取D4样品,将样品按照1.3.1处理后,平行操作6份,在1.3.5条件下,进样测定,计算α-La,β-LgA,β-LgB质量浓度和相对标准偏差。
1.3.7 标准品回收率实验
选取D4样品,将样品按照1.3.1处理后,每种标准蛋白(α-La,β-LgA,β-LgB)分别加入一定数量。测定添加标准蛋白前后样品中各蛋白质组分的总质量浓度,并计算标准样品的回收率。加标回收率(%)=(加标试样测定值-试样测定值)/加标量×100%。
2 结果与分析
2.1 pH4.6沉淀前后样品中蛋白差异电泳分析
为更好的分析牛乳活性蛋白,了解经p H 4.6沉淀后,牛乳中不同蛋白的保留情况,选取部分原料乳、常温和低温保存的牛乳,对其p H 4.6沉淀前后样品中的蛋白进行了SDS-PAGE电泳分析。结果如图1所示。图1中,M为标准分子蛋白Marker,图1(a)中泳道2~10和图1(b)中泳道2~4为样品经p H 4.6沉淀后蛋白电泳,图1(b)中泳道5~10和图1(b)中泳道2~7为样品未经pH 4.6沉淀的蛋白电泳。由图1可以看出,未经pH 4.6沉淀的牛乳中酪蛋白(αs1-CN,αs2-CN,β-CN,κ-CN)则完整的体现在SDS-PAGE图谱中,其中κ-CN由于质量浓度较低,其对应的蛋白条带颜色较浅。而经p H 4.6沉淀后大部分的酪蛋白均被除去,剩余的蛋白中α-La,β-Lg,Lf和BSA的蛋白条带较为清晰,但不同牛乳样品中各组分的蛋白条带清晰程度差异较为明显。两种原料乳中乳清蛋白条带较为一致,而低温存放的牛乳中,样品D 2和D 3经p H 4.6沉淀后,乳清蛋白条带与其它低温存放的牛乳样品相比显著模糊,常温存放的牛乳样品经p H 4.6沉淀后,乳清蛋白条带颜色均较浅。结果表明p H 4.6沉淀可以很好的除去酪蛋白和变性的乳清蛋白,而不同热处理的商品液态乳中的乳清蛋白的变性程度不同,导致乳清蛋白中非变性活性乳蛋白在SDS-PAGE图谱中显示出粗细不同的条带。
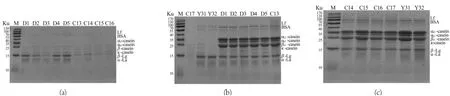
图1样品经pH4.6沉淀前后蛋白电泳结果
2.2 RP-HPLC方法的建立
2.2.1 方法精密度和稳定性结果
为了进一步分析液态乳中活性乳白蛋白和乳球蛋白的质量浓度,建立了RP-HPLC法。该方法的精密度和稳定性如表1所示。由表1可知样品经6次平行测定后,α-La,β-LgA,β-LgB质量浓度的平均值和相对标准偏差(RSD)分别为1.1129 g/L,1.4480 g/L,0.8004 g/L和0.49%,1.37%,1.17%。6个平行样品测定中α-La,β-LgA,β-LgB质量浓度平的均值和相对标准 偏 分 别 为1.1411 g/L,1.4459 g/L,0.7767 g/L和4.29%,6.61%,7.62%。表明在280 nm波长下测定样品质量浓度的相对标准偏差均小于10%,因此采用该方法对液态乳样品中这3种主要活性蛋白组分的定量检测结果具有很好的稳定性,符合检测要求。
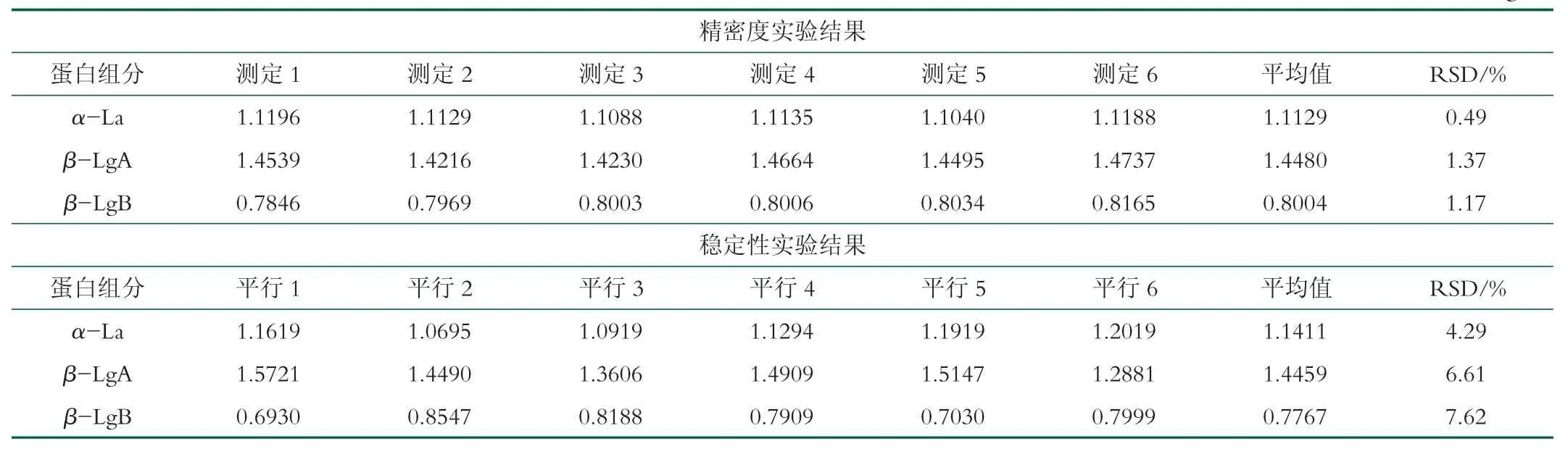
表1方法的精密度和重复性 g/L
2.2.2 标准品回收率结果分析
不同标准蛋白组分在液态乳样品中的回收率结果表明了标准物质在测定过程中的损失,损失越少则回收率越高。本研究中,α-La,β-LgA,β-LgB标准蛋白的回收率均在95%以上,且相对标准偏差在5%以下,见表2。结果说明该方法在液态乳定量测定中具有很好的回收率。
表2方法的标准回收率 mg/mL
2.3 样品中活性蛋白组分质量浓度的测定结果
2.3.1 标准曲线的建立与谱图分析
本实验采用外标法,以峰面积(mAU)为Y轴,以质量浓度(mg/mL)为X轴绘制标准曲线。α-La、β-LgB和β-LgA按照单峰面积进行统计计算,测定系数分别为0.9984,0.9986和1,见表3。通过表3中的标准方程和测定系数,证明了该方法在各自蛋白浓度范围内呈良好线性关系。

表3标准蛋白的线性方程和相关系数
分别选取蛋白标准(图2(a))、原料乳样品Y32(图2(b)),低温保存乳样品D 7(图2(c)),常温保存乳样品C13(图2(d))的图谱进行对比分析。由图2可知,3个目标蛋白在5~10 min内全部被洗脱,按照出峰顺序对应的目标蛋白依次为α-La、β-LgB和β-LgA。由图谱可知3种蛋白在标准品和样品中均得到了很好的基线分离,其中图2(b)和图2(c)中3种蛋白峰型比较一致,而图2(d)中蛋白峰面积很小,尤其是蛋白β-LgB所在位置的峰几乎检测不出,表明该样品中β-LgB蛋白质量浓度很低。
2.3.2 样品中活性α-La测定结果分析
由图3可知,5种原料乳样品中活性α-La质量浓度均高于1.32 g/L;而低温保存样品中,除D8,D9,D10,D11中α-La质量浓度均高于2.00 g/L外,D1,D4,D5中α-La质量浓度也较高,质量浓度在(1.00~1.50)g/L之间,其余样品α-La质量浓度均较低,尤其是D12,D 29,D 30这3个样品中α-La质量浓度低于0.15 g/L;而常温保存的样品中活性蛋白α-La质量浓度均低于0.16 g/L,其中C14样品的α-La质量浓度最高,为0.1551 g/L,其余常温存放样品的α-La质量浓度均很低,因此未在图3中表示。赵烜等[13]的研究表明α-La热变性后无法自聚,但能与β-Lg、免疫球蛋白等形成聚集体,有利于缩短发酵时间,改善凝胶后的凝胶结构,且高温短时巴氏杀菌乳中α-乳白蛋白质量浓度低于低温巴氏杀菌乳中的质量浓度。α-La在压力和加热条件下的动力学和热力学参数表明α-La的变性为一个聚集式反应[14],同时,在加热过程中,α-La的存在可导致位于乳铁蛋白内部的疏水残基进一步暴露,加速活性乳铁蛋白的变性[15]。Lorenzen等[16]的研究中原料乳的α-La质量浓度高于1.00 g/L,Boitz等[17]的报道中表明经巴氏杀菌后的牛乳中α-La质量浓度在1.020~1.152 g/L之间。相同热处理时间内,天然α-La的保留程度会随着热处理温度的升高而显著下降[18]。因此,本研究结果中样品α-La的质量浓度差异与前人研究结果相符合。
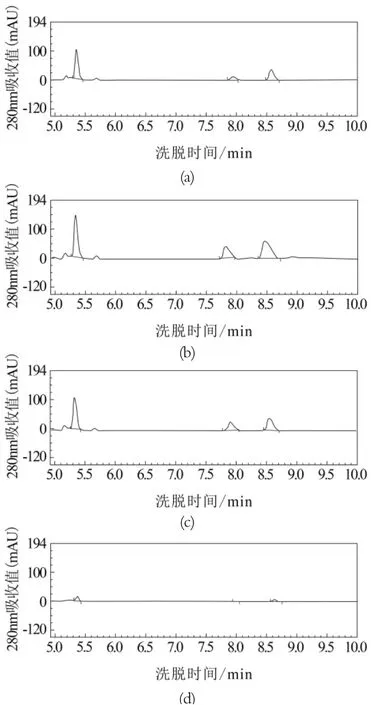
图2蛋白标准和样品的HPLC图谱
2.3.3 样品中活性β-Lg(β-LgA和β-LgB)测定结果分析
由图4可知,5种原料乳样品中β-LgA质量浓度高于1.55 g/L,β-LgB质量浓度高于0.95 g/L;低温存放的样品除D3,D12,D28,D29,D30质量浓度低于0.10 g/L外,其余样品中β-LgA和β-LgB质量浓度在0.19~2.70 g/L之间。这是由于不同乳蛋白组分的变性温度不同,β-Lg在温度达到75℃时开始变性,且变性程度不仅与热处理温度密切相关还受持续时间的影响[19]。常温存放的乳样品中,25号样品β-LgA的质量浓度最高为0.0751 g/L,24号样品β-LgB的质量浓度最高为0.0218 g/L,其余常温存放样品的β-LgA和β-LgB质量浓度均很低,未在图4中标出。有关研究表明经巴氏杀菌的牛乳中β-Lg质量浓度高于2.00 g/L,而经超高温瞬时灭菌的牛乳中β-Lg质量浓度低于0.05 g/L[20]。Zhu等[21]的研究表明,在热处理过程中β-LgB和β-LgA的变化趋势相似,在55℃或65℃加热时,β-LgB和β-LgA的变性程度性均不超过10%,而在95℃加热5 min后,则几乎全部发生变性。Bogahawaththa等[22]的研究表明75℃处理15 s基本不会使β-Lg及β-Lg与α-La的混合物蛋白变性。这些研究结果与我们的研究结果较为一致。也有研究表明β-Lg在70℃下加热30 min,蛋白质即展开,并形成不可逆的二聚反应[23]。本研究中低温存放的巴氏杀菌乳大多满足国际乳品联合会(International Dairy Federation,IDF)中要求的巴氏杀菌乳中β-Lg最低质量浓度为2.60 g/L,高温巴氏杀菌乳最低质量浓度为2.00 g/L的标准[24]。
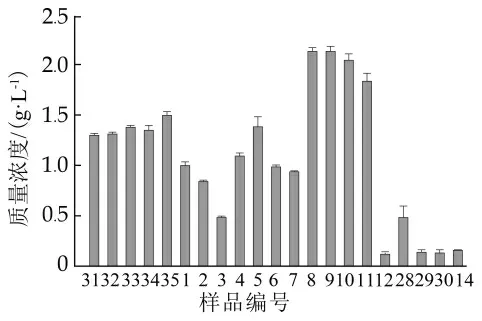
图3样品中α-乳白蛋白质量浓度
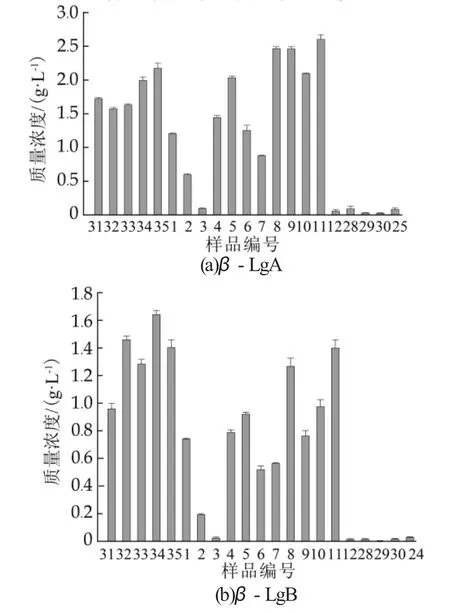
图4样品中β-乳球蛋白的质量浓度
2.3.4 样品活性蛋白与保质期关系的综合分析
图5显示了样品中活性蛋白α-La、β-LgA和β-LgB,及其总量与样品保质期的关系。当保质期小于1 d时,活性蛋白保持的均较好,保质期在7,15,30 d内时,与未经过热处理的原料乳相比,活性蛋白质量浓度则有所降低,但不同样品中活性蛋白的最终质量浓度有所差异。其中D3样品中蛋白质量浓度较低,这与SDSPAGE图谱中测定的D3样品的结果一致。当样品保质期在30~45 d内时,活性蛋白质量浓度均显著降低,当样品(编号C13~C25)保质期为180 d时,活性蛋白质量浓度均低于0.24 g/L,因此未在图5中表示。同理,Sabrina等[25]的报道中阐述了热加工强度增加,可延长货架期的同时也会不同程度的破坏乳蛋白,并可根据活性乳蛋白如β-Lg的质量浓度来判断乳及乳制品的热加工程度。总之,液态牛乳经巴氏杀菌后,只能杀死大部分致病微生物,还会留有一些无害或有益但致死条件比较高的微生物,之后还需要冷链储存和运输,保质期相对较短,只有3 d到15 d不等,但该方法可保持牛奶的一些活性蛋白成分。而牛奶经高温杀菌后,所有的微生物几乎被杀灭,但极高的温度也会令牛奶中一些热敏活性蛋白质有所损失。
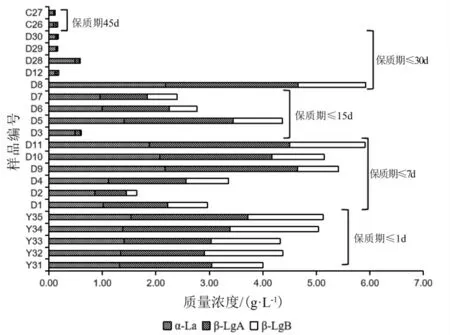
图5样品中活性蛋白质量浓度与保质期的关系
3 结论
市售液态牛乳经p H 4.6沉淀后,酪蛋白和大部分变性的乳清蛋白可被除去,上清液中保留的活性α-乳白蛋白和β-乳球蛋白质量浓度可用本研究建立的RP-HPLC方法在10 min内快速准确地检出。经巴氏杀菌后的牛乳中活性蛋白质质量浓度与原料乳相比变化不大,甚至部分高于原料乳中活性蛋白测定量,而经灭菌后低温存放的牛乳中活性蛋白质量浓度较低;经高温灭菌的牛乳中活性蛋白的保留很低;因此,经巴氏杀菌后低温存放的鲜牛奶能够最大程度的保留乳中活性蛋白。
