体积排阻色谱法测定牛奶、乳粉、乳清粉中α-乳白蛋白的含量
2022-05-19杜茹芸王亮林毅侃
杜茹芸,王亮,林毅侃
(上海市质量监督检验技术研究院,上海200233)
0 引言
牛奶及其制品作为一种优质蛋白补充来源的食物,几千年前就已经被人类用来补充营养,也是目前世界上主流国家官方营养推荐的食品之一。从营养学的角度来看,牛奶及其制品可以满足人类对于蛋白质日常需求的20%~28%,其中年龄越小对于牛奶等乳制品的需求量也会越大[1-3]。乳制品中的活性蛋白,除了有着较高的营养价值外,还有诸多的生物活性功能,对于人体的肠道、血糖、血脂以及骨骼等都有不同的功效[4-7]。
牛乳蛋白质主要分为酪蛋白和乳清蛋白,分别占牛乳蛋白质的80%和20%。牛乳中的乳清蛋白又包括α-乳白蛋白、β-乳球蛋白、乳铁蛋白以及免疫球蛋白等,其中α-乳白蛋白是乳清蛋白中含量第二丰富的蛋白质,约占乳清蛋白的20%。α-乳白蛋白的分子量较小,约为14 000 u,从而易于吸收,可以有效减轻老年人和婴幼儿的肾脏负担,是必需氨基酸和支链氨基酸的极好来源。α-乳白蛋白富含的色氨酸是神经发育的重要因子,能够显著改善婴幼儿以及成人的睡眠质量。α-乳白蛋白在牛乳中含量较低,只占总蛋白的2%~3%。母乳中则含量较高,占总蛋白的20%~25%。因此越来越多的婴幼儿配方乳粉额外添加α-乳白蛋白,使其含量接近母乳水平。其他一些针对特殊人群的配方粉中也可能添加了α-乳白蛋白[8-10]。
乳制品和婴幼儿配方乳粉中α-乳白蛋白含量的检测技术一直是研究热点,常规的分析蛋白的方法包括免疫学方法(ELISA)、液相色谱法、毛细管电泳、LCMS的方法等等。其中ELISA的方法取决于抗体的特异性,成本较高并且定量的准确性不能保证。毛细管电泳法受限于仪器的应用没有那么全面,很多企业和机构都没有配备。LC-MS方法需要酶解以及合成特异性的肽段,操作复杂,对于人员要求较高,且酶解过程不可控[11-18]。因此,液相色谱法相对来说应用最广泛,由于α-乳白蛋白和β-乳球蛋白的分子量太过接近,需要选取合适的体积排阻色谱柱对两种蛋白进行分离,从而准确测得α-乳白蛋白的含量。
本研究选取了合适的体积排阻色谱柱,并且不仅针对于婴幼儿配方产品,还将同样有市场需求的乳清粉和牛乳中的α-乳白蛋白的含量检测进行了研究,从而开发了一种可以同时用于检测婴幼儿配方牛乳粉、牛乳清粉以及牛乳中α-乳白蛋白含量的检测方法,并且对市场上多批次的产品进行了检测。
1 材料与方法
1.1 材料与试剂
40批次婴幼儿配方乳粉和10批次牛奶来源于网络及超市购买、10批次乳清粉由企业提供。
α-乳白蛋白标准品(牛源,纯度≥85%)、β-乳球蛋白标准品(牛源,纯度≥85%),美国Sigma公司;β-巯基乙醇,上海普誉科贸有限公司;盐酸胍(优级纯),上海阿拉丁生化科技股份有限公司;β-巯基乙醇,美国Sigma公司;磷酸二氢钠、磷酸氢二钠、乙二胺四乙酸、盐酸、氢氧化钠(分析纯),国药集团化学试剂有限公司。
1.2 仪器与设备
Waters 2695高效液相色谱仪带DAD检测器,美国Waters公司;MS304S电子分析天平(感量0.1 mg),瑞士梅特勒-托利多仪器有限公司;GL-88B漩涡混合器,其林贝尔仪器制造有限公司产品。
1.3 方法
1.3.1 流动相配制
缓冲溶液:称取56.6 g磷酸氢二钠、3.5 g磷酸二氢钠和2.9 g乙二胺四乙酸,将其溶解到800 mL水中,测量p H,如有必要,用50%氢氧化钠溶液或盐酸将p H调节到7.0±0.5。将溶液转移至1 000 mL容量瓶,用水定容至1 000 mL。
流动相:称取573 g盐酸胍,置于1 000 mL广口锥形瓶中,添加100 mL缓冲溶液,再用水将该溶液稀释到约900 mL,同时不停搅拌,用50%氢氧化钠溶液,将p H调节到7.0±0.5。将溶液转移至1 000 m L容量瓶中,并用水定容至刻度。0.45μm滤膜过滤。
1.3.2 标准溶液配制
由于β-乳球蛋白的分子量与α-乳白蛋白接近,是干扰α-乳白蛋白测定的主要蛋白,因此每次进标准样品都需要加上β-乳球蛋白用于判定两者的分离情况。
标准储备液:根据每批次标准品提供的COA分析证书,称取含有10 mg(精确到0.1 mg)α-乳白蛋白标准品和10 mg(精确到0.1 mg)β-乳球蛋白标准品,置于10 m L容量瓶,用水充分溶解后定容,作为α-乳白蛋白和β-乳球蛋白混合标准储备液,浓度为1.0 mg/mL。
标准曲线溶液:分别移取标准储备液0.25、0.5、1.25、2.5、5 m L至10 m L容量瓶中,用流动相溶解并定容至刻度,配成浓度为10、25、50、125、250、500 mg/L的标准工作溶液。标准工作溶液应现用现配。分别取1.5 m L配置好的标准工作溶液,分别加入10μL 2-巯基乙醇,旋紧瓶盖,剧烈振荡10 s,置于室温下2 h后再进行高效液相色谱分析。制备好的标准曲线溶液应在48 h内测定。
1.3.3 样品前处理
(1)牛奶:称取0.5 g牛奶,置于10 m L容量瓶中,加入流动相定容至10 mL,溶液备用。
(2)奶粉:称取1.0 g奶粉,置于10 m L容量瓶中,加水使样品溶解,如样品溶解不完全,可使用超声仪超声,应保持样品温度不高于30℃,样品完全溶解后,加水定容至10 m L。吸取1.0 m L溶解后的样品至10 m L容量瓶中,加流动相定容至10 m L,溶液备用。
(3)乳清粉样品:称取1.0 g乳清粉样品,置于100 mL容量瓶中,加水使样品完全溶解后,用水定容至100 mL。吸取一定量溶解后的样品至10 mL容量瓶中,用流动相进行稀释,使α-乳白蛋白的含量在标准曲线范围内,溶液备用。
(4)还原反应:取上述备用溶液1.5 m L,加入10μL 2-巯基乙醇,旋紧瓶盖,剧烈振荡10 s,置于室温下2 h后再进行仪器分析。制备好的样品应在48 h内进行测定。
1.3.4 色谱仪器条件
(1)高效液相色谱仪:Waters 2695带二极管阵列检测器;色谱柱:体积排阻色谱保护柱:MAbPac SEC-1G 5μm(4 mm×50 mm);体积排阻色谱柱:两根M AbPac SEC-1 300(7.8 mm×300 mm);流动相:6 mol/L盐酸胍;流速:0.5 m L/min;检测波长:280 nm;柱温:25℃;进样量:50μL。
(2)试样溶液的测定。取50μL样品溶液注入高效液相色谱仪,在色谱条件下测定试样的响应值(峰面积)。由校准工曲线线性回归方程计算样品溶液中α-乳白蛋白的含量。
2 结果与分析
2.1 液相色谱条件的确定
2.1.1 检测波长的确定
由于β-乳球蛋白的分子量与α-乳白蛋白较为接近,为了确认α-乳白蛋白以及β-乳球蛋白的分离情况,用本方法测定α-乳白蛋白时,需要将α-乳白蛋白以及β-乳球蛋白的标准溶液同时进样。在200 nm~400 nm的范围内进行二极管阵列扫描,β-乳球蛋白的得到其特征吸收光谱图。两个蛋白在280 nm左右吸收峰都较强,因此,确定280 nm为α-乳白蛋白检测波长。
2.1.2 流动相的确定
乳粉、牛奶、乳清粉的加工过程中不可避免的会使用到热处理工艺,乳清蛋白对热较为敏感,不可避免的会发生一点的空间结构变化以及聚合。6 mol/L盐酸胍是常用的蛋白变性剂,可以很好的溶解蛋白质并使蛋白结构变得一致,因此本研究采用6 mol/L盐酸胍作为流动相对α-乳白蛋白和β-乳球蛋白进行分离。研究发现流动相pH在6.5~7.5范围内对于两种蛋白的分离没有太大区别,如图1,并且避开了α-乳白蛋白4.2左右、β-乳球蛋白5.2左右以及酪蛋白4.8左右的等电点,不会造成样品中蛋白质的沉淀。因此,本标准对于流动相的p H值范围设定为6.5~7.5。

图1流动相pH值对于α-乳白蛋白和β-乳球蛋白分离的影响
2.1.3 液相色谱色谱柱的确定
乳清蛋白家族中,对α-乳白蛋白检测的主要干扰来自于β-乳球蛋白,α-乳白蛋白的相对分子质量约为14 000 u,β-乳球蛋白的分子量为18 000 u,两者的分子量较为接近,需要选取有效的体积排阻色谱柱(SEC柱)对两者进行分离。本研究尝试使用一根耐高压的内经为1.9μm或者2.7μm,长度为30 cm的体积排阻色谱柱对α-乳白蛋白和β-乳球蛋白进行分离,结果单根色谱柱均无法对两种蛋白进行很好的分离,如图2。由于分子量太接近,一根体积排阻色谱柱无法将这两种蛋白完全分离,考虑串联两根提价排阻色谱柱来进行分离,由于耐高压的体积排阻色谱柱成本较高,本研究选取了串联两根内径为5μm,长度为30 cm的体积排阻色谱柱来进行测试。共购买了3个品牌的2根体积排阻色谱柱进行串联,分别为TSK-GEL G3000 SWXL(5μm,7.8 mm×300 mm)、Dikma SEC 1000(5μm,7.8×300 mm)以及Thermo的MAbPac SEC-1(5μm,7.8×300 mm)。相对而言,两根Thermo的MAbPac SEC-1连用对于α-乳白蛋白和β-乳球蛋白的分离情况较好,见图3。

图2 一根2.7μm以及一根1.9μm体积排阻色谱柱对于α-乳白蛋白和β-乳球蛋白的分离情况
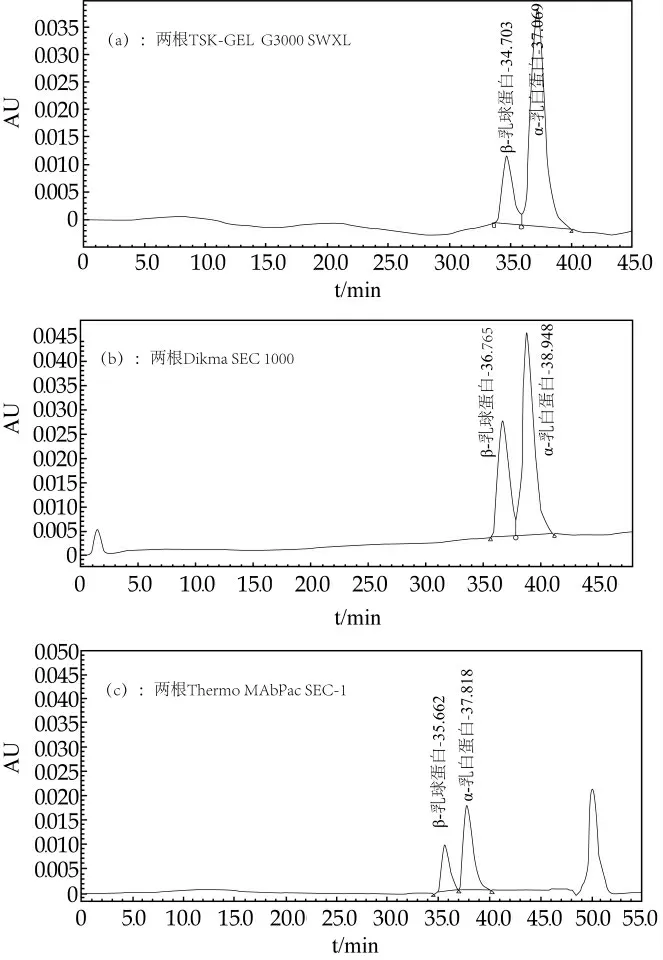
图3不同品牌的两根凝胶色谱柱串联对于α-乳白蛋白和β-乳球蛋白的分离情况
2.2 方法的线性范围及检出限
2.2.1 线性范围
线性范围是指试样量与响应讯号之间保持线性关系的范围。各取50μL浓度为0、25、50、125、250、500 mg/L的标准曲线溶液,分别按上述色谱条件进行分析。以相应的色谱峰面积y为纵坐标、待测组分的质量浓度x(mg/L)为横坐标,绘制标准工作曲线,经线性回归后求得相关系数。所得结果见表1和图4。说明待测组分在该浓度范围内均具有良好的线性关系。

表1线性方程

图5α-乳白蛋白的标准工作曲线
2.2.2 方法的检出限和定量限
标准曲线最低点为10 mg/L,取50μL标准工作溶液最低点注入超高效液相色谱仪,溶液在相同条件下进样6次,记录色谱峰面积,以最低浓度峰与基线噪音峰比值的3倍测得目标物的检出限(limit of detection,LOD),以最低浓度峰与基线噪音峰比值的10倍测得目标物的定量限(limit of quantitation,LOQ),计算出方法的检出浓度和定量浓度,测定结果见表2。

表2α-乳白蛋白的检出浓度和定量浓度
α-乳白蛋白的检出浓度为3.00μg/mL,定量浓度为10.0μg/mL。当牛奶的取样量为0.5 g,定容体积为10 m L的时候,检出限为0.006 g/100 g,定量限为0.02 g/100 g;当乳粉的取样量为1.0 g,稀释倍数为10时,检出限为0.03 g/100 g,定量限为0.1 g/100 g;当乳清粉的取样量为1.0 g,稀释倍数为20时,检出限为0.6 g/100 g,定量限为2.0 g/100 g。
2.3 回收率及精密度实验
选取婴幼儿配方乳粉、乳清粉、牛乳样品基质,由于样品本底就会含有α-乳白蛋白,因此乳粉和牛乳的实际加标量,会根据样品中本底含量来添加,添加量为本底的一半、本底值以及本底的2倍作为低、中、高3个加标浓度进行回收率实验,每一个添加水平重复6次。乳清粉通常作为原料添加到配方乳粉中,因此乳清粉中α-乳白蛋白的含量范围跨度可能较大,根据实际检测经验,加标量为(10%、20%、40%),每一个添加水平重复测定6次。按照相同的分析方法进行测定,比较加入标准样品后实际测得的含量扣除本底值后和理论添加的含量的比值,来计算加标回收率,并计算测定结果的相对标准偏差(relative standard deviation,RSD),牛奶、乳粉和乳清粉中α-乳白蛋白低中高3种浓度的加标平均回收率分别为90.9%~98.2%、100.0%~101.4%和95.1%~100.4%,相对标准偏差范围分别为1.03%~2.34%、1.84%~5.26%和3.94%~6.06%,详见表3。

表3不同样品基质中平均回收率及精密度
2.4 实际样品测定结果
使用本研究建立的方法,对市场上及企业提供的40批次乳粉,企业提供的10批次α-乳清粉以及10批次灭菌牛乳进行了α-乳白蛋白的含量的测定,可以看到牛奶中α-乳白蛋白的本底值大概在0.1%左右,乳清粉中α-乳白蛋白的含量大概在30%~40%左右,婴配粉中可能额外添加α-乳白蛋白,因此含量跨度比较大,有标签表示值的和检出值比较接近,具体检测结果见表4。

表4实际样品测试结果

(续表4)
3 结论
本研究建立牛奶、牛乳粉和牛乳清粉中的α-乳白蛋白含量测定的体积排阻色谱法,该方法具有前处理简单、准确度高等特点。经实际样品检测证明,该方法适合牛奶、牛乳粉和牛乳清粉中α-乳白蛋白的含量检测,为企业保健品注册以及政府对于乳制品市场的监管提供了强有力的技术保障。
