富含半胱氨酸蛋白61对慢性肾脏病小鼠骨骼肌萎缩的影响
2022-05-16古亮左一丹林幼幼王小妹苏震
古亮 左一丹 林幼幼 王小妹 苏震
慢性肾脏病(chronic kidney disease,CKD)是一个全球公共卫生问题,其发病率占全球成年人口的10%~15%[1]。CKD除了可致肾脏功能异常外,还可致多种并发症,肌肉萎缩就是其中之一[2-3]。CKD患者发生肌肉萎缩会使生活质量下降,死亡率上升[4]。已有研究表明,CKD引起肌肉萎缩的原因包括炎症、氧化应激、蛋白合成与分解异常等,这些原因可引起肌肉质量和力量的快速下降,导致肌肉功能丧失[5-6]。富含半胱氨酸蛋白61(cysteine-rich protein 61,CCN1)是一种多功能的细胞外基质蛋白,参与细胞黏附、迁移、趋化、分化、凋亡、衰老及伤口愈合、纤维化等过程[7-9]。研究发现,在皮肤伤口愈合过程中,CCN1通过整合素α6β1和硫酸乙酰肝素蛋白聚糖(heparan sulfate proteoglycan,HSPG)途径诱导DNA损伤反应激活p53蛋白触发细胞衰老;在成纤维细胞衰老的研究中发现,CCN1可通过RAC1-NOX1复合物诱导活性氧(reactive oxygen species,ROS)的产生,激活ERK和p38MAPK,导致p16/Rb上调[10]。肌肉祖细胞(muscle progenitor cells,MPCs)加入重组CCN1蛋白后,p53、p16和 Rb蛋白表达升高,MPCs衰老表型增强。在老年小鼠血清中CCN1表达明显升高,进一步说明骨骼肌年龄相关性衰老可能与CCN1表达上调有关[11]。基于此,本研究以骨骼肌条件性敲除CCN1小鼠,即条件性基因敲除(conditional knockout,CKO)小鼠为实验动物,构建CKD小鼠模型,探讨CCN1对CKD小鼠骨骼肌萎缩的影响,现报道如下。
1 材料和方法
1.1 材料
1.1.1 骨骼肌条件性敲除CCN1的小鼠制备 委托江苏南京集萃药康生物科技有限公司通过CRISPR-Cas 9技术在C57BL/6小鼠(购自江苏南京集萃药康生物科技有限公司)CCN1基因上下游各插入一段LoxP序列,得到杂合CCN1flox/+小鼠,将其与CCN1+/+小鼠进行杂交纯化遗传背景。然后本研究团队把纯化后的CCN1flox/+小鼠交配繁殖得到CCN1flox/flox小鼠。CCN1flox/flox小鼠与CKmm-Cre+/-小鼠(购自美国Jackson实验室)杂交,繁殖生育得到CKmm-Cre+/-CCN1flox/+小鼠。随后将异性CKmm-Cre+/-CCN1flox/+与CCN1flox/flox小鼠杂交得到 CKmm-Cre+/-CCN1flox/flox、CKmm-Cre+/-CCN1flox/+、CK-mm-Cre-/-CCN1flox/flox、CKmm-Cre-/-CCN1flox/+4 种基因型小鼠。其中CKmm-Cre+/-CCN1flox/flox为骨骼肌条件性敲除CCN1的小鼠,即CKO小鼠,其中雄性有14只;CKmm-Cre-/-CCN1flox/flox为野生型(wild type,WT)小鼠,其中雄性有15只。将WT小鼠和CKO小鼠按随机数字表法分为野生型假手术组(wild type sham,WOS组)6只、野生型造模组(wild type operation,WOC组)9只、敲除型假手术组(conditional knockout sham,COS组)8只、敲除型造模组(conditional knockout operation,COC组)6只。小鼠置于自然光、安静环境、室温(22±2)℃、相对湿度(50±2)%环境下饲养。本研究经温州医科大学动物伦理委员会批准[批件号:wydw2018-0007;动物许可证号:SYXK(浙)2015-0009]。
1.1.2 主要试剂和仪器 Mouse Tail SuperDirectTMPCR Kit购自成都福际生物技术有限公司;SAKURA Tissue-TekRO.C.T购自美国樱花公司;抗层粘连蛋白抗体购自美国Abcam公司;荧光山羊抗兔IgG购自中国biosharp公司;DAPI购自北京索莱宝公司;逆转录试剂盒购自中国南京诺唯赞公司;BCA购自中国碧云天公司;肌酐、尿素氮、CCN1、尿蛋白检测试剂盒均购自南京建成生物研究所;HE染色试剂盒购自北京索莱宝公司;GAPDH购自中国Affinity公司;CCN1购自美国Novus Biologicals公司;p53购自美国 Cell Signaling Technology公司;山羊抗兔 IgG(H+L)购自中国biosharp公司。SpectraMax iD3全波长酶标仪购自美国Molecular Devices公司;Mini-Proten Tetra System电泳系统购自美国 BIO-RAD公司;RM2235轮转式石蜡切片机购自德国Leica公司;LV-150N光学显微镜购自日本尼康公司。
1.2 方法
1.2.1 构建5/6肾切除小鼠模型 各组小鼠均根据小鼠体重腹腔注射2%戊巴比妥钠溶液(40 mg/kg)进行麻醉。WOC组和COC组小鼠在距左肋脊部约0.5 cm处纵行切开约1.5 cm,暴露左侧肾脏,分离肾脏周围组织及包膜,切除左肾上极、下极2/3肾组织,并用明胶海绵迅速覆盖到创面压迫止血,观察肾脏切口直至凝血,复位剩余肾脏,逐层缝合组织;1周后再次用上述方法暴露小鼠右侧肾脏,用手术缝线结扎右肾动脉,切除整个右肾,并逐层缝合。WOS组和COS组小鼠假手术,仅逐层切开暴露肾脏,随后逐层缝合组织。
1.2.2 肌肉取样 将造模21个月后的各组小鼠称重后麻醉、眼球取血并用颈椎脱臼法处死,立即收集胫骨前肌、腓肠肌组织样本并称重。将各组每只小鼠腓肠肌保存于-80℃冰箱,用于real-time PCR和Western blot。将各组每只小鼠胫骨前肌都包埋于OCT中,并浸入液氮预冷的异戊烷中速冻,保存于-80℃冰箱,用于laminin免疫荧光检测。
1.2.3 血清CCN1、肌酐、尿素氮及尿白蛋白肌酐比值测定 收集各组小鼠的血液,4℃静置24 h分层,随后以3 000 r/min离心得到小鼠血清。小鼠处死前7天内,通过动物代谢笼收集尿液。血清及尿液标本根据试剂盒说明书中详细步骤检测得到血清CCN1、肌酐、尿素氮水平及尿白蛋白肌酐比值。
1.2.4 肾脏组织病理学观察 每只小鼠处死后立即取出肾脏并切取约2 mm厚肾组织,4%多聚甲醛固定48 h。常规石蜡包埋,切片。根据HE染色试剂盒说明书染色。每组随机选取3只小鼠各1张肾组织切片,每张切片随机选取3个视野观察小鼠肾脏的病理学改变。
1.2.5 胫骨前肌肌纤维横截面观察 各组小鼠胫骨前肌经冷冻切片机制作7 μm切片,在4%多聚甲醛中固定15 min、5%牛血清白蛋白封闭1 h。加入抗层粘连蛋白抗体(laminin,1∶250)4 ℃过夜。避光加入二抗,室温孵育1 h。滴加抗荧光衰减的DAPI染液20 μl,室温避光孵育10 min;封片。使用荧光显微镜在相同的曝光时间后捕获肌纤维横截面图像。使用 Image J软件在相同条件下处理测量图像中的肌纤维面积,获得各只小鼠胫骨前肌肌纤维横截面积(每只小鼠至少统计6张切片和至少300个肌纤维)。
1.2.6 腓肠肌组织CCN1、肌肉特异性环指蛋白1(muscle RING finger 1,MuRF-1)、肌肉萎缩盒F基因(muscle atrophy F-box,MAFbx)mRNA表达水平检测采用TRIzol法提取腓肠肌组织总RNA。使用逆转录试剂盒将RNA反转录为cDNA。用SYBRGeen PCR试剂进行real-time PCR。mRNA表达水平标准化为GAPDH表达。采用2-ΔΔCt法计算相对mRNA表达水平,引物序列见表1。
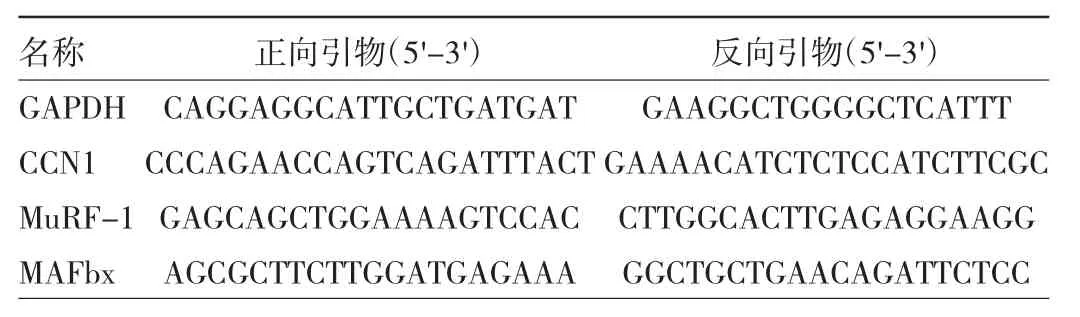
表1 引物序列
1.2.7 腓肠肌组织总蛋白提取 切取各组每只小鼠30 mg的腓肠肌,并向各个组织样本中加入300 μl RIPA。使用组织匀浆器匀浆提取小鼠腓肠肌中蛋白质。使用酶标仪测量蛋白在562 nm波长处的吸光度值。根据BCA法蛋白定量检测法测量匀浆的蛋白质样品浓度。
1.2.8 腓肠肌组织CCN1、p53蛋白表达水平检测 采用Western blot法。取各组每只小鼠20 μg的腓肠肌组织总蛋白上样到10%SDS-聚丙烯酰胺凝胶电泳。恒流将蛋白转移到PVDF膜,5%脱脂牛奶在室温下封闭 PVDF膜1 h。在GAPDH、CCN1、p53一抗中 4℃孵育过夜。洗膜后分别加入对应二抗,室温孵育PVDF膜1 h。洗膜后用ECL化学发光试剂检测。凝胶成像仪观察并拍照。Image J测定灰度值并分析。
1.3 统计学处理 采用GraphPad Prism 8统计软件。计量资料以表示,多组比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 4组小鼠肌酐、尿素氮、血清CCN1、尿白蛋白肌酐比值比较 WOC组小鼠肌酐、尿素氮、血清CCN1、尿白蛋白肌酐比值均高于WOS组小鼠(均P<0.05),COC组小鼠肌酐、尿素氮、血清CCN1、尿白蛋白肌酐比值均高于COS组小鼠(均P<0.05),而COC组小鼠较WOC组小鼠尿白蛋白肌酐比值下降(P<0.05),见图1。
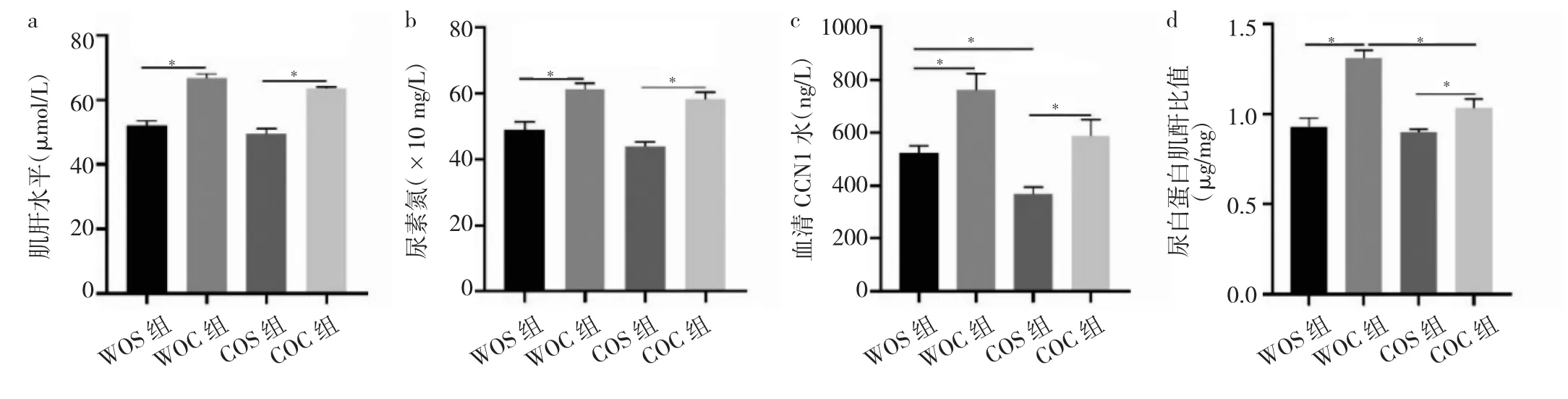
图1 4组小鼠肌酐、尿素氮、血清CCN1、尿白蛋白肌酐比值比较(a:肌酐水平比较;b:尿素氮水平比较;c:血清CCN1水平比较;d:尿白蛋白肌酐比值比较)
2.2 4组小鼠肾脏组织病理学观察所见 与WOS组、COS组相比,WOC组、COC组小鼠肾脏组织切片可见明显的肾间质纤维化改变;COC组较WOC组肾间质间质纤维化程度减轻,见图2(插页)。
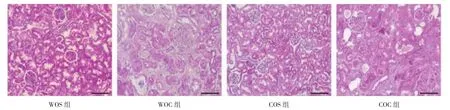
图2 4组小鼠肾脏组织病理学观察所见(HE染色,×200)
2.3 4组小鼠造模后21个月后体重、胫骨前肌、腓肠肌的重量及胫骨前肌体重比值、腓肠肌体重比值比较WOC组小鼠体重、胫骨前肌、腓肠肌的重量及胫骨前肌体重比值、腓肠肌体重比值均低于WOS组小鼠(均P<0.05),COC组小鼠体重、胫骨前肌、腓肠肌的重量及胫骨前肌体重比值、腓肠肌体重比值均低于COS组小鼠(均P<0.05),而COC组小鼠较WOC组小鼠腓肠肌、胫骨前肌的重量及腓肠肌体重比值、胫骨前肌体重比值均升高(均P<0.05),见表2、图3。
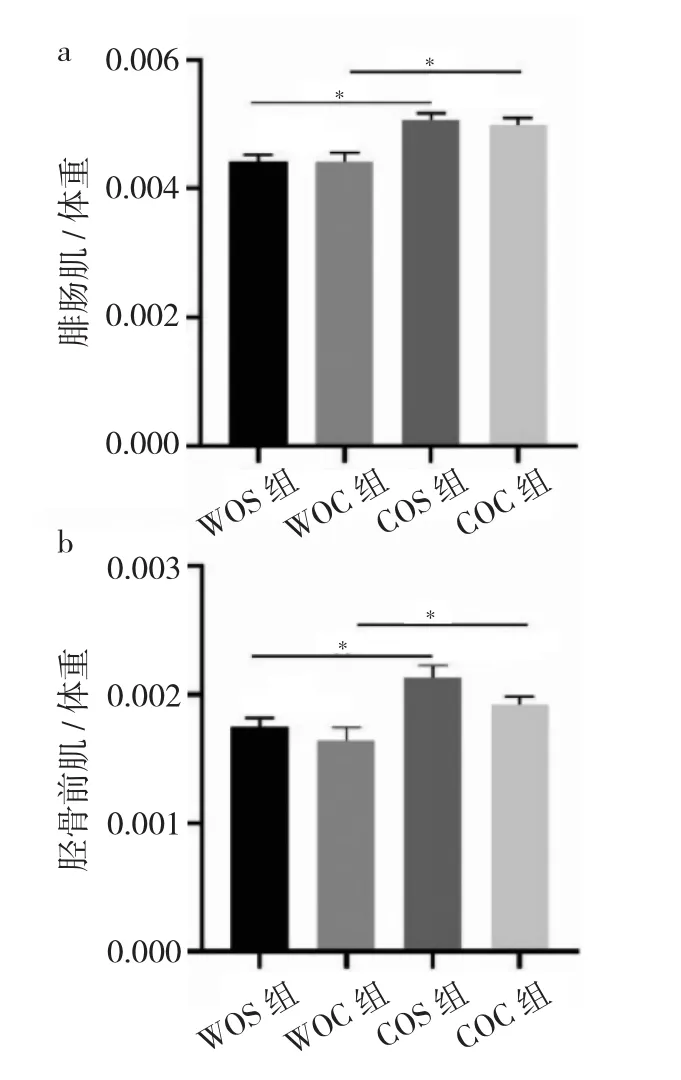
图3 4组小鼠胫骨前肌体重比值、腓肠肌体重比值比较(a:腓肠肌体重比值比较;b:胫骨前肌体重比值比较)
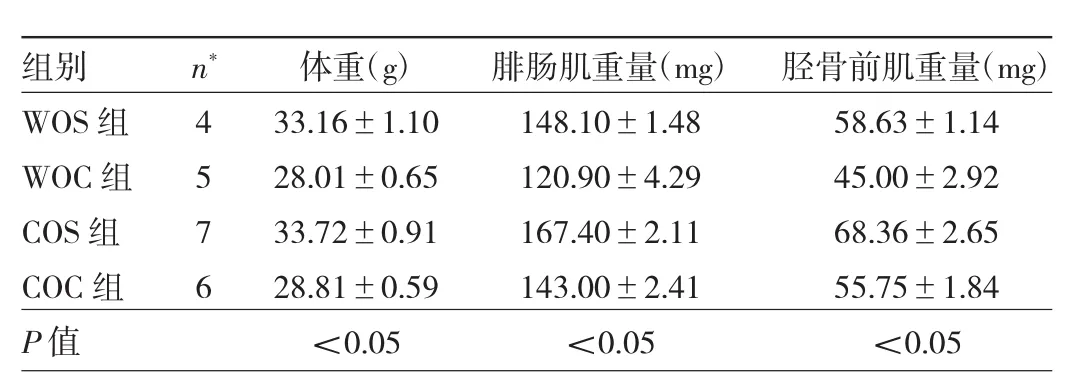
表2 4组小鼠造模后21个月后体重、胫骨前肌、腓肠肌的重量比较
2.4 4组小鼠胫骨前肌肌纤维横截面积比较 WOC组小鼠胫骨前肌肌纤维横截面积小于WOS组小鼠(P<0.05),COC组小鼠胫骨前肌肌纤维横截面积小于COS组小鼠(P<0.05),而COC组小鼠较WOC组小鼠胫骨前肌肌纤维横截面积大(均P<0.05),见图4。
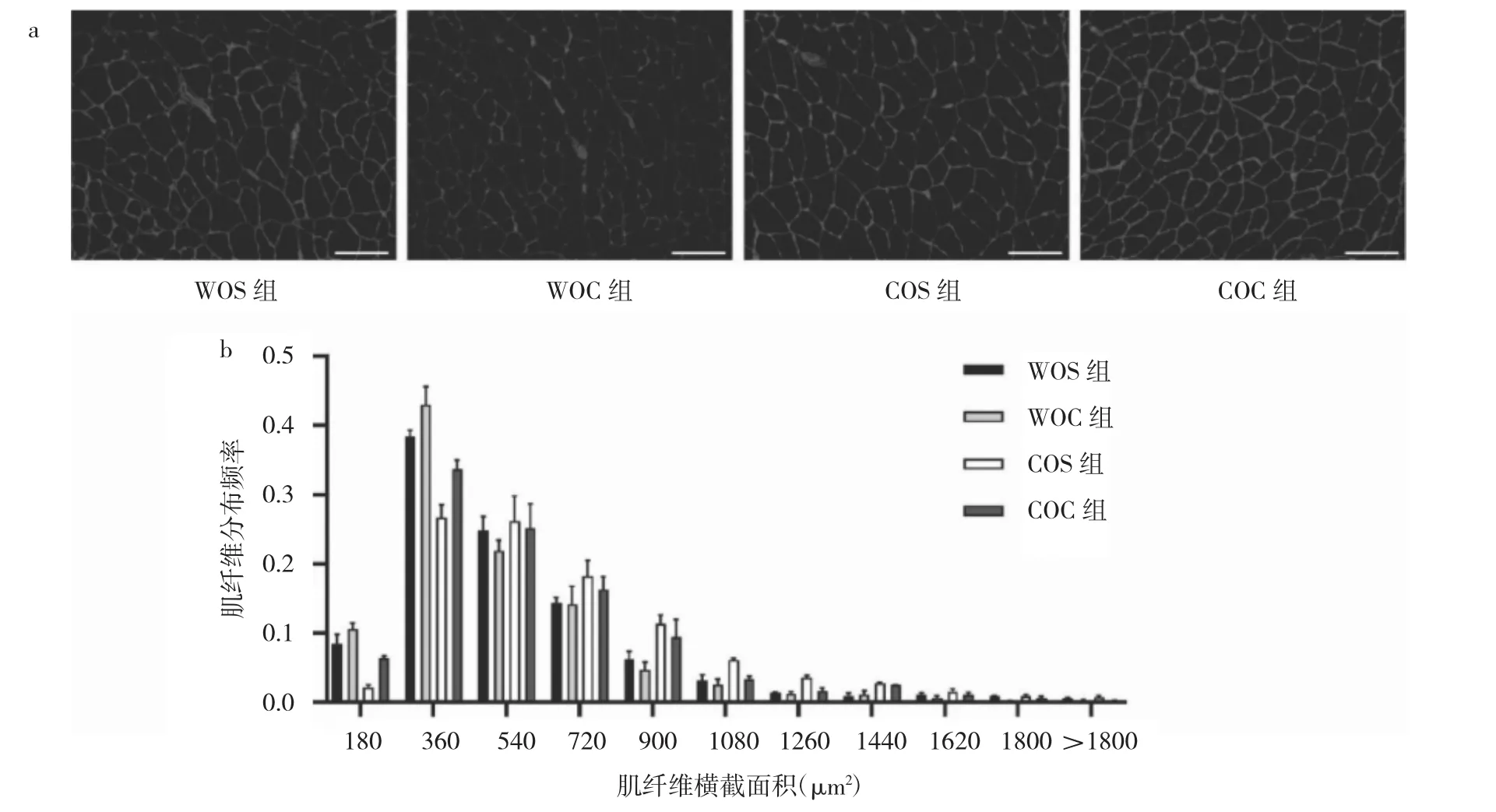
图4 4组小鼠胫骨前肌肌纤维横截面观察比较(a:肌纤维横截面镜下观察所见,laminin荧光染色,×200;b:肌纤维横截面积频率分布)
2.5 4组小鼠腓肠肌组织CCN1、MuRF-1、MAFbx mRNA表达水平比较 WOC组小鼠腓肠肌组织CCN1、MuRF-1、MAFbxmRNA表达水平均高于WOS组小鼠(均P<0.05),COC组小鼠腓肠肌组织CCN1、MuRF-1、MAFbx mRNA表达水平均高于COS组小鼠(均P<0.05),而COC组小鼠较WOC组小鼠CCN1、MuRF-1、MAFbx mRNA表达水平均降低(均P<0.05),见图5。
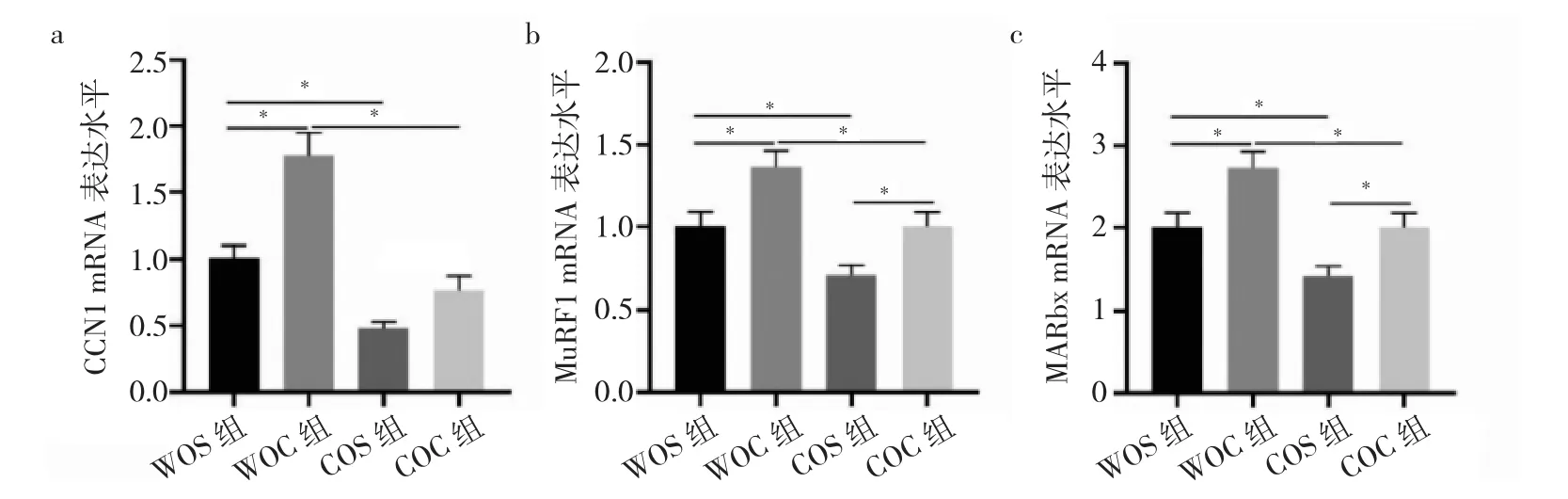
图5 4组小鼠腓肠肌组织CCN1、MuRF-1、MAFbx mRNA表达水平比较(a:CCN1 mRNA表达水平比较;b:MuRF1 mRNA表达水平比较;c:MARbx mRNA表达水平比较)
2.6 4组小鼠腓肠肌组织CCN1、p53蛋白表达水平比较 WOC组小鼠腓肠肌组织CCN1、p53蛋白表达水平均高于WOS组小鼠(均P<0.05),COC组小鼠腓肠肌组织CCN1蛋白表达水平高于COS组小鼠(P<0.05),而COC组小鼠较WOC组小鼠腓肠肌组织CCN1、p53蛋白表达水平下降(均P<0.05),见图6。
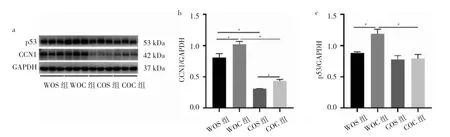
图6 4组小鼠腓肠肌组织CCN1、p53蛋白表达水平比较(a:蛋白表达电泳图;b:CCN1蛋白表达水平比较;c:p53蛋白表达水平比较)
3 讨论
CKD的分解代谢环境(包括炎症、激素、代谢性酸中毒和胰岛素抵抗等因素)可激活蛋白质降解,并抑制蛋白质合成,肌肉再生受损导致肌肉萎缩加速[12]。肌肉萎缩在CKD早期即可发生,导致患者生活质量下降和死亡风险增加。细胞外基质在肌肉生长、发育和再生过程中,促进骨骼肌对环境的适应[13]。CCN1由多种类型的细胞分泌至细胞外基质中,介导细胞间信号转导。CCN1参与老年小鼠骨骼肌纤维类型的转变[14]。本研究通过5/6肾切除手术建立CKD小鼠模型,研究CCN1对CKD小鼠骨骼肌萎缩的影响。本研究结果显示CKD造模21个月后的小鼠骨骼肌确实发生明显萎缩。COC组小鼠较WOC组血清CCN1和尿白蛋白肌酐比值均明显下降;肌纤维横截面积、胫骨前肌体重比值、腓肠肌体重比值升高;这些结果表明CKD造模后可导致CCN1升高,肌肉萎缩加剧,而敲除CCN1可以延缓骨骼肌的萎缩。然而,在CKD造模后COC组较WOC组尿白蛋白肌酐比值明显下降,肾间质纤维化程度减轻,提示肌肉敲除CCN1后对肾脏功能可能具有保护作用,具体机制还需进一步分析CKD小鼠肾脏予以验证。
肌肉蛋白的过度降解是肌肉萎缩的主要原因之一[12]。泛素蛋白酶体途径会在多种分解代谢情况下被激活,其中MuRF1和MAFbx是这一过程的经典标志物[15]。本研究结果显示CKD造模小鼠较假手术小鼠MuRF1和MAFbx明显升高,而COC组较WOC组明显下降。这表明骨骼肌敲除CCN1后可以改善CKD分解状态下的骨骼肌萎缩。CCN1可通过p53、p21、p16诱导成纤维细胞的衰老[10,16-17],参与调节年龄相关性肌萎缩[11]。Fox等[18]研究发现,固定肢体后抑制p53可部分抵抗肌肉萎缩。在恶性肿瘤导致的肌肉萎缩中,肌肉组织p53蛋白表达也明显升高[19]。本研究发现,在21个月CKD小鼠腓肠肌CCN1、p53蛋白表达水平较假手术小鼠升高,而COC组较WOC组明显下降。这表明CKD可以通过CCN1和p53的上调导致骨骼肌萎缩增强;骨骼肌敲除CCN1后可以部分延缓p53蛋白对肌肉的萎缩作用。
综上所述,本研究通过骨骼肌敲除CCN1的小鼠CKD模型,验证了CCN1对CKD骨骼肌萎缩中的影响。CCN1可能通过p53途径促进CKD小鼠骨骼肌衰老和蛋白降解途径加重骨骼肌萎缩。本研究或能为治疗CKD骨骼肌萎缩提供参考。
