circPVT1在食管鳞状细胞癌中的表达及对细胞增殖、凋亡的影响
2022-05-16齐海亮杨阳史雪娟李亚斋
齐海亮 杨阳 史雪娟 李亚斋
食管癌是世界范围内第九高发的恶性肿瘤,每年约有60万人被诊断为食管癌,发病率为5.9/10万,而且在中国的发病率更高,达12.6/10万[1]。其中,食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)是最常见的病理类型,占所有食管癌的90%以上[2]。近年来,随着对重点人群早期筛查的普及和治疗技术的提高,部分早期ESCC患者可以长期存活,但由于肿瘤复发、广泛浸润和转移等原因,ESCC的5年生存率仍低于13%[3]。尽管有大量研究报道了如抑癌基因肿瘤蛋白 p53(the tumor suppressor gene,the tumor protein p53,TP53)、磷脂酰肌醇激酶-3催化亚基α(phosphatidylinositol kinase-3 catalyzes the Subunit,PIK3CA)、表皮生长因子受体(epidermal growth factor receptor,EGFR)和鼠肉瘤病毒致癌基因(mouse sarcoma virus oncogene,KRAS)在内的多个基因突变在ESCC的发生、发展中起重要作用,但ESCC的驱动基因仍不明确。环状RNA(circular RNA,circRNA)是非编码RNA的新成员,由于circRNA的共价闭环结构使其可以免受RNA酶降解,因此具有高度稳定性。随着对circRNA功能的研究深入,人们发现异常表达的circRNA在许多恶性肿瘤的增殖、凋亡、侵袭、治疗抵抗等方面起重要作用[4]。研究发现,circRNA浆细胞瘤变体易位1(plasmacytoma variant translocation 1,circPVT1)表达增高参与喉癌、胃癌细胞的增殖、凋亡调控[5-6],但circPVT1在ESCC中的表达及作用尚不明确。基于此,本研究通过检测ESCC患者肿瘤组织与相应癌旁组织及购买的ESCC细胞中circPVT1的表达情况,分析circPVT1与患者临床病理特征的关系,并通过细胞转染短发夹RNA以敲低circPVT1的表达,探讨circPVT1对ESCC细胞增殖、凋亡的影响。
1 材料和方法
1.1 材料
1.1.1 临床组织标本 收集2017年9月至2019年12月在河北省胸科医院胸外科明确诊断,且行手术治疗的40例ESCC患者的肿瘤组织及相应癌旁组织。患者男22例,女18例;年龄42~78岁,中位年龄60岁。患者术前均未行放疗、化疗、生物治疗。依据患者年龄分为<60岁19例,≥60岁21例;依据WHO肿瘤病理学分级分为高中分化17例,低分化23例;依据淋巴结有无转移分为无淋巴结转移(N0)25例,淋巴结转移(N+)15例;依据国际抗癌联盟(Union for International Cancer Control,UICC)第8版食管癌TNM判定标准分为Ⅰ+Ⅱ期26例,Ⅲ+Ⅳ期14例。本研究经过医院医学伦理委员会审批,患者知情并同意。
1.1.2 细胞 正常食管上皮细胞HEEC及ESCC细胞ECA-109由河北医科大学第四医院中心实验馈赠;将细胞置于含有10%FBS及青霉素和链霉素双抗的DMEM培养基中,于37℃、5%CO2培养箱中培养,每1~2 d更换细胞培养液,待细胞达80%融合,用0.25%胰蛋白酶消化传代。根据细胞密度分装到新的细胞培养瓶中,放回培养箱继续培养。
1.1.3 主要试剂和仪器 DMEM培养基(美国Gibco公司);Lipofectamine 2000细胞转染试剂(美国Invitrogen公司);FBS(美国 Gibco公司);AnnexinV-FITC/PI凋亡检测试剂盒(美国BD公司);CCK-8细胞增殖/毒性检测试剂盒(上海贝博生物公司);RNA提取试剂盒(德国QIAGEN公司);反转录试剂盒(美国Thermo公司);荧光定量 PCR 试剂盒(Syber green mix)(美国 Invitrogen公司),增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)单克隆抗体(美国Proteintech公司),B 淋巴细胞瘤-2(B-cell lymphoma-2,BCL-2)单克隆抗体(美国Proteintech公司),β-actin单克隆抗体(美国Proteintech公司)。引物设计及短发夹环状RNA sh-circPVT1、sh-control(阴性对照)合成由上海吉玛公司完成。
1.2 方法
1.2.1 组织标本处理 将切下的病变食管组织标本在半小时内避开肿瘤坏死区取肿瘤组织及距离肿瘤组织边缘2 cm以选的正常组织,剪切至大小约1 cm3的组织块,放入液氮中速冻2~3 min,然后保存于-80℃液氮罐中。
1.2.2 ESCC组织与癌旁组织、ECA-109细胞与HEEC细胞circPVT1表达水平检测 参照RNA提取试剂盒说明书方法提取组织和细胞的总RNA。RNA纯度和浓度应用Nanodrop核酸定量仪进行检测,符合纯度和浓度要求的RNA进行反转录。取5 μg总RNA按反转录试剂盒说明书建立 20 μl反转录体系合成 cDNA。qRT-PCR在美国Applied Biosystems公司PCR仪上进行。cDNA按照1∶10稀释,反应体系如下:SYBRRGreen qPCR 预混液 10 μl,cDNA 2 μl,上游引物 0.5 μl,下游引物0.5 μl,去离子水7 μl,离心混匀后,进行PCR反应。相对定量法采用比较Ct法,以线性GAPDH作为内参,采用ΔCt(Ct目的-Ct内参)法进行相对定量分析,采用2-ΔCt计算所得值作为目的RNA的相对表达水平。
1.2.3 细胞转染 质粒转染按照Lipofectamine 2000说明书进行,具体如下:ECA-109细胞接种到细胞培养瓶或96孔板中培养24 h,当细胞密度为60%~70%时进行转染。转染时,首先将无血清DMEM分别与sh-circPVT1、sh-control混合,同时将DMEM与Lipofectamine 2000转染试剂混合,常温放置5 min,随后将DMEM/sh-circPVT1混合液及DMEM/sh-control混合液分别与DMEM/Lipofectamine 2000混合液相混合,短暂震荡混匀后于室温静置15 min。同时ECA-109细胞无血清DMEM培养基进行换液,后将上述两种混合液分别加入细胞中,放入培养箱中转染6 h,弃去细胞中的培养基,更换为新的无血清DMEM培养基,继续放入37℃、5%CO2培养箱中培养12~72 h,收集转染后的两种细胞进行下一步实验。
1.2.4 转染sh-circPVT1与转染阴性对照的ECA-109细胞circPVT1表达水平检测 方法同1.2.2。
1.2.5 转染sh-circPVT1与转染阴性对照的ECA-109细胞增殖情况检测 采用CCK-8法。将ECA-109细胞接种于96孔板,调整细胞浓度为5×104/100 μl,按1.2.3的方法进行转染,并在转染后 0、12、24、48、72 h进行细胞增殖检测。转染成功后,在细胞培养基中加入CCK-8试剂10 μl,37℃培养箱中继续放置2 h。取出96孔板,酶标仪检测每孔在450 nm处的吸光度(optical density,OD)值,并通过下列公式计算细胞的增殖率。细胞增殖率(%)=(实验组OD450-空白组OD450)/(对照组OD450-空白组OD450)。
1.2.6 转染sh-circPVT1与转染阴性对照的ECA-109细胞凋亡情况检测 采用流式细胞术。将ECA-109细胞接种于培养瓶中,按1.2.3的方法进行转染,转染48 h后收集细胞;冰PBS洗涤细胞2次后加入100 μl 1×Binding Buffer将细胞悬浮于EP管中,后每个EP管中快速加入5 μl异硫氰酸荧光素标记的磷脂蛋白V(Annexin V-fluorescein isothiocyanate,Annexin V-FITC)染液及 5 μl碘化丙啶(propidium iodide,PI)染液,混合均匀室温避光孵育15 min,转移到专用试管中,加入 3 200 μl 1×Binding Buffer,应用流式细胞仪检测细胞凋亡情况。细胞凋亡率(%)=(Q2象限细胞总数+Q4象限细胞总数)/总细胞数。
1.2.7 转染sh-circPVT1与转染阴性对照的ECA-109细胞PCNA、BCL-2蛋白表达水平检测 采用Western blot法。收集细胞,提取总蛋白。取等量蛋白进行SDS-聚丙烯酰胺凝胶电泳,电泳完毕,取出凝胶进行半干转膜。转膜完毕,取出PVDF膜,放置在含5%脱脂奶粉的TTBS封闭液中,于室温封闭2 h,将封闭后的PVDF膜用TTBS适当洗脱,然后放入用一抗稀释液稀释的一抗中,4℃放置过夜。次日,取出PVDF膜用TTBS洗膜5~6次,将PVDF膜置入用适当TTBS稀释的化学发光二抗中,室温反应2 h,取出PVDF膜用TTBS适当洗脱。最后用化学发光仪检测抗体特异结合条带。
1.3 统计学处理 采用SPSS 13.0统计软件。计量资料以表示,组间比较采用两独立样本t检验。计数资料以频数和构成比表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 ESCC组织与癌旁组织、ECA-109细胞与HEEC细胞circPVT1表达水平比较 ESCC组织与癌旁组织circPVT1 表达水平分别为 1.42±0.84、0.94±0.51,ESCC组织circPVT1表达水平高于癌旁组织(P<0.05)。ECA-109细胞与HEEC细胞circPVT1表达水平分别为 0.73±0.36、0.44±0.21,ECA-109 细胞 circPVT1 表达水平高于HEEC细胞(P<0.05)。即circPVT1在ESCC组织及细胞株中的表达均上调。
2.2 不同临床病理特征的ESCC患者circPVT1表达情况比较 以circPVT1表达水平中位数1.40为界,ESCC患者分为circPVT1高表达(≥1.40)18例和低表达(<1.40)22例。统计分析显示,circPVT1的表达与患者肿瘤TNM分期、淋巴结转移有关(P<0.05),但与患者年龄、性别、肿瘤分化程度无关(P>0.05)。即TNM分期晚、淋巴结转移的ESCC患者circPVT1表达上调,见表1。
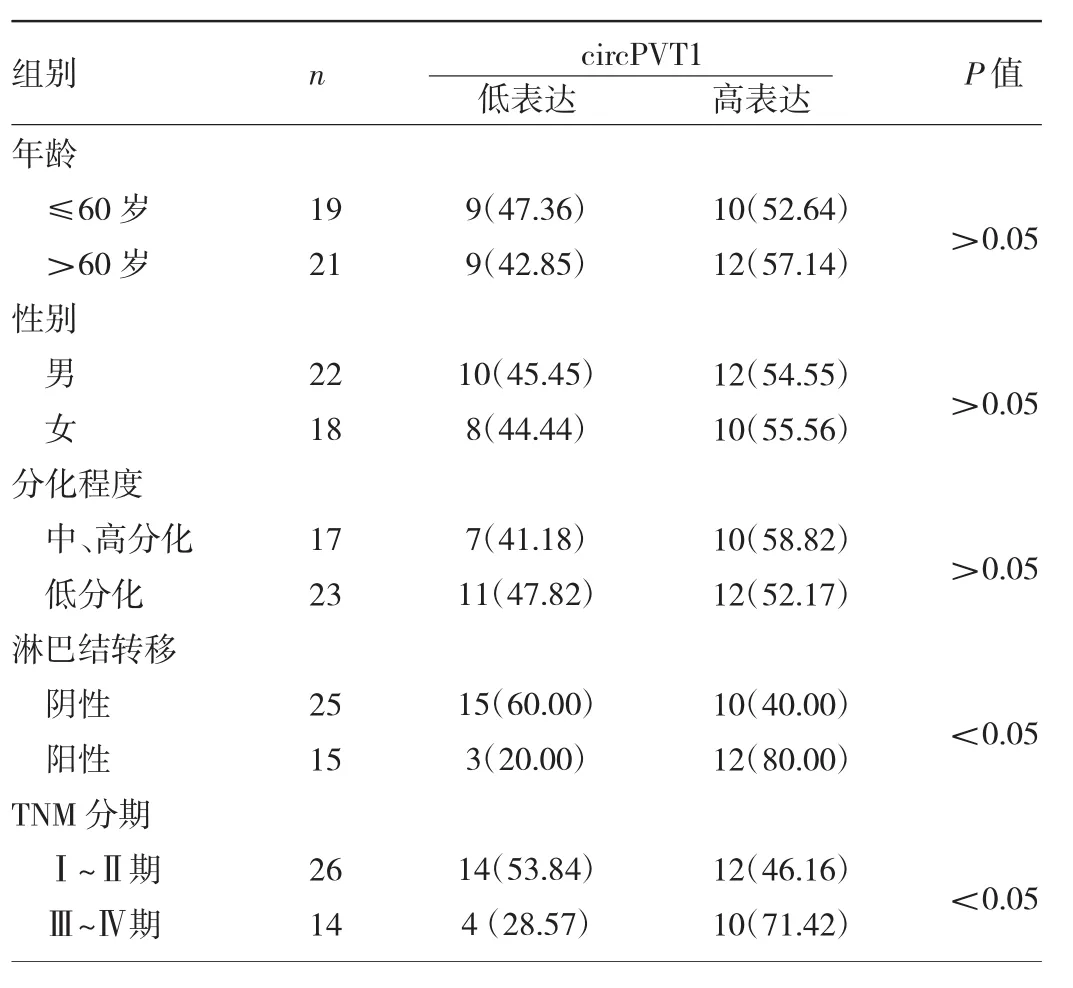
表1 不同临床病理特征的ESCC患者circPVT1表达情况比较[例(%)]
2.3 转染sh-circPVT1与转染阴性对照的ECA-109细胞circPVT1表达水平比较 转染sh-circPVT1与转染阴性对照的ECA-109细胞circPVT1表达水平分别为 0.43±0.22、0.99±0.64,转染 sh-circPVT1 的 ECA-109细胞circPVT1表达水平较转染阴性对照的ECA-109细胞降低(P<0.05)。
2.4 转染sh-circPVT1 与转染阴性对照的ECA-109细胞增殖率比较 转染 12、24、36、48、72 h后,转染sh-circPVT1的ECA-109细胞增殖率均低于转染阴性对照的ECA-109细胞(P<0.05),见表2。
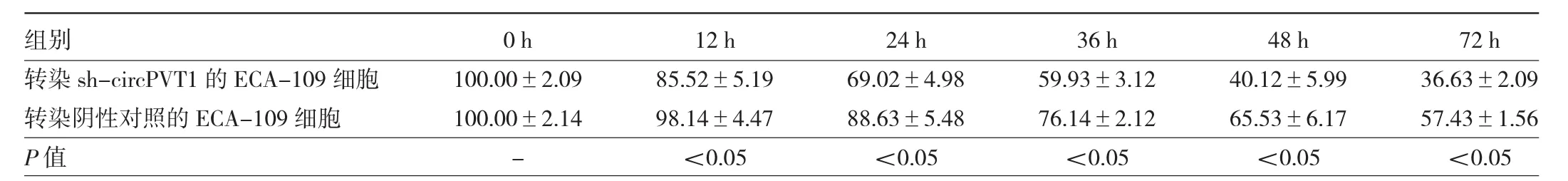
表2 转染sh-circPVT1与转染阴性对照的ECA-109细胞增殖率比较(%)
2.5 转染sh-circPVT1与转染阴性对照的ECA-109细胞凋亡率比较 转染sh-circPVT1与转染阴性对照的 ECA-109细胞凋亡率分别为(17.49±4.14)%、(5.49±0.95)%,转染sh-circPVT1的ECA-109细胞凋亡率高于转染阴性对照的ECA-109细胞(P<0.05)。即在ECA-109细胞中敲低circPVT1能够促进细胞凋亡。
2.6 转染sh-circPVT1与转染阴性对照的ECA-109细胞PCNA、BCL-2蛋白表达水平比较 转染sh-circPVT1与转染阴性对照的ECA-109细胞PCNA蛋白表达水平分别为 1.14±0.75、1.72±0.94,BCL-2 蛋白表达水平分别为 1.51±0.67、0.82±0.52,蛋白表达电泳图见图1。与转染阴性对照相比,转染sh-circPVT1的ECA-109细胞PCNA蛋白表达下调(P<0.05),BCL-2蛋白表达上调(P<0.05)。
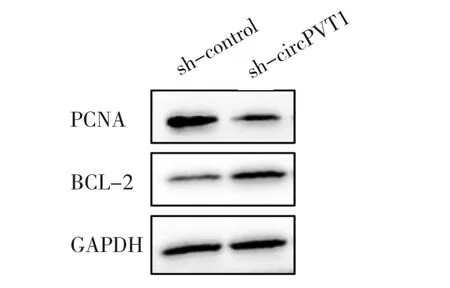
图1 转染sh-circPVT1与转染阴性对照的ECA-109细胞PCNA、BCL-2蛋白表达电泳图
3 讨论
circRNA作为非编码RNA家族中的重要成员,广泛存在于真核生物中。上世纪70年代circRNA被首次被报道,但当时被认为是RNA剪切错误所形成的错误产物而未得到重视。近年来,随着高通量测序技术的发展及对circRNA的研究深入,越来越多的circRNA被鉴定出来,同时其在基因表达调控中的重要作用也被重新发现和重新评价,重要的是研究也证实circRNA在多种疾病的病理生理过程中发挥了不可或缺作用[7-8]。从生成上说,circRNA由其母体基因mRNA加工过程中通过反向剪切而成,根据其来源不同circRNA可分为3类,包括外显子circRNA、内含子circRNA和外显子内含子circRNA;从结构上说,circRNA为闭合环状结构,缺乏3'polyA尾巴和5'端帽子结构,可以免受核酸外切酶RNase R的降解,因此比相应的线性RNA更稳定,同时circRNA具有组织特异性,能够在体液及胞外囊泡中检测到,这些特性使得circRNA有了作为新的生物标志物的可能;从功能上说,circRNA最重要的功能是作为内源性竞争RNA,吸附微小RNA进而影响微小RNA对下游靶基因的调控,间接调节基因表达;另外circRNA更多的功能也在逐渐被发现,例如可以和RNA结合蛋白相互作用,转录调控甚至编码小肽[9-12]。
随着对 circRNA功能研究深入,越来越多的证据证实表达异常的circRNA参与恶性肿瘤的发生、发展、侵袭、代谢等过程,并在预后评价及治疗效果预测中发挥不可或缺的作用,其中包括ESCC。例如,在ESCC组织和细胞中circNTRK2表达明显升高,高表达的circNTRK2与TNM分期、淋巴结转移和不良预后有关。敲低circNTRK2可抑制ESCC细胞增殖、侵袭和上皮间质转化,并增强细胞凋亡,而circNTRK2的过表达则显示相反的作用[13]。另外,Wang 等[14]也证实,circGSK3β在ESCC中高表达,其表达上调与ESCC患者所处的临床阶段和不良预后呈正相关。有研究也发现,circGSK3β通过与其母基因GSK3β直接相互作用,并通过抑制GSK3β活性促进ESCC细胞迁移和侵袭[15];此外,Pan等[16]通过测序发现有153 circRNA在ESCC组织和细胞株中表达上调,并证实 hsa_circ_0006948的高表达与淋巴转移和预后不良呈正相关。从功能上讲,hsa_circ_0006948在体外和体内均促进了细胞增殖、迁移和侵袭,为治疗ESCC提供了新的靶向治疗位点。本研究结果显示,ESCC组织和细胞中circPVT1的表达较正常组织及细胞明显上调,并且通过与患者临床病理特进行分析,发现TNM分期晚期及淋巴结转移的ESCC患者中circPVT1的表达明显上调,提示circPVT1的高表达可能与患者的临床分期有关。
circPVT1位于染色体8q24.19上,由癌基因PVT1基因的外显子环化而成,首先在胃癌中发现及报道,通过高通量测序检测了胃癌组织及癌旁组织中的circRNA的表达差异,发现circPVT1在胃癌组织中明显升高,高表达circPVT1的患者总生存率及5年无病生存率明显减低;进一步功能学实验证实,过表达circPVT1促进胃癌细胞增殖,其机制为circPVT1通过吸附miR-125而实现[5]。circPVT1通过充当miR-205-5p的海绵,进而调控了miR-205-5p的靶基因c-FLIP的表达参与了骨肉瘤细胞的侵袭和迁移[17]。有研究显示,mut-p53/YAP/TEAD复合体可增强circPVT1的表达,而circPVT1在头颈部鳞状细胞癌中也充当致癌基因,由于TP53是人类癌症中最常见的突变基因,因此有理由推测circPVT1在其他类型的癌症中也可能起重要作用[18]。本研究结果显示,在ESCC细胞中敲低circPVT1能够促进细胞凋亡,抑制其增殖,证实circPVT1在ESCC中也发挥了癌基因的作用,为靶向治疗ESCC提供了新的生物学标记。
综上所述,ESCC组织中circPVT1表达上调,高表达circPVT1和肿瘤临床分期及淋巴结转移相关。在ESCC细胞中敲低circPVT1能够抑制细胞增殖,促进细胞凋亡,circPVT1在ESCC中发挥癌基因的作用。这或为治疗ESCC提供了新的分子生物学靶标。
