中国林蛙不同生长阶段哈蟆油中PUFAs与FAD关联性
2022-05-16孙敬蒙汪卓明宋燕青张炜煜
孙敬蒙 汪卓明 郭 毅 宋燕青* 张炜煜
(1.吉林大学第一医院临床药学部,长春,130021;2.博纳西亚(合肥)医药科技有限公司,合肥,230000;3.吉林省药品审核查验中心,长春,130062;4.长春中医药大学药学院,长春,130117)
中国林蛙(Ranachensinensis)属两栖纲(Amphibia),无尾目(Anura),蛙科(Ranidae),蛙属[1],是我国著名的集食补、保健和美容于一体的经济价值较高的两栖类药用动物[2],蝌蚪期和冬眠期均存活于水中,变态后幼、成蛙在每年的春天结束前完成冬眠,随后开始地面生活。吉林省长白山山脉区域是中国林蛙最佳产地。哈蟆油(oviductus ranae)为中国林蛙雌蛙输卵管的干制品[3],是中国林蛙主要的生理药效作用部位,且富含多种对人体有益的多不饱和脂肪酸(polyunsaturated fatty acids,PUFAs)。PUFAs对于两栖冬眠动物生长发育有重要意义,是构成生物机体内部脂肪的一种重要营养物质。PUFAs的合成是一个较为复杂的过程,它是以饱和脂肪酸硬脂酸(stearic acid,SA)为底物,通过脂肪酸伸长酶和脱氢酶的一系列作用完成的,其中碳链的延长与脱氢过程是相互交替进行的。在合成途径中[4],脂肪酸脱氢酶(fatty acid dehydrogenase,FAD)是关键酶[5],它控制着目标PUFAs的不饱和程度[6],Δ6-FAD是动物脂肪酸生物合成的第一限速酶,是PUFAs合成途径中的关键酶;Δ5-FAD是合成PUFAs途径中的第二个限速酶;Δ9-FAD是一种可溶性FAD[7]。
PUFAs和FAD在中国林蛙的其他组织部位中表达量的情况目前没有文献报道。本研究以吉林省靖宇县中国林蛙全年6个生长阶段采集的3龄雌蛙样本为研究对象,以输卵管组织为研究部位,探讨FAD基因表达量和PUFAs含量的相关性,以期确定中国林蛙哈蟆油最佳采收期,为其养殖和采收提供依据。
1 试验动物
依据中国林蛙生活习性及繁殖方式,将生长期划分为6个阶段:出蛰期(2—3月)、产卵期(3—5月)、捕食期(5—9月)、入蛰期(9—11月)、散居冬眠期(11—12月)和群居冬眠期(12—2月)。在吉林省靖宇县按中国林蛙生长阶段采集3龄雌蛙,每个不同生长阶段的样本量最少为6只。解剖取得中国林蛙的输卵管部位,冰箱-80 ℃冻存。
2 研究方法
2.1 中国林蛙哈蟆油PUFAs含量测定
采用StatView分析脂肪酸的组成及相对含量。
2.1.1 气相色谱条件
Agilent 7890B色谱仪,SPTM-2560毛细管色谱柱(100 m×0.25 mm×0.20 μm),载气为高纯氮气(99.999%),气化室温度250 ℃,检测器温度260 ℃;程序升温:初始温度100 ℃,保持5 min,以4 ℃/min升至240 ℃,保持30 min;总运行时间70 min。分流进样(分流比为50∶1),进样量为1 μL;色谱柱流速为0.507 7 mL/min,H2流速为40 mL/min,空气流速为400 mL/min,尾吹流速为30 mL/min。
2.1.2 溶液的配制
内标物溶液:精密称取十七烷酸甲酯5 mg,置于5 mL量瓶中,加正己烷至刻度,摇匀,备用。
对照品溶液:精密量取100 μL 17种脂肪酸混合标准品(Supelco 17 Component FAME Mix,纯度≥98%)置2 mL量瓶中,加正己烷至刻度,混匀,备用。
供试品溶液:称取约1 g中国林蛙输卵管组织,加入焦性没食子酸、0.9%NaCl溶液、十七烷酸甲酯内标溶液,置于离心管中,匀浆,继续加入甲醇、氯仿,1 500 r/min,离心5 min,吸取下层溶液。剩余上层溶液中加氯仿、生理盐水,1 500 r/min,离心5 min,吸取下层溶液;剩余上层溶液中继续加氯仿、生理盐水,1 500 r/min,离心5 min,吸取下层溶液;合并3次吸取的下层溶液,置旋转蒸发仪氮气吹干。加入盐酸-甲醇溶液,100 ℃加热30 min,取出放置至室温,加入去离子水、石油醚,1 500 r/min,离心5 min,吸取上层溶液,下层溶液继续加入石油醚,涡旋,取出上层溶液,重复3次,合并上层溶液;加入去离子水,充分振荡3 min,1 500 r/min,离心5 min,弃去下层溶液,反复操作,将上层溶液洗至pH 5.0~6.0后,加入无水硫酸钠,静置,将液体倒出,置旋转蒸发仪氮气吹干,用正己烷充分溶解并定容至1 mL。
2.1.3 线性关系考察
精密吸取十七烷酸甲酯溶液(1 mg/mL)0.06、0.09、0.12、0.18、0.24 mL,分别置于1 mL量瓶中,加正己烷定容至刻度,摇匀,配成不同浓度的十七烷酸甲酯溶液。依次注入气相色谱仪测定,记录峰面积,以色谱峰面积(Y)为纵坐标,质量浓度(X)为横坐标,绘制标准曲线,求得回归方程。
2.2 PUFAs合成相关FAD表达量测定
2.2.1 中国林蛙哈蟆油RNA的提取
取不同生长阶段的中国林蛙输卵管组织置于预冷的研钵中,同时向研钵中倾入液氮保持低温并将其研成粉末,取50~100 mg输卵管粉末于离心管中,加入TRIzol约10 mL,振摇,碎冰中静置5 min,加入氯仿200 μL,振摇后插入碎冰中静置5 min,于4 ℃离心机中,14 000 r/min离心15 min。吸取上层清液置新离心管中,加入等体积的异丙醇,倒置并充分混摇,在0 ℃碎冰中放置10 min,随后在4 ℃离心机中,12 000 r/min离心10 min。弃上清液,向下层沉淀中加入1 mL经过DEPC水处理后的75%乙醇,4 ℃离心机中,12 000 r/min离心5 min,弃上清液,于碎冰中静置1 min,吸取20 μL DEPC水溶解RNA沉淀,待测。
2.2.2 cDNA反转录试验
吸取RNA Marker 10×Loading Buffer 2 μL与样品混匀,注入电泳槽电泳15 min。紫外灯下可见,电泳带区间有3条清晰的亮带。
采用SYBR Green法去除基因组DNA。反应体系:5×gDNA Eraser Buffer 2.0 μL,gDNA Eraser 1.0 μL,RNA 1.0 μL,RNase Free H2O 6 μL,混合液在42 ℃条件下反应2 min,之后于4 ℃保存备用。
采用TaKaRa公司的PrimeScriptTMRT reagent Kit with gDNA Eraser-Perfect Real Time试剂盒进行反转录。反应体系:Reaction solution 10 μL,5×PrintScript Buffer 2 10 μL,PrintScript RT Enzyme Mix I 1 μL,RT Primer Mix 1 μL,RNase Free H2O 4 μL,总体积20 μL。反应程序为37 ℃,15 min;85 ℃,5 s;PCR程序结束后自动降温至4 ℃保存,将得到的cDNA在-20 ℃保存。
2.2.3 cDNA荧光定量测定
选取EF1-α作为内参基因。采用TaKaRa公司的SYBR Premix EXTaqTM(Tli RNaseH Plus)试剂盒,其定量部分均在Mx3000PTMReal time PCR仪上操作,操作系统为StrataGene Mx3000P。反应体系总体积为20 μL,其中2×TransStart Top Green qPCR SuperMix 10 μL,Passiue Refeerence Dye(50×)0.4 μL,PCR Forword Primer(10 μmol/L)0.4 μL;PCR Reverse Primer(10 μmol/L)0.4 μL;DEPC水6.8 μL,cDNA 2 μL。两步法PCR扩增标准程序:95 ℃预变性,30 s;95 ℃变性5 s,60 ℃退火15 s,40个循环。熔解曲线95 ℃,5 s;60 ℃,60 s;95 ℃,15 s。采用2-ΔΔCT法计算相对基因表达量。
2.3 数据处理与分析
用SPSS 19.0对中国林蛙不同生长阶段哈蟆油中OA、ALA、AA、EPA和DHA含量聚类分析,采用离差平方和法,以欧氏距离为区间聚类。依据中国林蛙不同生长阶段哈蟆油总PUFAs含量与OA、ALA、AA、EPA和DHA含量及相对基因表达量的数据,使用SPSS 19.0和R 4.0.1进行相关性分析。
3 结果与分析
3.1 系统适用性
以十七烷酸甲酯浓度(X)为横坐标,色谱峰面积(Y)为纵坐标,进行线性回归,得回归方程为Y=2 034.700X+11.146,相关系数R2=0.999 3,表明十七烷酸甲酯内标的线性关系良好(图1)。以十七烷酸甲酯为内标,17种混合脂肪酸为混标(图2),测定了供试品含量,得到气相色谱图(图3)。
图1 内标物(十七烷酸甲酯)色谱图Fig.1 Chromatogram of internal standard (methyl heptadecanoate)
图2 17种混合脂肪酸混标色谱图Fig.2 Mixed standard chromatograms of 17 fatty acid methyl esters
图3 哈蟆油PUFAs供试品色谱图Fig.3 Chromatogram of the test product of PUFAs
3.2 中国林蛙哈蟆油PUFAs含量
采用“2.1.1”项下色谱条件测定不同生长阶段中国林蛙哈蟆油总PUFAs含量及OA、ALA、AA、DHA、EPA含量(表1)。由表1可见,中国林蛙在散居冬眠期时哈蟆油中总PUFAs含量及OA、ALA、AA、DHA、EPA含量最高。
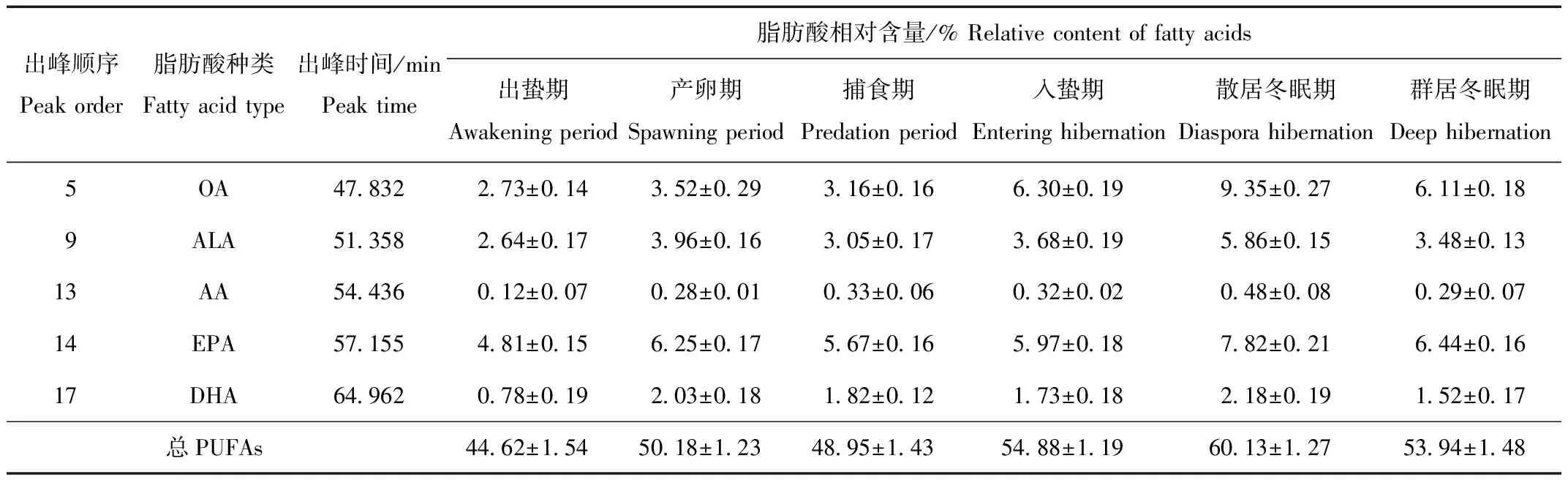
表1 不同生长阶段中国林蛙哈蟆油中PUFAs含量
由图4可见,6个生长阶段中国林蛙哈蟆油样品可聚为三大类:散居冬眠期单独聚为一类,记为第1类,此类总PUFAs和5种重要PUFAs含量位列首位,明显高于总体平均值;入蛰期和群居冬眠期聚为一类,记为第2类,此类总PUFAs、OA和EPA含量略高于总体平均值,ALA、AA和DHA含量与总体平均值相似;出蛰期、产卵期和捕食期聚为一类,记为第3类,此类总PUFAs和5种重要PUFAs含量均低于总体平均值。综上可知,不同生长阶段中国林蛙哈蟆油中PUFAs含量存在明显差异,其中散居冬眠期各PUFAs含量较高,其次为入蛰期和群居冬眠期,最低为出蛰期、产卵期和捕食期。
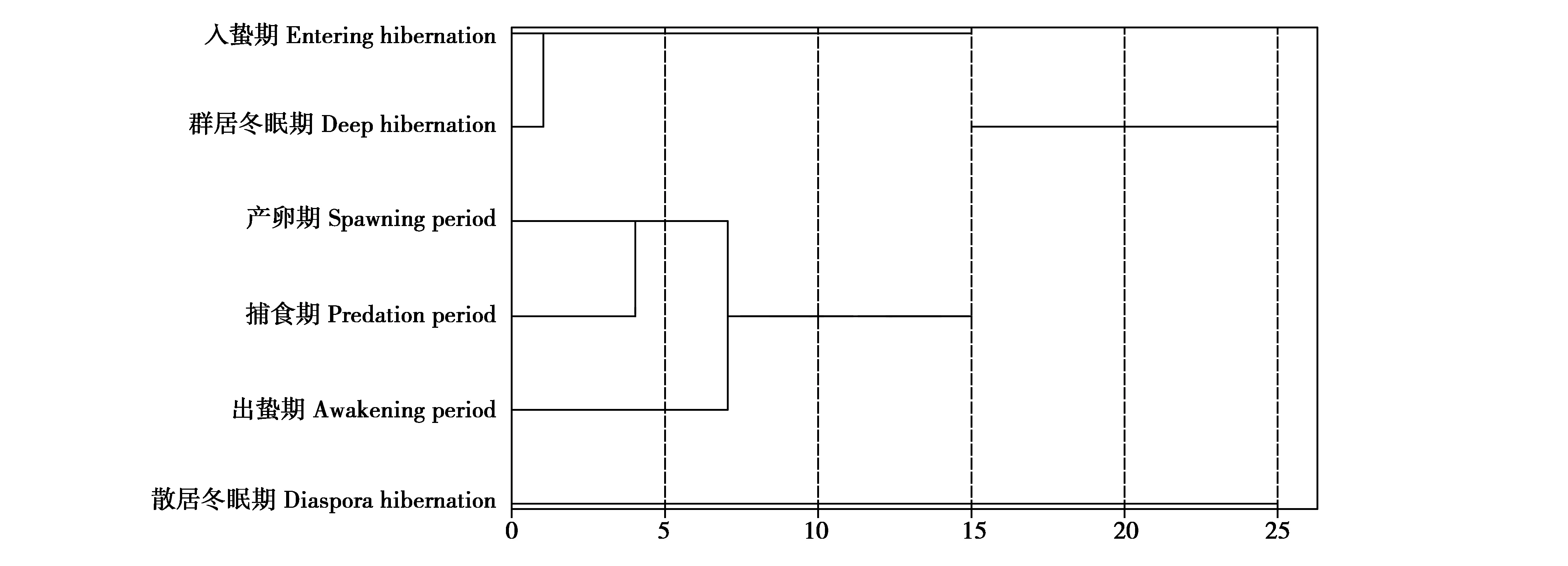
图4 中国林蛙不同生长阶段哈蟆油PUFAs含量聚类分析树状图Fig.4 Dendrogram of cluster analysis of PUFAs content in oviductus ranae at different growth stages of Rana chensinensis
3.3 FAD表达量
中国林蛙不同生长阶段哈蟆油PUFAs合成相关FAD的表达情况如表2所示。由表2可见,中国林蛙全年不同生长阶段哈蟆油中各个基因的表达,基本在散居冬眠期达到峰值;Δ6-FAD、Δ5-FAD和Δ9-FAD基因表达量在出蛰期—捕食期先升高后降低;Δ6-FAD、Δ5-FAD和Δ9-FAD基因的表达量在捕食期—散居冬眠期不断升高;Δ6-FAD和Δ9-FAD基因在散居冬眠期—群居冬眠期时表达水平下调;Δ5-FAD基因在散居冬眠期—群居冬眠期时表达水平有所提高;n-3FAD1和n-3FAD2基因在全年都处于一个相对较稳定随外界气温降低有所升高的表达量水平。
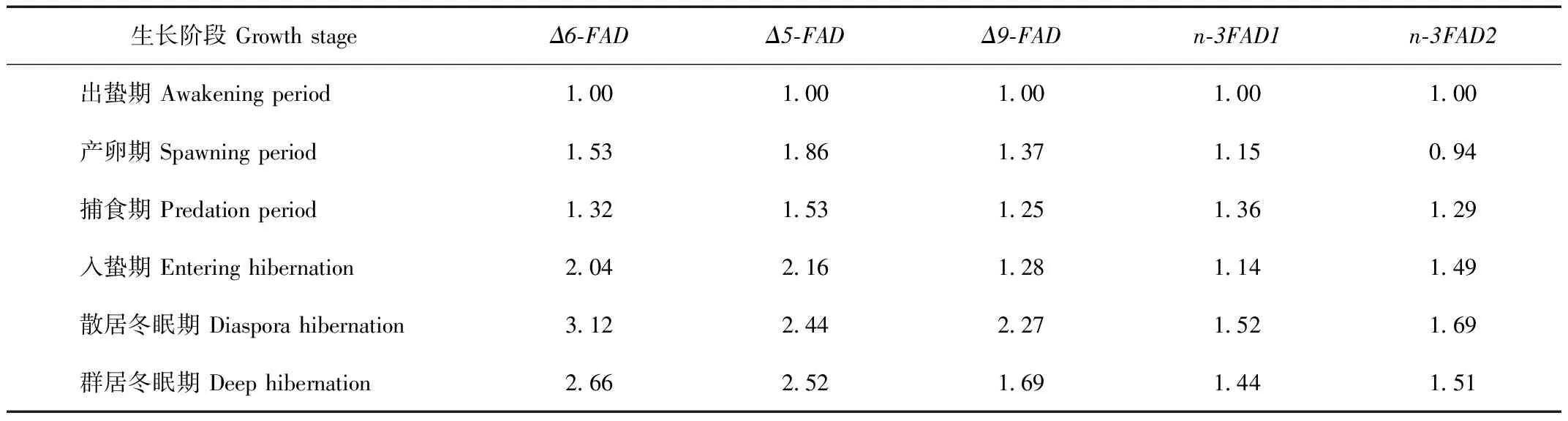
表2 不同生长阶段中国林蛙哈蟆油FAD相对表达量
3.4 相关性分析
3.4.1 不同生长阶段PUFAs之间的相关性
依据相关性分析(表3)可见,不同生长阶段OA、ALA、AA、EPA、DHA含量与总PUFAs均具有强相关关系(相关系数均大于0.8),这可能与总PUFAs与单独PUFA具有相同的合成和代谢途径有关,因而含量具有相似的变化趋势和强相关性。其中OA和EPA的置信度小于0.05,与总PUFAs具有显著相关性,可认为两者在中国林蛙哈蟆油采集时期的鉴别上具有重要意义。
3.4.2 不同生长阶段各PUFAs含量与基因相对表达量的相关性
由表3可见,在中国林蛙不同生长阶段哈蟆油样本中,各基因的表达量与各生长阶段总PUFAs含量相关性强弱顺序为Δ6-FAD(0.94)>Δ5-FAD(0.91)>Δ9-FAD(0.89)>n-3FAD2(0.87)>n-3FAD1(0.72),其中Δ9-FAD、n-3FAD1、n-3FAD2基因表达量与总PUFAs含量有强相关性,但其置信度均大于0.05,故不具有显著相关性;仅有Δ6-FAD和Δ5-FAD基因的表达量与总PUFAs含量具有显著相关性(P<0.05)。在各基因表达量与单独PUFA含量相关性分析中:Δ6-FAD基因表达量与各生长阶段OA和EPA含量具有显著相关性(P<0.05),与ALA具有强相关性;Δ5-FAD基因表达量与各生长阶段OA、AA和EPA含量具有强相关性;Δ9-FAD基因表达量与各生长阶段OA、ALA和EPA含量均有显著相关性(P<0.05);n-3FAD1和n-3FAD2基因表达量与各生长阶段AA、EPA含量有强相关性。
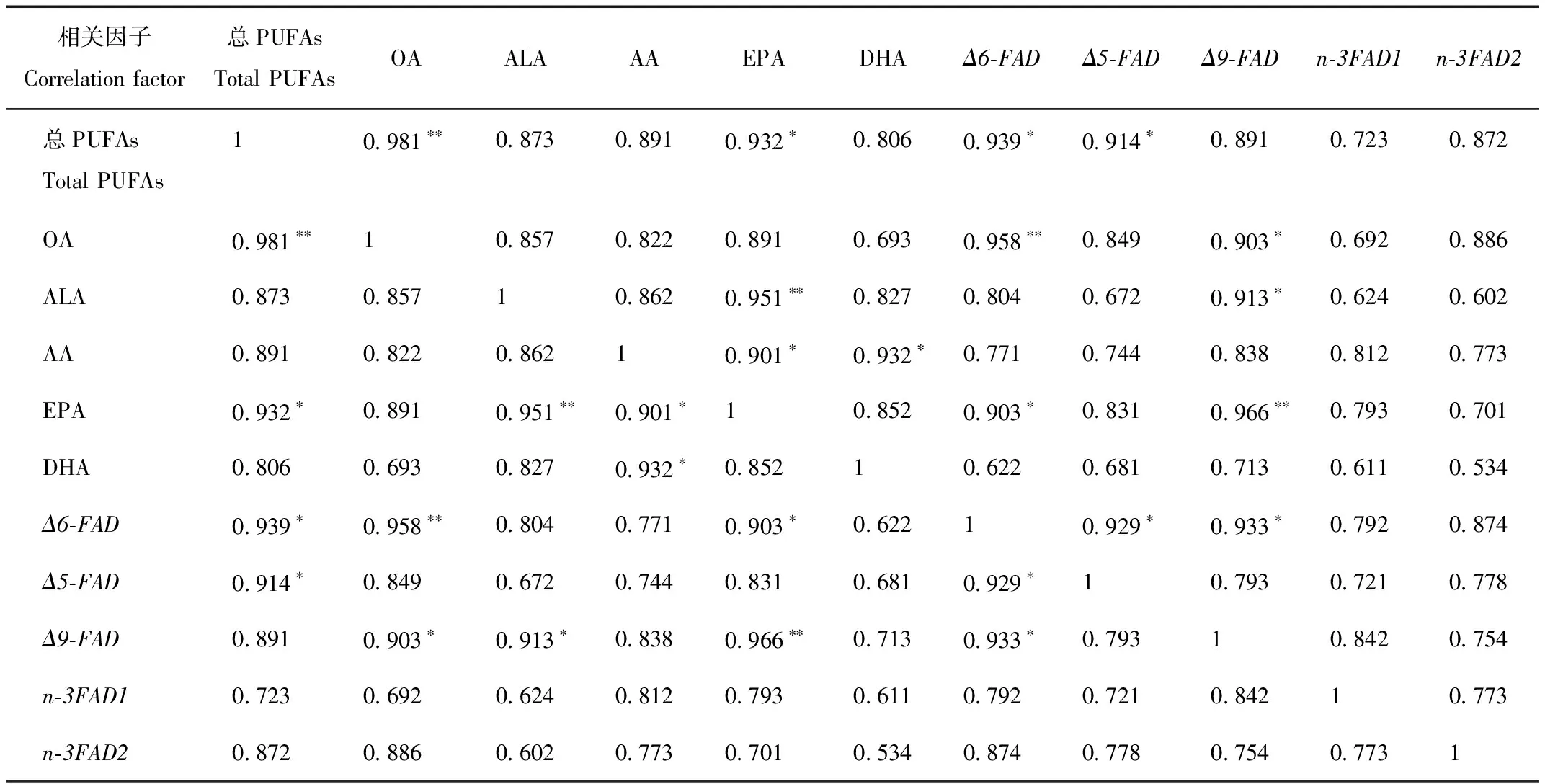
表3 总PUFAs含量与单独PUFA含量、基因表达量的相关性
4 讨论
在本研究中,供试林蛙为吉林省靖宇县人工包山封沟放养的中国林蛙。连续3年采收每个生长阶段的中国林蛙,每个阶段的样本量最少为6只,试验误差均在合理误差范围内。研究表明,Δ6-FAD、Δ5-FAD、Δ9-FAD、n-3FAD1和n-3FAD2在散居冬眠期时表达量达到峰值,即在中国林蛙生长的11—12月达到最大值,说明此时中国林蛙哈蟆油中PUFAs的合成达到1年中的顶峰,依据PUFAs含量测定结果也可看出该时期中国林蛙哈蟆油中的PUFAs含量最高。Δ6-FAD、Δ5-FAD和Δ9-FAD基因表达量在出蛰期—捕食期先升高后降低,出蛰期—产卵期升高可能是中国林蛙在产卵期时需要大量的营养物质供应,这其中必然包括大量PUFAs的合成,Δ6-FAD、Δ5-FAD和Δ9-FAD基因表达的酶在OA、ALA、AA、EPA和DHA等PUFAs的合成中具有关键作用,中国林蛙需要提高这几种基因的表达来满足自身产卵的营养需求。产卵期—捕食期降低可能是中国林蛙刚刚产卵,身体中营养消耗较多并开始进入捕食期,通过捕食进行自身营养的补充;另一方面,中国林蛙进入捕食期后,外界温度升高,体内已无需高比例的PUFAs来维持生命体征,故调控体内PUFAs合成的关键酶基因,Δ6-FAD、Δ5-FAD和Δ9-FAD受到该信号影响,降低表达水平。在捕食期—散居冬眠期,Δ6-FAD、Δ5-FAD和Δ9-FAD基因的表达量不断升高,可能是因为中国林蛙在捕食期后体内存有大量的糖类、蛋白质和脂肪酸等,进入入蛰期和散居冬眠期时外界环境温度开始骤降,中国林蛙为在寒冷的环境中生存,需合成大量的PUFAs维持自身细胞膜的流动性,受此外界信号的调节,升高Δ6-FAD、Δ5-FAD和Δ9-FAD基因的表达水平。在散居冬眠期—群居冬眠期,Δ6-FAD和Δ9-FAD基因表达水平下调,可能由于此时中国林蛙已进入冬眠期,体内已合成较多的PUFAs,基本可以满足抗寒和维持生命之需。Δ5-FAD基因在中国林蛙体内与EPA的合成关系较为密切,而EPA在促进脂肪酸代谢,减少血液黏度(减少血小板凝血功能)、清理血管垃圾等方面具有重要作用。中国林蛙在冬眠时需要维持血液的循环通畅,使得Δ5-FAD基因在散居冬眠期—群居冬眠期时表达水平提高,从而增加体内EPA的含量。
n-3FAD1和n-3FAD2基因与n-3系列PUFAs的合成有重要的关系,n-3系列的PUFAs不仅是生物细胞膜的重要组分,且在生物体内具有重要的生理功能。正因为n-3系列PUFAs在生物体内举足轻重的地位,n-3FAD1和n-3FAD2基因在全年都处于一个相对较稳定、且随外界气温的降低有所升高的表达量水平,以此保障中国林蛙体内n-3系列PUFAs的正常合成。
Δ6-FAD在PUFAs的形成中起着极为重要的作用,其在不饱和脂肪酸的第6位和第7位碳原子脱氢[8],从而引入双键,是PUFAs合成途径中的关键酶。在合成途径中,Δ6-FAD基因主要调控OA、ALA、AA和DHA等重要PUFAs的合成和代谢,故其在PUFAs积累过程中起到关键调控作用。Δ5-FAD是合成 PUFAs 途径中的第二个限速酶,Δ5-FAD基因是调控AA、EPA等重要PUFAs合成的关键基因。由于Δ6-FAD和Δ5-FAD基因表达量与总PUFAs含量及所调控的重要单独PUFA含量有显著相关性,可认为Δ6-FAD和Δ5-FAD的基因表达量在中国林蛙不同生长阶段哈蟆油的鉴别上具有重要意义。
PUFAs和FAD的关联性在其他蛙类物种中未见文献报道,这种关联机制将在后续试验中继续探讨。中国林蛙在冬季大约有6个月的冬眠期,在低温环境下只有维持细胞膜的流动性才可确保细胞膜执行正常的生理功能[9]。细胞膜的流动性与脂肪酸组成密切相关,脂肪酸中PUFAs的流动性比饱和脂肪酸更强。因此,PUFAs的变化规律对于维持细胞的结构、膜的流动性以及酶的活性具有非常重要的作用。变温动物或恒温动物能通过调节细胞膜中脂肪酸的饱和程度来适应外界环境温度的变化,而这种适应能力主要是通过FAD对脂肪酸的去饱和催化作用来实现的。本研究表明中国林蛙冬眠时,哈蟆油中FAD关键基因的表达量增加,从而增加PUFAs合成量,保证其能安全度过冬眠期。
5 结论
通过对中国林蛙不同生长阶段哈蟆油进行PUFAs测定及关键酶基因表达量测定,并采用SPSS 19.0和R 4.0.1对测得数据进行相关性分析,得出中国林蛙哈蟆油最佳采收期为散居冬眠期,即每年的11—12月。
对不同生长阶段中国林蛙哈蟆油总PUFAs含量与单独PUFA含量进行了相关性分析,发现OA、ALA、AA、EPA、DHA含量与总PUFAs均具有强相关关系(相关系数均大于0.8),仅OA、EPA与总PUFAs具有显著相关性,在哈蟆油采集时期的鉴别及质量评价上具有重要参考价值。
对不同生长阶段中国林蛙哈蟆油总PUFAs含量与单独PUFA含量、基因相对表达量进行了相关性分析,Δ9-FAD、n-3FAD1、n-3FAD2基因表达量与总PUFAs含量有强相关性;仅有Δ6-FAD和Δ5-FAD基因的表达量与总PUFAs含量具有显著相关性,因此,Δ6-FAD和Δ5-FAD基因的表达量在哈蟆油采集时期的鉴别及质量评价上具有重要参考价值。
