中华草龟源维氏气单胞菌的分离及生物学特性鉴定
2022-05-16赵允清邵明珠郭家媚周云宵吴同垒张志强张召兴张艳英
赵允清 邵明珠 郭家媚 葛 成 周云宵吴同垒 张志强 任 海 张召兴,2* 张艳英*
(1.河北科技师范学院,河北省预防兽医学重点实验室,秦皇岛,066604;2.河北旅游职业学院畜牧兽医系,承德,067000)
中华草龟(Chinemysreevesiis)又称泥龟、乌龟等,在我国龟类中分布最广、数量最多,具有生长快、抗病力强、出肉率高、味道鲜美且具有观赏性等特点,养殖量逐年攀升[1]。维氏气单胞菌(Aeromonasveronii)又名维罗纳气单胞菌、维隆气单胞菌和凡隆气单胞菌等,属于弧菌科(Vibrionaceae)气单胞菌属成员,其中维罗纳生物型和维氏气单胞菌温和生物型是维氏气单胞菌的2个变种,可以引起水生动物、哺乳动物及人患胃肠炎、脑膜炎、腹泻和菌血症等疾病,是人—兽—鱼共患病原菌[2-3]。维氏气单胞菌是主要存在水系统中的一种条件致病菌,在正常水系统生态环境下不导致疾病,当环境中存在应激因素时,如换料、转群等,有些致病菌株可以引起龟、蟹、鱼、虾及大鱿等水产动物发病,死亡率最高可达到100%,给水产养殖业带来严重的经济损失[4-5]。维氏气单胞菌携带肠毒素、气溶素、溶血素、外膜蛋白和细胞毒性肠毒素等多种毒力基因,该菌致病与其携带的毒力基因表达具有一定相关性,且分离的致病菌株大多数携带肠毒素、溶血素和细胞游离性溶血素等毒力基因[6-7]。维氏气单胞菌对临床中常用的抗生素具有较高的耐药性,出现多重耐药性,耐药性的产生与环境、温度、用药的频率及携带耐药基因等多方面有关[8]。
本研究从患病死亡的中华草龟体内分离得到1株维氏气单胞菌,命名为CRQ1,并检测其致病性、毒力基因、耐药性和耐药基因,为进一步对水产养殖业中维氏气单胞菌的防控提供科学指导,降低养殖户的经济损失。
1 材料与方法
1.1 样品来源
患病濒死的中华草龟来自河北科技师范学院大学生创业中心中华草龟养殖基地;健康斑马鱼(Brachydaniorerio)来自河北省秦皇岛市旺旺水族馆。
1.2 细菌分离与培养
将濒死的中华草龟无菌解剖,取肝组织、肠道等病料划线接种于绵羊鲜血平板上,倒置于恒温培养箱中28 ℃培养18~24 h后,挑选形态大小一致的优势菌落接种于RS琼脂培养基进一步鉴定培养,获得纯化后的菌株进行革兰氏染色,分离菌株命名为CRQ1。
1.3 分离菌的生化试验鉴定
按照说明书,将纯化培养的分离菌调整菌液浓度为OD600≈0.4时,接种于ID32E生化鉴定试条中,37 ℃恒温培养24~48 h,利用ATB自动化微生物生化鉴定系统进行生化特性鉴定。
1.4 分离菌的16S rRNA鉴定
用提取试剂盒提取分离菌株的基因组DNA为模板,以细菌通用16S rRNA基因序列(5′-CCGTCTTCAGTTCCAGTGTG-3′/5′-GTGGCGGACGGGTGAGTAA-3′)为引物,PCR扩增出大小约为1 500 bp的目的片段。回收基因片段与pMD-18T载体连接,构建重组质粒由生工生物工程(上海)股份有限公司测序,利用BLAST软件将测序结果与GenBank中登录的16S rRNA序列进行同源性比对,构建系统进化树。
1.5 分离菌的致病性试验
将分离纯化培养的菌液培养至对数期(OD600=0.8)时,滴板计数,调整菌液浓度。将100尾健康斑马鱼随机挑选大小一致的分为7组,每组10尾进行试验。1~6组每尾注射菌液20 μL,浓度分别为1.0×103、1.0×104、1.0×105、1.0×106、1.0×107、1.0×108cfu/mL,第7组为对照组,注射等量的PBS,感染12 h后,观察15 d,记录每组发病情况及死亡情况,利用改良寇氏法计算分离菌株感染健康斑马鱼的半数致死量( LD50)。
1.6 毒力基因检测
参照文献[6-7],设计维氏气单胞菌act、aha、Exu、aerA、LuxS、Lip、Hly、ompA和Ser9种毒力基因引物,由生工生物工程(上海)股份有限公司合成,以提取分离株CRQ1的基因组DNA为模板。PCR扩增相关毒力基因,回收PCR产物测序,测序结果与GenBank中登录的毒力基因序列进行同源性比对(BLAST软件)。
1.7 药敏试验
参考文献[9],采用美国临床实验室标准机构(CLSI)推荐的K-B纸片扩散法对分离纯化的细菌进行10种药物的敏感性试验。
1.8 耐药基因的检测
参照文献[10-11],四环素类耐药基因tet(A)、tet(C)、tet(D)、tet(E)、tet(G),氟喹诺酮类耐药基因qnrA、qnrB、qnrC、qnrD、qnrS、qepA、oqxA、oqxB、gyrA、gyrB、parC、parE,氨基糖苷类耐药基因aadA1、aadA2、StrA、aac(6)-Ib、aadB、aac2、aac4、aadD、npmA、ant-Ia、aac(3)-Ia,磺胺类耐药基因sul-1、sul-3,大环内酯类耐药基因ermB、mefA、ermA,5类耐药基因引物由生工生物工程(上海)股份有限公司合成,利用已提取的细菌基因组DNA为模板,进行PCR扩增,回收PCR产物测序,测序结果与GenBank中登录序列进行同源性比对(BLAST软件)。
2 结果与分析
2.1 菌株分离培养与鉴定
从中华草龟病变肝脏组织中,分离纯化到1株单一病原菌,命名为CRQ1。CRQ1株在7%脱纤兔血培养基长出边缘整齐、光滑的圆形菌落,形成透明的溶血环,呈现β溶血;在RS琼脂培养基长出圆形、边缘整齐、透明的淡黄色菌落。染色镜检为阴性菌,可见单个或者成对排列,略微弯曲短杆状菌。CRQ1菌株经ATB自动化微生物生化鉴定系统鉴定为维氏气单胞菌,其生化特征与维氏气单胞菌一致(表1)。CRQ1菌株经过培养特性、形态学及生化鉴定,初步鉴定为维氏气单胞菌。

表1 分离菌株的生化检测结果
2.2 分离菌16S rRNA鉴定
用提取试剂盒提取分离菌株的基因组DNA为模板,以细菌通用16S rRNA基因序列为引物,从分离菌CRQ1中扩增出大约为1 492 bp的PCR目的基因条带(图1)。16S rRNA基因的同源性分析结果显示,CRQ1菌株与GenBank中登录的10株维氏气单胞菌参考株基因序列同源性为97.9%~99.4%,16S rRNA系统进化树(图2)可见CRQ1分离菌与GeneBank登录的CP050012.1株聚为同一支,表明CRQ1分离菌为维氏气单胞菌。

图1 分离菌株16S rRNA鉴定结果Fig.1 Results of isolated strains of PCR amplification 注:M.DL2000 DNA Marker;1.菌株 Note:M,DL2000 DNA Marker.1,Isolates strain

图2 分离菌株的16S rRNA系统进化树Fig.2 Phylogenetic tree of 16S rRNA of isolated strains
2.3 分离菌的致病性
将分离菌CRQ1培养液分别经腹腔注射感染斑马鱼,24 h后出现死亡,直到感染后的第10天,死亡率100%,对照组试验斑马鱼无明显的症状,在死亡实验斑马鱼的内脏中分离到维氏气单胞菌。利用改良寇氏法计算分离株CRQ1的 LD50为3.57×107cfu/mL,表明从病死中华草龟肝脏中分离的维氏气单胞菌具有很强的致病性。
2.4 分离菌的毒力基因
用PCR方法对维氏气单胞菌毒力基因进行检测,结果显示,CRQ1株同时携带aerA、Hly、ompA、aha、Ser、LuxS、Exu、Lip和act9种毒力基因(图3),毒力基因的测序结果与GenBank中登录的维氏气单胞菌参考株基因序列同源性均大于97.0%,表明分离维氏气单胞菌携带多种毒力基因。
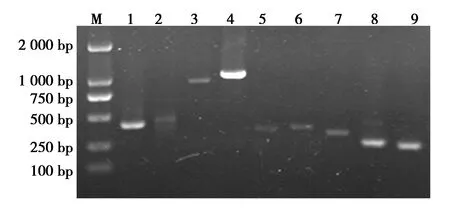
图3 分离菌株毒力基因检测结果Fig.3 Results of virulence gene detection of isolated strains 注(Note):M.DL2000 DNA Marker;1~9.aerA,Hly,ompA,aha,Ser,LuxS,Exu,Lip,act
2.5 分离菌的药敏特性
采用K-B法测定CRQ1菌株对18种抗菌药物的耐药性。结果显示,CRQ1菌株对头孢曲松、环丙沙星、诺氟沙星、恩诺沙星、氧氟沙星、多西环素、土霉素、林可霉素和替米考星9种药物高度敏感;对阿米卡星、链霉素、磺胺间甲氧嘧啶、青霉素、氨苄西林、氟苯尼考、卡那霉素及阿莫西林8种药物中度敏感;对新斯的明耐药(表2),表明该菌对多种药物较敏感,可以药敏结果轮换用药或穿梭用药。
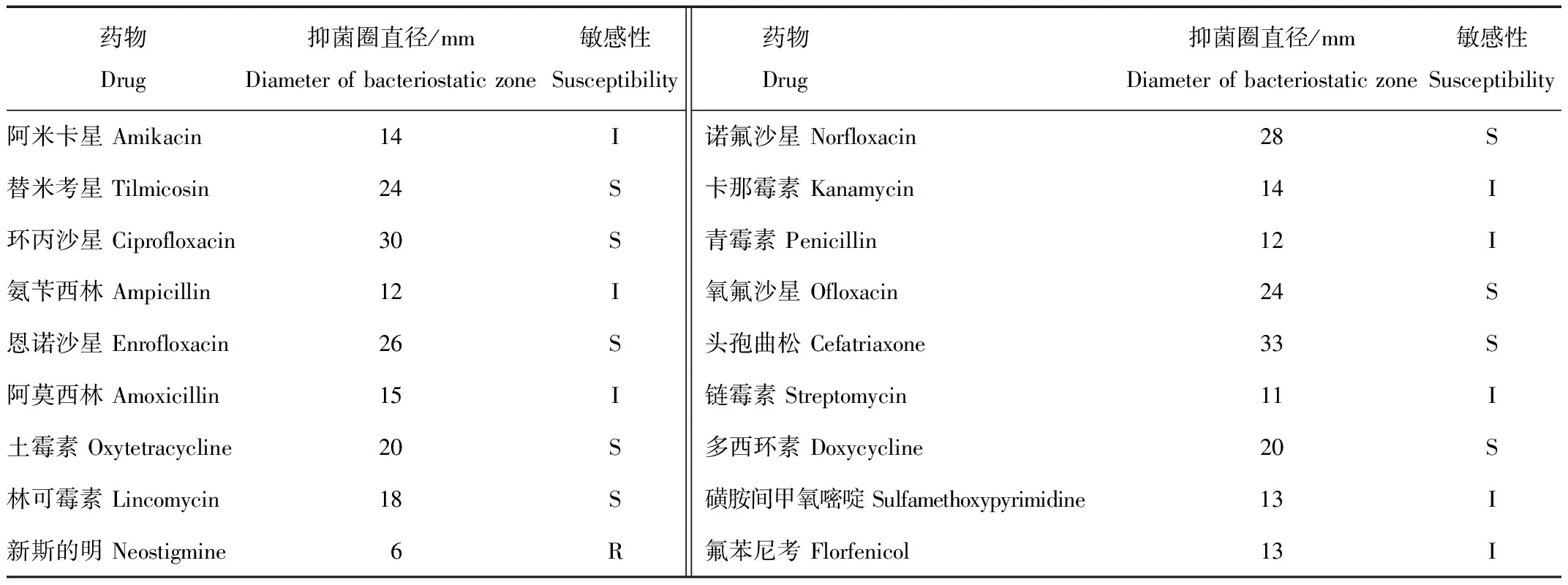
表2 分离菌药敏试验结果
2.6 分离菌耐药基因的PCR检测
用PCR方法检测CRQ1株的四环素类、氟喹诺酮类、氨基糖苷类、磺胺类和大环内酯类5类药物的耐药基因。结果显示,CRQ1株携带四环素类耐药基因tet(A)、tet(E),氟喹诺酮类耐药基因oqxA、gyrA、gyrB、parC、parE,氨基糖苷类耐药基因aac2、aac(6)-Ib、aadB、aac4,磺胺类耐药基因sul-1,大环内酯类耐药基因ermB(图4),由此可见,耐药基因型与耐药表型存在一定差异,说明分离株携带相关耐药基因还未表达出来,需要轮回用药和穿梭用药。测序结果与GenBank中登录的维氏气单胞菌参考株基因序列同源性均大于97.0%,表明CRQ1株携带多种耐药基因。

图4 分离菌株耐药基因检测结果Fig.4 Results of drug resistance gene detection of isolated strains 注(Note):M.DL2000 DNA Marker;1~33.tet(A),tet(C),tet(D),tet(E),tet(G),qnrA,qnrB,qnrC,qnrD,qnrS,qepA,oqxA,oqxB,gyrA,gyrB,parC,parE,aadA1,aadA2,StrA,aac2,aac4,aadB,aadD,npmA,ant-Ia,aac(3)-Ia,aac(6)-Ib,sul-1,sul-3,ermB,mefA,ermA
3 讨论
维氏气单胞菌广泛存在大自然的水体和土壤中,可以分为致病型和非致病型菌株,致病型菌株可以引起鱼、虾、龟等多种水生生物的溃疡、出血、腹水及败血症等,感染率和死亡率均较高,对水产养殖业造成较大经济损失[12-13]。该菌还可以引起人腹泻、患脑膜炎和败血症等,是临床中人—兽—鱼共患病原菌。近几年关于龟源的致病型维氏气单胞菌的报道逐渐增多。方振华等[12]从发病死亡的中华条颈龟(Mauremyssinensis)体内分离得到致病型维氏气单胞菌。何成伟等[14]从患病黄喉拟水龟(M.mutica)中分离到维氏气单胞菌。本试验从患病死亡的中华草龟分离得到致病型维氏气单胞菌,国内尚未见报道。维氏气单胞菌可能对龟类等水生动物的养殖存在潜在威胁,应该注重该病防控。
维氏气单胞菌携带多种毒力基因,致病性与携带多种毒力基因的表达有关,同时毒力基因的种类与数量对致病具有一定相关性,不同种类的毒力基因与致病性之间具有一定的差异性,毒力基因在致病过程中起着不可忽视的作用[15]。aerA是维氏气单胞菌的重要毒力基因,具有细胞毒性、溶血性和肠毒素毒性特性,可以导致全身脏器的广泛性出血;Lip主要参与宿主细胞膜的变化;Ser、Lip和aha参与气单胞菌黏附、整合;LuxS参与细菌生物膜的形成,加强细菌的感染力[6-7]。本研究从中华草龟体内分离的致病型维氏气单胞菌株,携带aerA、act、aha、Ser、Exu、Lip、Hly、ompA和LuxS9种毒力基因,说明携带毒力基因与致病性具有相关性,与任燕等[4]研究的草鱼源维氏气单胞菌致病性与携带毒力基因相关一致。中华草龟体内分离的致病型维氏气单胞菌携带多种基因,说明致病机制复杂,这些毒力基因可能具有协同致病作用。
临床中主要用抗生素对维氏气单胞菌进行防治,由于使用不合理,常用的抗生素会产生很强的耐药性。本研究表明,CRQ1株对常用的药物敏感,耐药性较低,与方振华等[12]、何成伟等[14]、Prediger等[16]研究的维氏气单胞菌的耐药性存在差异性,这可能与菌株及药物使用有关。经耐药基因检测结果表明,CRQ1株携带多种耐药基因,但是对临床中常用药物没有产生很强的耐药性,可能是耐药基因没有表达所致,耐药基因与耐药性的关联需要进一步研究。
