禽腺病毒4型荧光定量PCR检测方法的建立与初步评估
2022-05-14王国康贾妙妙冯贺龙邵华斌罗青平温国元
王国康 , 卢 琴 , 贾妙妙 , 李 丽 , 冯贺龙 , 邵华斌 , 罗青平 , 曾 驰 , 温国元
(1. 武汉轻工大学生物与制药工程学院 , 湖北 武汉 430023 ; 2. 湖北省农业科学院畜牧兽医研究所 , 湖北 武汉 430064 ; 3. 农业农村部畜禽细菌病防治制剂创制重点实验室 , 湖北 武汉 430064 ; 4. 畜禽病原微生物学湖北省重点实验室 , 湖北 武汉 430064)
禽腺病毒(Fowl adenovirus,FAdV)是家禽和野禽的常见传染病病原,一般呈感染率高、发病率低等特点,以隐性感染的形式普遍存在于鸡群中。在家禽免疫力低下、存在免疫抑制病或多病原混合感染时会导致感染的禽群发病。FAdV为腺病毒科禽腺病毒属成员,其基因组为单股双链DNA[1]。FAdV分为I、II和III共3个群,其中I群又分为A、B、C、D和E共5个亚群,包含12个血清型[2-3]。FAdV的主要结构蛋白有五邻体(Penton)、六邻体(Hexon)、纤突(Fiber)蛋白以及衣壳蛋白pⅠ、pVⅡ、PIIIa等,以这些蛋白为主构成了病毒粒子的核衣壳[4-5]。
2015年以来,鸡心包积水-肝炎综合征(Hydropericardium hepatitissyndrome,HHS)疫情在我国大面积流行,对养鸡业造成了严重的经济损失。FAdV血清4型(Fowl adenovirus serotype-4,FAdV-4)是HHS的病原,被归为I群C亚群,为我国当前主要流行的血清型[6]。与其他血清型相比,FAdV-4对鸡的致病性较强。发病鸡通常出现食欲不振、贫血、羽毛杂乱、鸡冠颜色变浅等症状,随后在3~5周龄突然死亡,并伴有淡黄色心包积液,偶有在肝脏形成包涵体,死亡率30%~90%[7]。由于FAdV-8和FAdV-11等其他血清型也在禽群中存在一定程度的感染。因此,为便于开展HHS的流行病学及临床检测等工作,有必要建立一种针对FAdV-4的病原学检测方法。
目前,针对FAdV-4的检测方法主要有琼脂扩散试验、酶联免疫吸附法、病毒分离鉴定和常规 PCR方法等[8]。荧光PCR方法是在常规PCR的基础上引入了荧光探针,其检测特异性和敏感性得到了增强,在特异检测FAdV-4病原方面具有一定的优势[9]。本研究以FAdV-4的Hexon基因为扩增靶区,设计了PCR引物和TaqMan探针,通过检测条件的优化,建立了FAdV-4荧光定量PCR检测方法,以期为该病的病原学监测和疫情诊断提供科学依据。
1 材料与方法
1.1 病毒和样品 FAdV-4 HB1510株、鸡减蛋综合征病毒HB76株、新城疫病毒LaSota株、鸡传染性支气管炎病毒H120株、H9N2禽流感病毒JM0305株和鸡大肠杆菌SS17-38株,均由本实验室保存。65份组织样品采集自湖北省武汉市新洲区和汉川市的养鸡场。
1.2 试剂和主要仪器 DNA提取试剂盒,购自美国 Axygen公司;荧光定量专用预混液(探针法)AceQ qPCR Probe Master Mix、快速PCR 2×Rapid Taq Master Mix,均购自南京诺唯赞生物科技有限公司;Trans2K Plus DNA Marker,购自北京全式金生物技术有限公司;DL2 000 DNA Marker,购自宝生物工程(大连)有限公司。荧光定量PCR仪为Bio-Rad公司生产的iQ5 Real Time PCR System。
1.3 引物和探针序列的设计合成 对NCBI上GenBank中的FAdV-4Hexon基因序列进行比对,选取其中相对保守的区域。根据保守区域序列,应用Primer Express 3.0软件设计了2对引物和1条探针(表1),分别用于荧光定量PCR和常规PCR检测。探针的5′端以荧光报告基团FAM标记,3′端以荧光淬灭基团TAMRA标记。引物和探针由生工生物工程(上海)股份有限公司合成。

表1 FAdV-4 荧光定量PCR和常规PCR方法的引物和探针序列
1.4 病毒核酸提取及标准品制备 病毒基因组提取采用小量DNA提取试剂盒,细菌基因组的提取采用细菌基因组提取试剂盒。提取的病毒和细菌基因组在-80 ℃保存待用。将FAdV-4细胞毒(105.0EID50/mL)进行10倍连续梯度稀释,直至10 EID50/mL, 稀释后的样品即可作为检测标准品。
1.5 荧光定量PCR检测方法 荧光定量PCR反应体系:AceQ qPCR Probe Master Mix 10 μL,PCR引物对(FAdV-F和FAdV-R)各1 μL,荧光探针(FADV-P)1 μL,DNA模板1 μL,加水补至20 μL。荧光定量PCR反应条件:95 ℃预变性5 min;95 ℃变性10 s,55 ℃退火和延伸35 s,50个循环。在此基础上,分别对引物及探针浓度、退火温度及循环次数进行优化。
1.6 常规PCR检测方法 常规PCR反应体系:2× Rapid Taq Master Mix 12.5 μL,PCR引物对(hexon-F和hexon-R)各1 μL,DNA模板1 μL,加水补至20 μL。 常规PCR反应条件:95 ℃预变性5 min;95 ℃变性15 s,56 ℃退火10 s,72 ℃延伸15 s,35个循环;72 ℃延伸5 min。2%琼脂糖凝胶电泳检测目的条带。
1.7 临床样品的检测 临床采集的组织样品按照1∶10(组织体重∶PBS体积)的比例加入PBS(pH 7.4),充分匀浆处理,高速离心去除沉淀。收集上清进行病毒基因组DNA的提取,用建立的荧光定量PCR和常规PCR方法进行检测,分析结果,比较两者的检测符合率。
2 结果
2.1 扩增靶区的选择 对NCBI上GenBank数据库中的各种血清型FAdV的Hexon序列进行比对分析,确定了一段在FAdV-4内高度保守、与其他血清型FAdV存在较大差异的序列。以该序列为扩增靶区,设计合成了PCR引物和TaqMan荧光探针。如图1所示,引物和探针序列与FAdV-4的毒株序列高度匹配,与我国流行的其他2种血清型FAdV-8和FAdV-11匹配性较差,FAdV-8不匹配碱基与总碱基之比分别为FAdV-F:10/16,FAdV-R:14/21,FAdV-P:9/22;FAdV-11不匹配碱基与总碱基之比分别为FAdV-F:9/16,FAdV-R:12/21,FAdV-P:10/22。序列分析结果表明,设计的引物和探针序列具有较好的FAdV-4特异性。

图1 荧光定量PCR的引物和探针与不同血清型FAdV毒株的序列匹配结果
2.2 荧光定量PCR检测条件的优化 经过各种检测条件的优化试验,确定了荧光定量PCR检测的反应体系及反应条件。反应体系:AceQ qPCR Probe Master Mix 10 μL,上下游引物终浓度为0.1 μmol/L,探针的终浓度为0.4 μmol/L,DNA模板为1 μL,最终加水补至20 μL;反应条件:95 ℃预变性5 min;95 ℃变性10 s,60 ℃退火35 s,40个循环,在每个循环60 ℃退火阶段收集荧光信号。
2.3 荧光定量PCR检测方法的敏感性试验 采用优化的FAdV-4荧光定量PCR检测条件,对梯度稀释的FAdV-4标准品(104、103、102EID50/mL和10 EID50/mL)进行病毒基因组DNA提取及荧光PCR反应,得到荧光定量PCR扩增动力学曲线(图2)和标准曲线(图3)。结果表明,荧光定量PCR可检测到病毒的最低浓度为10 EID50/mL。 在104~101EID50/mL 的浓度范围内,病毒滴度与Ct值呈良好的线性关系,标准曲线的线性回归方程为y=-3.286x+47.786,相关系数为0.994,扩增效率为101.5%。以常规PCR方法对上述标准品进行检测,能够检测出的最低病毒滴度为102EID50/mL(图4)。荧光定量PCR方法的检测敏感性比常规PCR高10倍。

图2 FAdV-4荧光定量PCR检测方法的标准曲线

图3 FAdV-4荧光定量PCR检测方法的扩增动力学曲线
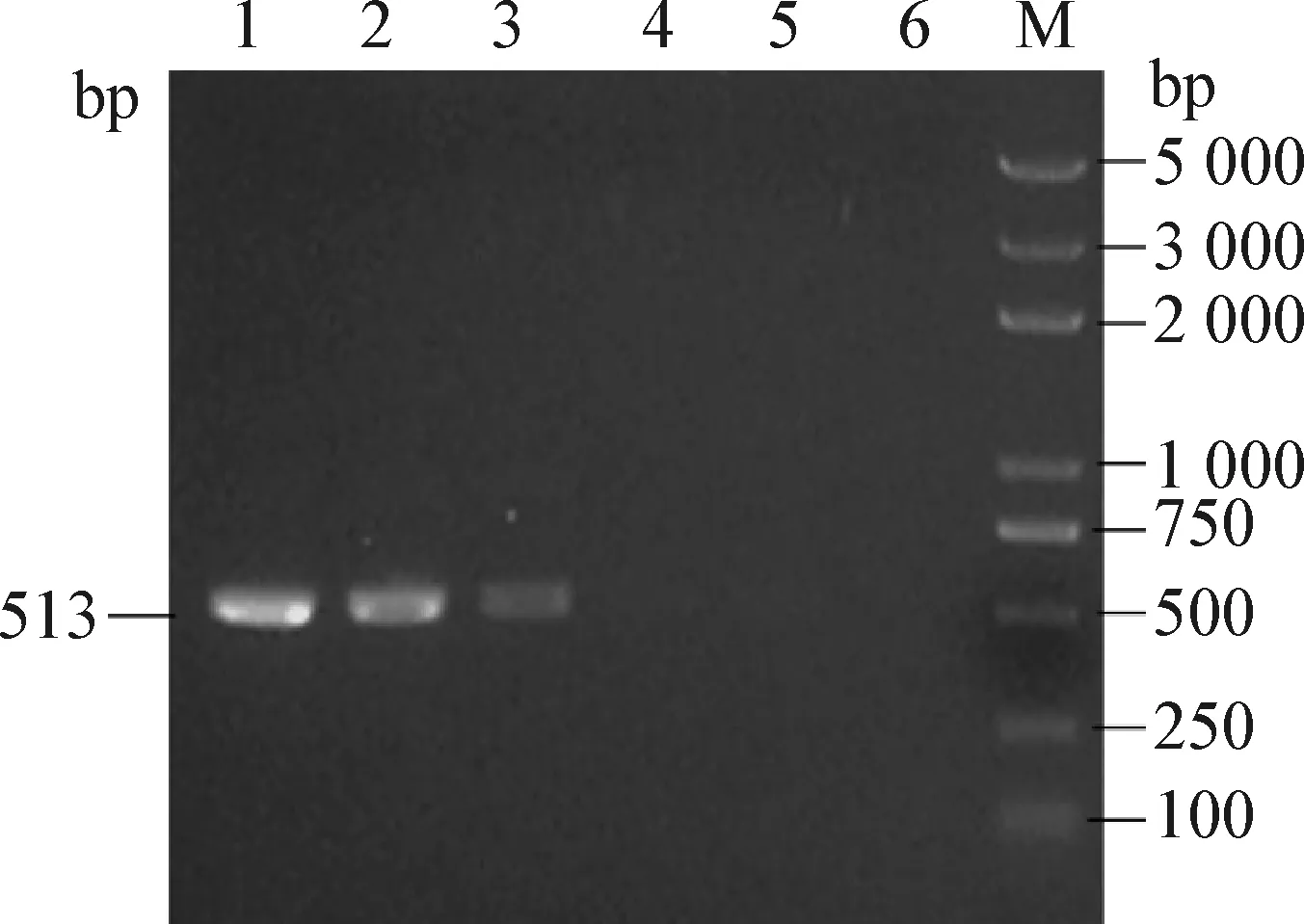
图4 FAdV-4常规PCR检测方法的敏感性检测结果
2.4 荧光定量PCR检测方法的特异性试验 建立的FAdV-4荧光定量PCR检测方法,对FAdV-4 HB1510株、鸡减蛋综合征病毒HB76株、新城疫病毒LaSota株、鸡传染性支气管炎病毒H120株、H9N2禽流感病毒JM0305株和鸡大肠杆菌SS17-38株进行检测。结果显示,仅有FAdV-4检测为阳性,其余样品与空白对照检测均为阴性,表明该检测方法具有较好的特异性。
2.5 荧光PCR检测方法的重复性试验 建立的FAdV-4荧光PCR检测方法,对4份FAdV-4临床阳性组织样品进行重复性检测,以分析其组内与组间重复性。结果表明,组内重复性试验中,Ct值的变异系数CV在0.31%~0.55%;组间重复性试验中,Ct值的变异系数CV在0.44%~1.12%(表2)。组内和组间变异系数均较小,表明建立的FAdV-4荧光定量PCR检测方法具有良好的重复性。

表2 FAdV-4荧光定量 PCR的重复性检测结果
2.6 荧光定量PCR检测方法的临床应用 5份临床采集的组织样品同时进行FAdV-4荧光定量PCR和常规PCR检测。结果如表3所示,荧光定量PCR检测的阳性数为9份,常规PCR检测的阳性数为3份。与常规PCR方法相比,荧光定量PCR方法的检测符合率为90.7%(59/65=90.7%),检测敏感性为100%(3/3=100%),检测特异性为90.3%(56/62=90.3%)。

表3 FAdV-4荧光定量PCR和常规PCR的临床样品检测比较
3 讨论
1987年3月由FAdV-4引起的HHS在巴基斯坦的安卡拉地区首次暴发,随后世界各地相继出现HHS疫情[10]。我国HHS疫情在2010年以后呈现了上升趋势,以2015年为分界线。2015年以前,仅有零星HHS疫情发生,但2015年之后,我国许多省市相继暴发HHS疫情,且疫情范围仍在不断扩大,给我国养鸡业带来了严重的经济损失[11]。为监测FAdV-4病原流行情况和疫情诊断,急需一种特异、敏感的FAdV-4病原检测方法。
当前FAdV-4的检测方法主要有琼脂扩散、酶联免疫吸附和常规PCR等方法。由于FAdV-8和FAdV-11等其他血清型毒株的临床感染情况较为普遍,这对FAdV-4的特异性检测造成了一定程度的干扰[12]。荧光定量PCR技术以其高灵敏度、高特异性、检测速度快等优点,在病原的定性和定量检测方面得到了广泛应用[9]。该技术可分为染料法和探针法。染料法中的荧光染料主要与双链DNA分子结合,所以当出现引物二聚体、单链二级结构和非特异性扩增产物时,也会产生荧光信号,导致出现假阳性[13-14]。Hexon基因保守区段GC含量较高,扩增时易产生引物二聚体,从而影响检测结果[15]。TaqMan探针法通过要合成标记有荧光染料的探针,即使有1个碱基突变也会影响探针的结合及检测效果,具有较高的检测特异性[13-16]。Hexon蛋白是FAdV病毒核衣壳的重要组成部分,具有群、亚群及型特异性的抗原决定簇[17-18],是实现FAdV-4特异检测的优选基因。
本研究通过对Hexon基因序列比对分析,设计合成了PCR引物和TaqMan荧光探针,其序列与FAdV-4的毒株高度匹配,而与其他血清型FAdV匹配性较差。经过引物、探针的浓度、退火温度和循环数等一系列检测条件优化之后,建立了快速检测FAdV-4的荧光定量PCR检测方法。敏感性试验中,TaqMan探针荧光定量PCR检测方法比常规PCR检测方法高10倍。特异性试验中,用各种病毒的核酸进行荧光定量PCR检测,除了FAdV-4外,其他病原均未出现有效扩增,表明特异性良好。重复性试验中,组内重复和组间重复变异系数均较小,说明重复性较好。临床样品检测中,与常规PCR方法相比,荧光定量PCR方法的检测符合率为90.8%,诊断灵敏度为100%,诊断特异性为90.3%。综上,FAdV-4荧光定量PCR检测方法敏感性高、特异性强、重复性好、操作简单快速,可为我国FAdV-4的流行病学监测和疫情诊断提供有力的技术支撑。
