胸膜肺炎放线杆菌多重耐药菌株与敏感菌株的差异蛋白质组学分析
2022-05-14李海利张青娴朱文豪焦文强方剑玉徐引弟王治方王克领郎利敏张立宪
李海利 , 李 静 , 张青娴 , 朱文豪 , 游 一 , 焦文强 , 方剑玉 , 徐引弟 , 王治方 , 许 峰 , 王克领 , 郎利敏 , 张立宪 , 邹 靖
(1.河南省农业科学院畜牧兽医研究所 , 河南 郑州 450002 ; 2.商丘市民权县农业农村局 , 河南 商丘 476800 ;3.信阳市畜牧工作站 , 河南 信阳 464000)
胸膜肺炎放线杆菌(Actinobacilluspleuropneumoniae,APP)是引起猪呼吸系统疾病的主要病原之一。APP是一种革兰阴性小球杆菌,有荚膜和菌毛,不形成芽孢,能产生毒素,新鲜病料中呈两极染色,人工培养24~96 h可见到丝状菌。APP临床菌株对多种常用抗生素表现出高水平耐药,对动物和人类生命安全具有潜在威胁。前人研究表明,一些直接参与耐药的蛋白最初都是发现于非致病菌,而后在非致病菌与致病菌之间进行传播[1-2]。细菌的耐药性可以通过质粒、染色体或耐药基因在同种细菌或不同种细菌之间进行传播,甚至是原核生物与真核生物之间进行传播,从而导致耐药菌广泛分布,耐药问题更加复杂[3-4]。定量蛋白质组学是研究耐药机制、研发新疫苗和诊断候选蛋白及新药物的有力工具。
多重耐药性的产生是一个涉及多种蛋白质和多条途径参与的过程,利用蛋白质组学技术可以全面、动态、定量地分析比较多重耐药菌株与敏感菌株中蛋白质种类和数量的改变,这不仅有助于筛选鉴定出APP耐药特异性标志物和特异性抗原,通过生物信息学分析还可能发现APP耐药中的某些通路,对APP的早诊、早治和新药研制具有重要的指导意义。
本试验采用同位素标记相对和绝对定量(Isobaric tags for relative and absolute quantification,iTRAQ)差异蛋白质组学研究策略,以临床分离的APP多重耐药菌株(HN201616)与标准菌株(CVCC261)的细菌全蛋白为研究对象,旨在从蛋白质水平上比较耐药菌株和敏感菌株细菌全蛋白的变化差异,寻找可能与耐药相关的已知或未知蛋白,探究APP耐药菌株产生多重耐药的原因。本试验的APP来自临床,是首次报道的具有高水平多重耐药表型的分离株。这些差异蛋白可能与APP的多重耐药性密切相关,本试验将有助于发现和探索这些蛋白质的新功能,并为明确APP的耐药机制和新药研发提供科学依据。
1 材料与方法
1.1 菌株 标准放线杆菌(APP)CVCC261,购自中国兽医微生物菌种保藏管理中心;临床分离多重耐药菌株(HN201616),来源于河南地区某养猪场肺脏分离,由本实验室保存。APP标准菌株对青霉素、哌拉西林、克林霉素、万古霉素等多种抗菌药物敏感。多重耐药菌株对青霉素G、哌拉西林、美洛培南、杆菌肽等耐药[5-9]。
1.2 主要试剂及配制 α-氰基-4-羟基肉桂酸,购自德国Bruker公司。脑心浸液琼脂[含10%犊牛血清和100 μg/mL烟酰胺腺嘌呤二核苷酸(Nicotinamide adenine dinucleotide,NAD)],购自青岛海博和北京路桥技术有限责任公司。
1.3 主要仪器 色谱仪是Thermo DINOEX Ultimate 3000 BioRS,分析柱是Durashell C18。质谱仪是AB SCIEX nanoLC-MS/MS,喷针口的直径是10 μm,捕获柱是Eksigent Chromxp Trap Column。
1.4 菌株复苏培养及保存 把标准菌株和临床分离菌株接种于脑心浸液琼脂(含10%犊牛血清和100 μg/mL NAD) 平板上,置于5%的CO2培养箱中培养24 h,提取单菌落进行纯化培养。连续传2代后进行质谱检测。挑取单菌落置于脑心浸液培养基里,37 ℃、180 r/min 震荡培养24 h,4 000 r/min离心30 min,弃上清液,收集菌体,-80 ℃冷冻保存备用。
1.5 样品处理方法 (1)蛋白提取及定量:用液氮把样品研磨成干粉,用200 μL的四乙基溴化铵(Tetraethylammenium bromide,TEAB)溶解干粉,然后加入4倍体积的冷丙酮[终浓度为10 mmol/L二硫苏糖醇(Dithiothreitol,DTT)]沉淀2 h;13 000 r/min离心20 min,收集沉淀;用冷丙酮重悬和离心,然后收集沉淀风干;加入100 μL TEAB溶解蛋白。采用Bradford法定量,采用12%的SDS-PAGE胶定量。(2)酶切和除盐:取100 μg(100 μL)蛋白用50 mmol/L碳酸氢铵(NH4HCO3)稀释,加入2 μg酶液;37 ℃消化过夜8~16 h;取酶解液,加入等体积的0.1%甲酸(Formic acid,FA)酸化;Strata-X C18柱子经甲醇活化,FA平衡后;将酶解液加入到柱子中,用0.1%FA+5%乙腈清洗柱子;冷冻抽干后用20 μL 0.5 mol/L TEAB复溶。(3)标记和等量混合:采用8-plex标记样本并等量混合。标记后的样本分为12个组分,分析柱是Durashell C18。LC-MS/MS条件:A:0.1% 甲酸,5% 乙腈;B:0.1% 甲酸,95% 乙腈;上样缓冲液:0.1% 甲酸,3% 乙腈。
1.6 生物信息分析和代谢途径分析 质谱分析后的蛋白,显著性差异蛋白质数目按照P≤0.05、差异倍数(Fold change,FC)≥1.5 和FC≤0.67条件筛选。生物信息学分析根据蛋白相邻类的聚簇(Cluster of Orthologous Groups of Proteins,COG)、分子功能基因本体论(Gene Ontology,GO)和京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)对蛋白进行注释。多重耐药菌株与敏感菌株差异蛋白Pathway富集分析的共同通路为糖酵解/糖异生、丙酮酸盐代谢、精氨酸、脯氨酸代谢以及缬氨酸和亮氨酸代谢。
2 结果
2.1 蛋白质的提取与含量测定 采用TCA-丙酮法对样品进行蛋白质的提取。选择Bradford定量方法定量提取总蛋白质,绘制标准曲线(图1),根据标准曲线计算样品的浓度。由图1可知,BSA浓度与OD595 nm之间存在良好的线性关系,所得方程为y=0.354 8x-0.006 1,R2=0.990 6。

图1 Bradford定量标准曲线
2.2 蛋白质的SDS-PAGE检测 SDS-PAGE电泳结果见图2。由图2可知,提取的蛋白质电泳条带清晰,符合下一步质谱分析,多重耐药菌株菌株与敏感菌株存在明显差异。

图2 SDS-PAGE电泳图
2.3 蛋白质定量及信息统计 使用Proteinpilot软件实现蛋白质组iTRAQ定量。显著性差异蛋白质数目按照P≤0.05、差异倍数(FC)≥1.5和FC≤0.67条件筛选。样品间蛋白显著差异数量见表1,上调蛋白数量见表2;下调蛋白数量见表3。

表1 样品中蛋白显著差异数量
由表2可知,外切酶ABC亚基A、3-磷酸甘油酸脱氢酶、6-磷酸葡糖酸内酯酶、甘油-3-磷酸脱氢酶、家族多药外排RND转运体周质适配器亚基、罕见脂蛋白B、细胞膜生物发生蛋白TolA、木糖ABC转运底物结合蛋白、有氧呼吸控制蛋白、钼ABC转运ATP结合蛋白、ABC转运蛋白ATP结合蛋白、钾转运外周膜蛋白、外切酶ABC亚基、膜蛋白、ABC转运体底物结合蛋白、ABC转运蛋白通透酶、转运蛋白腺苷三磷酸酶、6-磷酸葡糖酸内酯酶、铁ABC转运底物结合蛋白、ABC转运蛋白ATP结合蛋白、PTS甘露醇转运亚基IIABC、铁ABC转运体渗透酶、延长因子Ts等蛋白明显上调,其中家族多药外排RND转运体周质适配器亚基、木糖ABC转运底物结合蛋白、ABC转运蛋白结合蛋白、钼ABC转运ATP结合蛋白、ABC转运蛋白ATP结合蛋白、外切酶ABC B亚基、膜蛋白、ABC转运体底物结合蛋白、ABC转运蛋白通透酶、铁ABC转运底物结合蛋白、ABC转运蛋白ATP结合蛋白、PTS甘露醇转运亚基IIABC、铁ABC转运体渗透酶等这些蛋白与多重耐药密切相关。APP临床多重耐药菌株的出现和流行,与耐药蛋白的过度表达有关,这些蛋白的鉴定为APP新药研发和药物作用靶点奠定了基础。

表2 多重耐药菌株与敏感菌株鉴定出的部分上调蛋白
由表3可知,膜蛋白、二氢硫辛酰胺乙酰转移酶、肽ABC转运体底物结合蛋白、醋酸激酶、甘油醛-3-磷酸脱氢酶、锌ABC转运底物结合蛋白、铁ABC转运底物结合蛋白、推测的腐胺/亚精胺ABC转运体ATP酶、外膜羟肟酸铁受体、应激蛋白A、膜蛋白、家族转录调节因子、泛素生物合成蛋白、推测大肠杆菌素摄取蛋白等蛋白下调。这些下调蛋白的功能还有待进一步研究确定。

表3 多重耐药菌株与敏感菌株鉴定出的部分下调蛋白
2.4 表达量层次聚类分析和蛋白质功能注释 本试验所有差异蛋白的层次聚类结果见图3,显著差异的蛋白质数为395个,其中上调蛋白质205个,下调蛋白质190个。用R语言中Gplot包将有显著差异的蛋白质进行表达模式聚类分析(图3)。图3中每列表示1个样本,从左至右分别为多重耐药菌株和敏感菌株,每行表示1个蛋白,图中的颜色表示蛋白质在该组样本中相对表达量的大小,红色代表该蛋白质在该样本中表达量较高,绿色代表表达量较低。左侧为蛋白质聚类的树状图,右侧为蛋白质的名称,2个蛋白质分支离得越近,说明它们的表达量越接近;上方为样本聚类的树状图,下方为样本的名称,2个样本分支离的越近,说明这2个样本所有蛋白质的表达模式越接近,即蛋白质表达量变化趋势越接近。表达量较高的蛋白质呈红色,表达量较低的蛋白质呈绿色。通过不同颜色和颜色深浅,可以明显看出蛋白质的表达量的高低。
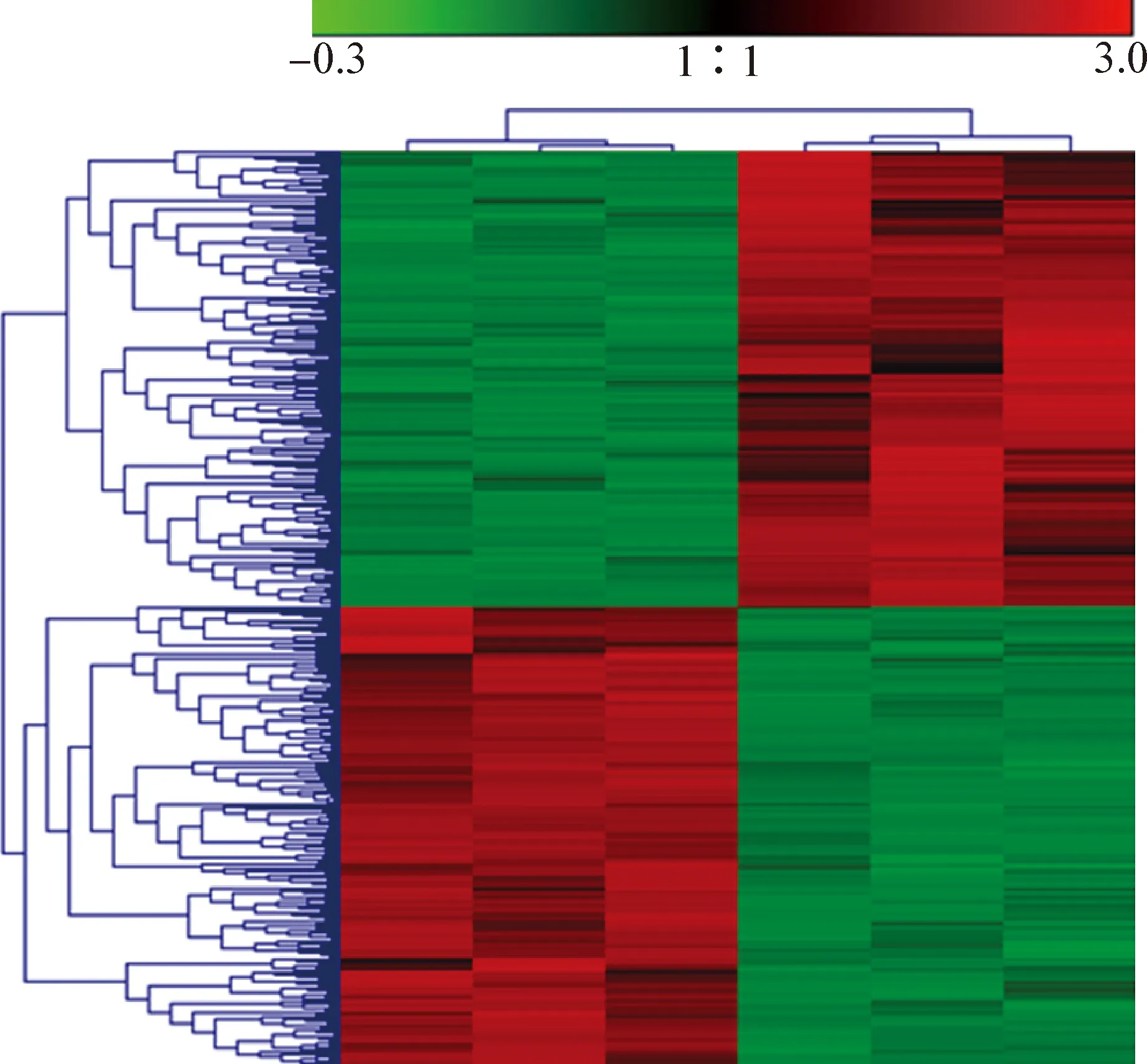
图3 差异蛋白层面按定量值的层次聚类结果
不同功能注释统计结果见图4。从图4可知,由于背景注释库的局限性,在一些数据库中,并不是所有的蛋白质都具有注释信息,COG功能注释到的蛋白质最多,为1 312个蛋白质;GO注释到1 216个蛋白质;KEGG注释到506个蛋白质。
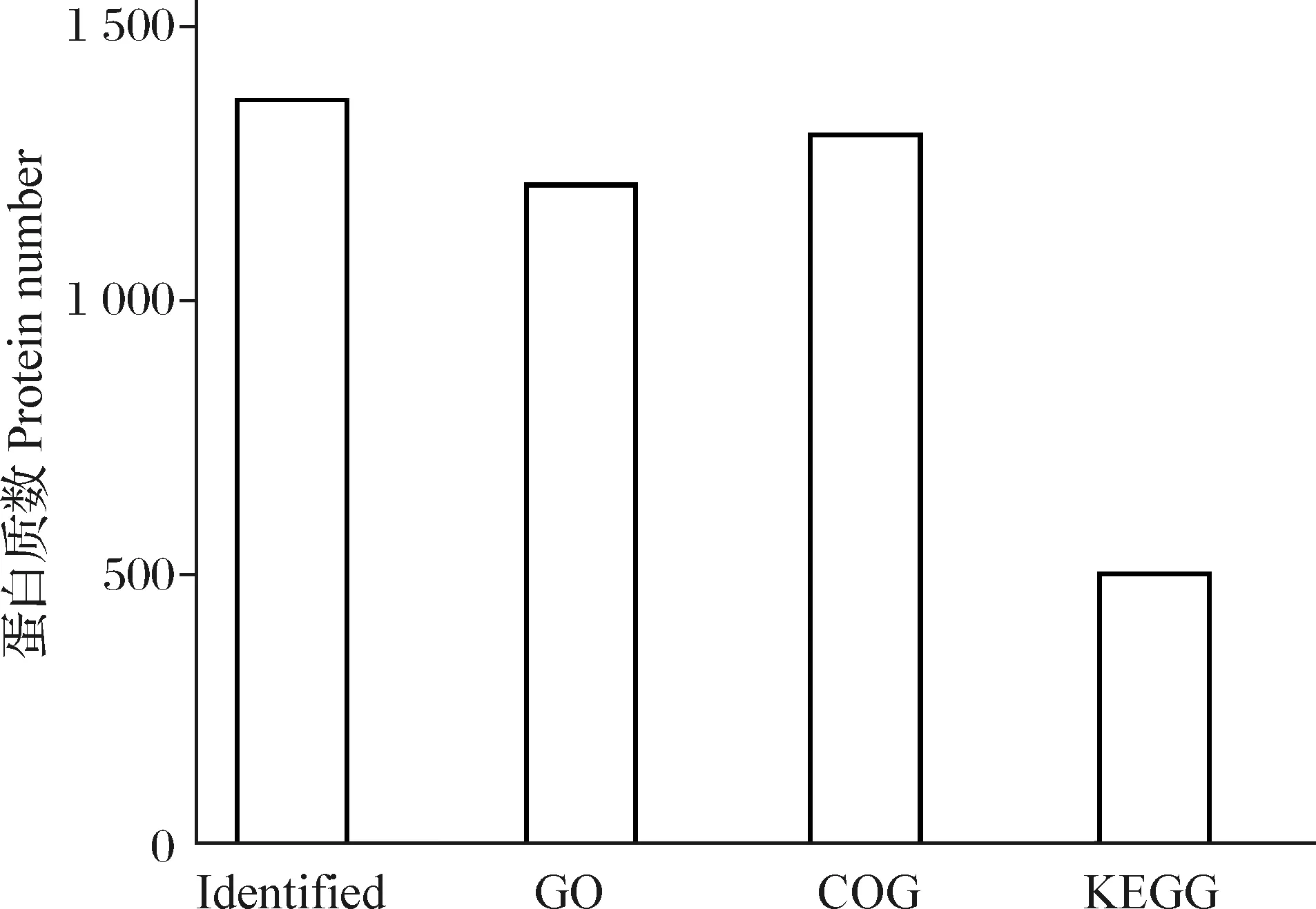
图4 不同功能注释结果统计
3 讨论
随着规模化养猪的不断发展,当前猪接触传染性胸膜肺炎已成为猪的严重呼吸系统疾病之一,常常单发或者发生混合感染,给养猪业造成了巨大的经济损失[10-13]。APP是国际公认的危害现代养猪业的重要传染病病原之一[14]。APP呈隐性持续感染并不断持续向外排毒,是猪场呼吸系统疾病发生的根本原因。近年来,随着抗生素的大量使用或滥用,使得细菌耐药性、药物残留、食品安全等问题变得日趋严重,抗生素超量使用或滥用不仅加大了动物性疾病防治和临床选用药物的难度,还能通过食物链危害人类[15]。同样,在集约化养殖的人工封闭环境中滋生的耐药菌株,通过质粒传播已成为耐药性传播的另一途径[16]。目前细菌耐药现象非常严重,出现了单耐药、多耐药和广泛耐药等菌株。目前临床分离出大量多重耐药菌株,因此开展细菌耐药性、流行病学和疫苗的研究具有重大意义。要控制APP的流行与蔓延关键在于掌握APP的耐药机制、有效的疫苗保护、早期诊断以及规范的联合用药预防和治疗[17]。
随着“超级细菌”的出现,增加了细菌病的治疗难度和治疗成本,使畜禽养殖业面临巨大威胁,也使人类面临着无药可救的尴尬局面。细菌是临床上常见的重要病原菌,而多重耐药APP菌株的出现尚属首次报道。本试验利用差异蛋白质组学技术对多重耐药APP菌株的全蛋白进行研究,这对深入了解APP细菌耐药机制和新药物研发具有重要意义。由于APP的强耐药性及生物安全性,因此利用蛋白质组学方法研究APP耐药机制的报道还非常少。本试验通过差异蛋白质组学研究多重耐药菌株与敏感菌株之间的差异,所用的1株多重耐药菌株由临床分离获得,经过超生破碎蛋白裂解等步骤之后,用iTRAQ技术分别与敏感标准株CVCC261进行比较和分析。总共鉴定1 373个蛋白,其中差异表达蛋白395个,包括上调蛋白205个,下调蛋白190个。按照其功能可分为抗原类蛋白、脂类代谢相关蛋白、肽聚糖合成相关蛋白、药靶相关蛋白、核酸类代谢蛋白、调控蛋白和生物膜形成相关蛋白等。其中抗原类蛋白在细菌宿主相互作用过程中起重要作用,也是诊断试剂开发、疫苗构建、新药物研发的候选标志物。
目前认为,引起细菌多重耐药主要原因是主动外排系统,有些细菌能够将进入细菌内的药物通过外排泵排出,从而使药物失去效力。细菌的外排系统主要由蛋白质组成,这些蛋白质主要来自5个家族:ATP-结合盒家族蛋白、耐药结节化细胞分化家族、主要易化子家族、小多药耐药家族和多药及毒性化合物外排族[11,15]。本试验发现,ATP-结合盒家族蛋白在多重耐药菌株中表达,而在敏感菌株中没有表达,由此可以推断ATP-结合盒家族蛋白很可能是APP中新发现的一种具有外排药物功能的蛋白,这在APP菌株中还属首次报道,但其具体作用机制还有待进一步研究。
本试验鉴定出的耐药蛋白主要有ATP-结合盒家族蛋白、二氢叶酸还原酶、外膜蛋白、麦芽孔蛋白、二氢酸合成酶等。生物标志物有谷胱甘肽转移酶、丙酮酸激酶M2和谷氨酰基水解酶等。这些蛋白可能与APP多重耐药性密切相关,后续需要采取分子生物学等方法进行深入研究,以便探索其具体的生物功能和作用机理。
