苯乳酸对具核梭杆菌的抑菌效果及机制
2022-05-13孔祥丽马岩石吴昕雨许晓曦
孔祥丽,马岩石,吴昕雨,许晓曦
(东北农业大学食品学院,乳品科学教育部重点实验室,黑龙江 哈尔滨 150030)
具核梭杆菌(Fusobacterium nucleatum,Fn)是革兰氏阴性厌氧菌,拟杆菌科,梭杆菌属,为人类共生菌。人类口腔、胃肠道等部位均发现其存在,该菌在不同的生态位下其种属有一定的特异性,属条件致病菌[1]。已有研究发现,具核梭杆菌与牙周疾病直接相关,其在口腔菌斑生物膜的形成中起到重要连接作用,且可协同其他口腔致病菌产生内毒素及刺激因子,诱导炎症发生[2-3]。Fn本身除了导致炎症因子上调,诱发口腔癌[4],亦是结肠直肠癌、宫颈癌、乳腺癌等疾病的重要关联菌[5-8]。Kashani等[9]对伊朗的80名Fn感染者分析发现,该菌可产生的特殊黏附素FadA,易形成生物膜。
苯乳酸作为天然有机酸,可以由部分乳酸菌通过苯丙酮酸在乳酸脱氢酶作用下产生[10]或由非乳酸菌如白地霉等产生[11],其结构稳定,可耐受高温等不良条件[12],为天然、安全的抗菌剂[13],能够有效抑制细菌、真菌的生长,在抑制单增李斯特菌[14]、大肠杆菌[15]、阴沟肠杆菌[16]、粪肠球菌[16]、金黄色葡萄球菌[16]等方面均有报道。由此表明,该生物有机酸在抑菌方面具有良好的应用潜力,但目前苯乳酸对Fn的抑菌作用及机制鲜有深入探究。
本课题组前期研究了200余种乳酸菌代谢产物对Fn的抑菌性,发现Lactobacillus rhamnosusGG、L. caseiM3和L. plantarumYYC-3的抑菌作用最好。此外,本团队前期研究还发现有关乳酸菌代谢产物对结直肠癌的预防调控作用中,植物乳杆菌的代谢产物对Fn导致的结直肠癌的预防作用最强[17];研究发现,植物乳杆菌LY-78代谢产物中的多种有机酸有一定的抑菌作用,经对比分析可知植物乳杆菌的抑菌性与其产生的天然有机酸苯乳酸相关[18];此外,本课题组还研究了苯乳酸对阴沟肠杆菌、粪肠球菌生物膜的抑制能力,从破坏细胞膜角度出发,详细探究了苯乳酸对这两种菌的抑菌作用[19]。
鉴于Fn对于结肠癌等恶性肿瘤细胞的保护及促生长和转移的特性[20],以及其可能于肠道形成生物膜对健康造成的威胁,本实验探究苯乳酸对Fn的生长抑制和破坏其形成生物膜的能力,在苯乳酸抑菌方面有重要的现实意义和实际应用价值。
1 材料与方法
1.1 材料与试剂
具核梭杆菌ATCC 25586 北京北纳创联生物技术研究院;L-3-苯乳酸 上海阿拉丁生化科技股份有限公司;硫乙醇酸盐液体培养基 青岛海博生物技术有限公司;碘化丙啶(propidium iodide,PI)荧光染液 美国Beckman Coulter公司;总蛋白(total protein,TP)测定试剂盒南京建成生物工程研究所;75%(体积分数)乙醇、95%(体积分数)甲醇、冰乙酸、0.5%(质量分数)结晶紫染色液、甘油、4%(质量分数)多聚戊二醛、纯叔丁醇北京索莱宝科技有限公司。
1.2 仪器与设备
Bioscreen全自动生长曲线分析仪 芬兰Growth Curves公司;JBQ-ZD全温振荡培养箱 常州普天仪器制造有限公司;LC-85C隔膜式抽气泵 上海力辰邦西仪器科技有限公司;GI54DWS高压灭菌器 美国致微仪器有限公司;3K 15高速冷冻离心机 德国Sigma公司;PB-10酸度计 北京赛多利斯科学仪器;SU8010场发射扫描电子显微镜 日本日立公司;SpectraMax i3x多功能酶标仪 上海美谷仪器有限公司、UV752N紫外分光光度计 上海仪电分析仪器有限;Mini VIDAS全自动荧光免疫分析仪 塞力斯医疗科技股份有限公司;Accuri C6 plus流式细胞仪 美国Becton Dickinson公司。
1.3 方法
1.3.1 Fn活化及培养
将200 μg Fn冻干菌粉接入10 mL液体硫乙醇酸盐培养基中,在37 ℃、氮气-二氧化碳(9∶1,V/V)厌氧罐中厌氧培养4 d,使菌种恢复活力,将活化后的菌种以5%(体积分数)接种量接种至新鲜培养基,相同条件下厌氧培养,每隔48 h传一代,传代2次后将菌液离心(1 000×g、5 min),得到菌体沉淀,用新鲜培养基重悬并调整菌体浓度为1×106CFU/mL备用。
1.3.2 Fn生长曲线的测定
参照文献[21]测定Fn生长曲线,在100 孔蜂窝板内按照200 μL/孔添加1.3.1节活化后的菌液(1×106CFU/mL),设置6个复孔,37 ℃、氮气-二氧化碳(9∶1,V/V)条件下厌氧培养(后续厌氧条件同)48 h,利用Bioscreen全自动生长曲线分析仪每隔30 min测定菌液在600 nm波长处的光密度值OD600nm,得到Fn生长曲线确定该培养条件下Fn的生长对数期。
1.3.3 苯乳酸最小抑菌质量浓度及最小杀菌质量浓度的测定
参照Kang Shimo等[22]的方法测定苯乳酸对Fn的最小抑菌质量浓度(minimum inhibitory concentration,MIC)和最小杀菌质量浓度(minimum bactericidal concentration,MBC)。在100 孔蜂窝板内按照200 μL/孔添加1.3.1节活化后的菌液(1×106CFU/mL),按照22 μL/孔分别添加不同质量浓度的苯乳酸溶液(终质量浓度为0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0 mg/mL),厌氧培养24 h,采用Bioscreen全自动生长曲线分析仪每隔2 h测定1次OD600nm,记录Fn的生长情况。在96 孔板内按照100 μL/孔添加1.3.1节活化后的菌液(1×106CFU/mL),按照11 μL/孔分别添加不同质量浓度的苯乳酸溶液(终质量浓度为0、0.3、0.4、0.5、0.7、1.0 mg/mL),厌氧培养0、24、48 h后用多功能酶标仪测定菌液OD600nm,并将48 h后测出OD600nm无明显变化的菌液均匀涂到血平板中,厌氧培养72 h,根据菌落生长的情况来确定MIC和MBC。
1.3.4 苯乳酸的抑菌作用研究
1.3.4.1 菌体形态的观察
先将无菌玻璃爬片(φ=8 mm)放入48 孔板中,按照250 μL/孔添加1.3.1节活化后的菌液(1×106CFU/mL),厌氧培养24 h后,每孔加入27.8 μL用磷酸盐缓冲液(phosphate buffered saline,PBS)(0.1 mol/L、pH 7.2,下同)溶解的苯乳酸溶液,苯乳酸终质量浓度为1/2 MIC、MIC和2 MIC,以等体积PBS做空白对照,处理2 h后吸弃溶液,添加预冷处理后的固定液,于4 ℃冰箱中放置8 h。吸弃孔板中的固定液,滴加PBS清洗,浸没爬片后静置10 min,重复3次。吸弃PBS后分别依次添加体积分数50%、70%、90%的乙醇溶液静置10 min,进行脱水处理,然后吸弃乙醇溶液,添加无水乙醇脱水(静置10 min)两次,吸弃无水乙醇,添加无水乙醇-纯叔丁醇(1∶1,V/V)溶液静置15 min,吸弃溶液加入叔丁醇静置15 min,吸弃叔丁醇后再次加入叔丁醇静置15 min,吸弃叔丁醇后进行冻干、喷金处理[23],然后将玻璃片放置于扫描电子显微镜载物台进行观察。
1.3.4.2 Fn上清液蛋白含量和pH值的测定
将1 mL 1.3.1节活化后的菌液(1×106CFU/mL)离心(1 000×g、3 min)后得到菌体。用1 mL PBS重悬菌体后离心(1 000×g、3 min)弃去上清液,此步骤进行两次,添加1 mL质量浓度为0.2、0.4、0.8、1.6、2.4 mg/mL的苯乳酸溶液,以等体积无菌水做空白对照,厌氧培养2 h后,1 000×g离心5 min,取0.5 mL上清液根据TP测定试剂盒说明书测定蛋白含量,结果以样品在595 nm处的光密度值OD595nm表示。另外,取5 mL相同处理方法得到的上清液,用PB-10酸度计在20 ℃下测定氧化还原电位(oxidation-reduction potential,ORP)和pH值。
1.3.4.3 Fn细胞膜完整性的测定
取1 mL 1.3.1节活化后的菌液(1×106CFU/mL)离心(1 000×g、3 min),加入1 mL PBS重悬再次离心(1 000×g、3 min),弃去上清液,分别添加1 mL不同质量浓度(1/2 MIC、MIC)的苯乳酸溶液,以等体积无菌水为空白对照,以等体积十六烷基三甲基溴化铵(hexadecyl trimethyl ammonium bromide,CTMAB)(能溶解革兰氏阴性菌的细胞膜)作为荧光染色的阳性对照[24],厌氧培养2 h。分别添加10 μL 1 mg/mL的PI染液,在4 ℃下染色20 min后,1 000×g离心5 min,添加1 mL PBS重悬后离心(1 000×g、5 min),弃去上清液,用200 μL PBS重悬菌体后在全自动荧光免疫分析仪观察和流式细胞仪分析荧光强度,通过Accuri C6 plus流式细胞仪计算Fn荧光阳性百分率。
1.3.4.4 Fn胞内蛋白的电泳分析
取1 mL 1.3.1节活化后的菌液(1×106CFU/mL),分别添加111 μL不同质量浓度的苯乳酸溶液(终质量浓度为0.2、0.4、0.8 mg/mL),以等体积无菌水作为空白对照,厌氧培养处理2 h后离心(3 000×g、5 min)得到菌体沉淀。按照10 mL/g添加细菌裂解液(含1%(体积分数)蛋白酶抑制剂的溶菌酶(20 kU/mL)),研磨并反复冻融3次,通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分离蛋白,采用5%(质量分数)浓缩胶和10%(质量分数)分离胶,加样量为20 μL,开始电压为80 V,30 min后调整电压为120 V直至实验结束。电泳结束后采用考马斯亮蓝染色分析Fn菌体胞内蛋白组成的变化。
1.3.4.5 Fn生物膜含量的测定
参考1.3.4.1节方法观察厌氧培养48 h的空白对照组和MIC苯乳酸(0.1 mol/L、pH 7.2 PBS溶解)处理2 h后Fn的生物膜。采用结晶紫染色法评估Fn的生物膜形成能力。取1.3.1节活化后的菌液(1×106CFU/mL),按照200 μL/孔添加至96 孔板,厌氧培养48 h后分别添加22 μL/孔苯乳酸、乳酸溶液(终质量浓度均为0.5 mg/mL),以等体积无菌水作为空白对照,厌氧培养处理2 h。吸出培养液用于测定pH值;孔内菌体用无菌PBS洗涤3次,除去松散附着的细胞,室温下干燥。每孔中添加100 μL 95%(体积分数)甲醇固定15 min后,弃去液体并风干。每孔加入100 μL 0.05%(质量分数)结晶紫染色10 min。无菌PBS冲洗3次,风干。添加100 μL/孔的体积分数33%醋酸溶液溶解10 min,在450 nm波长处测定光密度值OD450nm,以表征生物膜含量。
1.4 数据处理与分析
实验设置3个重复,实验结果以平均值±标准偏差表示。采用SPSS 26.0软件中单因素方差分析进行统计分析,采用Duncan多重比较进行显著性分析,P<0.05表示差异显著。采用Origin 2018 9.5软件作图。
2 结果与分析
2.1 Fn生长稳定期的确定
采用Bioscreen全自动生长曲线分析仪测定Fn在48 h内OD600nm变化,得到细菌的生长曲线,并确定Fn的对数生长期。如图1所示,经培养6 h后,Fn可达到生长对数期,当培养时间为27 h,菌株达到生长稳定期,因此Fn的最佳生长周期为27 h。在27 h前后选取一个时间点作为后续研究的统一判定时间,即选取24 h和48 h作为判断苯乳酸抑菌效果的时间点,测定苯乳酸对Fn生长的影响。
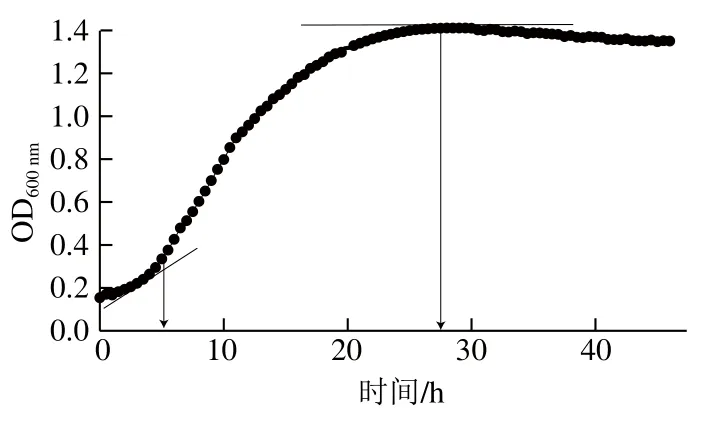
图1 Fn的生长曲线Fig. 1 Fn growth curve
2.2 苯乳酸对Fn的抑制效果
在培养基中加入不同质量浓度的苯乳酸溶液,确定Fn不再生长甚至死亡时苯乳酸的最小质量浓度。如图2A所示,随苯乳酸质量浓度的增加,Fn的生长速率减慢。在24 h厌氧培养期间,0.4 mg/mL苯乳酸即导致Fn的生长速率明显降低,0.7 mg/mL苯乳酸对Fn达到完全抑制,且0.7 mg/mL苯乳酸处理2 h就产生了抑制效果。如图2B所示,0.4 mg/mL苯乳酸处理0 h和24 h的OD600nm差异较小,苯乳酸质量浓度大于0.4 mg/mL即可在短时间内完全抑制Fn生长。加入0.5 mg/mL苯乳酸厌氧培养24 h和48 h后OD600nm差异不明显。因此,苯乳酸对Fn的MIC为0.5 mg/mL。将质量浓度0.5 mg/mL苯乳酸处理48 h后的Fn菌液涂在血平板上,厌氧培养72 h时的菌落计数结果为3.5×103CFU/mL,而质量浓度大于或等于0.7 mg/mL的苯乳酸处理组无活菌检出,此结果与图2A结果一致。因此,苯乳酸对Fn的MBC为0.7 mg/mL。

图2 苯乳酸对Fn生长的影响Fig. 2 Effect of phenyllactic acid on Fn growth
2.3 苯乳酸对Fn形态的影响
Thakur等在纳米粒子对细菌作用的研究中采用扫描电子显微镜观察到菌体损伤[25],孙明明等[26]也采用此技术观察菌体损伤。因此,为阐明苯乳酸对Fn抑制机制,本研究通过扫描电子显微镜成像技术观察菌体形态变化。
从图3A可看出,空白对照组的Fn两端为梭状,表面光滑。加入1/2 MIC苯乳酸处理后,Fn表面有少量蛋白溶出现象,部分菌体抱团、黏连,菌体表面变得粗糙和部分溶解,表面变得不光滑(图3B)。经MIC苯乳酸处理后,Fn细胞壁可能受损,细菌形态变得纤细,且表面产生大量凸起(图3C),推测为胞内物质渗出。经2 MIC苯乳酸处理后,Fn已无法维持正常菌体形态,表面粗糙不平,细胞膜和细胞壁严重损坏(图3D)。由此可推测苯乳酸破坏了细胞膜结构,导致内容物泄漏。
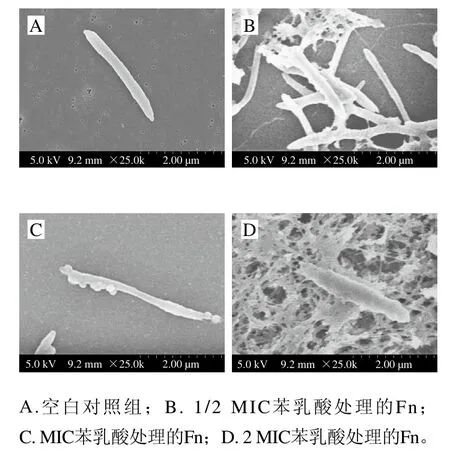
图3 苯乳酸对Fn菌体形态的影响Fig. 3 Effect of phenyllactic acid on the morphology of Fn
2.4 苯乳酸处理对Fn上清液中蛋白含量、氧化还原电位和pH值的影响
苯乳酸处理后的Fn菌体上清液中蛋白含量(OD595nm)发生变化,推断为细胞膜透过性受损、细菌内容物溶出[27],可通过OD595nm反映细胞膜的破坏程度。由图2可知,苯乳酸质量浓度大于0.4 mg/mL可明显影响Fn的生长,为探究不同质量浓度苯乳酸对细胞膜通透性的影响,采用0.2、0.4、0.8、1.6、2.4 mg/mL的苯乳酸处理Fn,测定细菌上清液中蛋白含量、ORP、pH值。
由图4A可知,与空白对照组相比,0.2、0.4 mg/mL苯乳酸处理组上清液中蛋白含量均显著增加(P<0.05)。而在更高质量浓度的苯乳酸作用下,与0.4 mg/mL组相比,上清液中蛋白含量显著减少(P<0.05),其原因可能是随苯乳酸质量浓度增加,溶液酸度升高,0.4 mg/mL苯乳酸处理组pH值为5.43±0.01,0.8 mg/mL苯乳酸处理组pH值则为4.50±0.01(图4B),已低于蛋白质的等电点,由于酸的作用,上清液中的蛋白质发生沉降而含量降低。随着苯乳酸的质量浓度增加,上清液的ORP总体呈增加趋势,即氧化性增强,培养基中杂质减少,进一步证明上清液蛋白质发生了沉降。苯乳酸质量浓度低于MIC时(0~0.4 mg/mL苯乳酸),苯乳酸处理质量浓度与上清液蛋白含量呈正相关,表明苯乳酸对Fn的抑制机制可能分为两方面,一是刺激Fn产生更多胞外分泌蛋白;二是破坏其细胞膜,使细胞内容物外泄。因此,本实验进一步分析苯乳酸对Fn细胞膜完整性的影响。

图4 苯乳酸处理Fn后上清液中蛋白含量、ORP、pH值的变化Fig. 4 Changes in protein content, oxidation-reduction potential, and pH in Fn culture supernatant after treatment with phenyllactic acid
2.5 苯乳酸对Fn细胞膜完整性的影响
荧光标记法是通过荧光探针与细胞核内的DNA结合产生特殊的荧光,荧光的数量和强度可反映被测物的含量,流式细胞仪能定量分析该荧光强度,黄云坡等[28]通过这两种方法综合评价苯乳酸对单增李斯特菌细胞膜的破坏程度,张宇婷等[29]采用该方法检测活菌数,本实验采用同样方法检测苯乳酸对Fn细胞膜的通透性及完整性的影响。
PI是一种不能通过完整细胞膜的DNA荧光探针,当细胞膜受损后PI可进入细胞并与DNA结合,在546 nm波长处发出红色荧光。空白对照组的Fn中有少量凋亡,经PI荧光探针染色后,仅出现少许红色荧光(图5A),1/2 MIC苯乳酸处理Fn 2 h后,红色荧光强度有所增加(图5B),即细胞的通透性增加;MIC苯乳酸处理Fn时,细胞膜损伤程度进一步增加,红色荧光强度明显增多,在整个检测范围内产生均匀的光斑(图5C)。同时,将经过CTMAB处理细胞膜的荧光状态作为阳性对照组(图5D),与阳性对照组相比,1/2 MIC苯乳酸处理的Fn细胞膜受损程度较小,而MIC苯乳酸处理的细胞膜损伤程度与之接近。
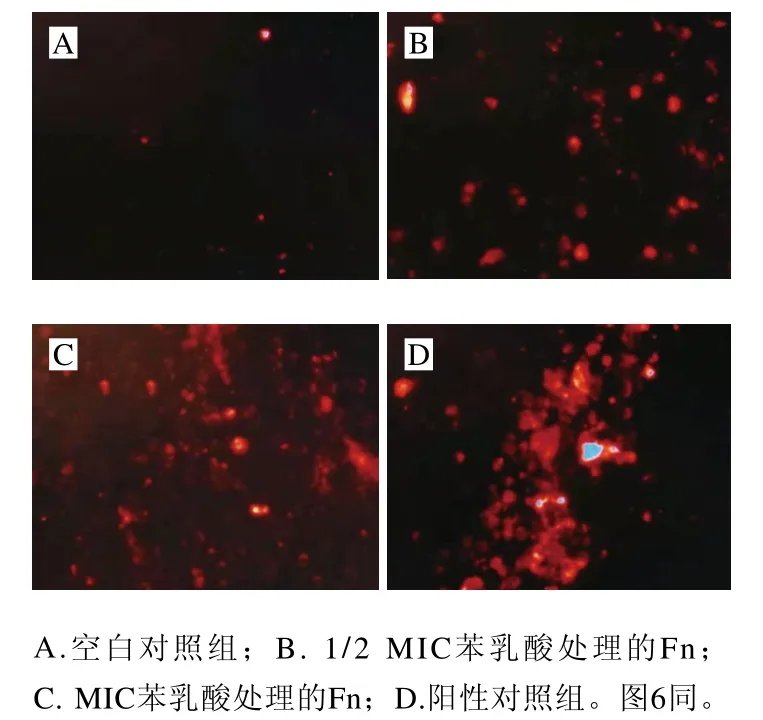
图5 荧光探针法检测苯乳酸对Fn细胞膜的破坏作用Fig. 5 Destructive effect of phenyllactic acid on the cell membrane of Fn demonstrated by fluorescent probe method
利用流式细胞仪来检验苯乳酸处理后的效果。如图6所示,空白对照组的Fn荧光阳性率为3.6%(图6A),为细菌正常代谢凋亡比例,1/2 MIC苯乳酸处理后细胞的荧光阳性率达到10.9%(图6B),MIC苯乳酸处理后的Fn的荧光阳性率达到51.6%(图6C),而阳性对照组的荧光阳性率为45.9%(图6D),该结果与全自动荧光免疫分析仪结果(图5)一致。综上所述,苯乳酸破坏了Fn细胞膜的选择透过性及完整性,细胞膜通透性提高。
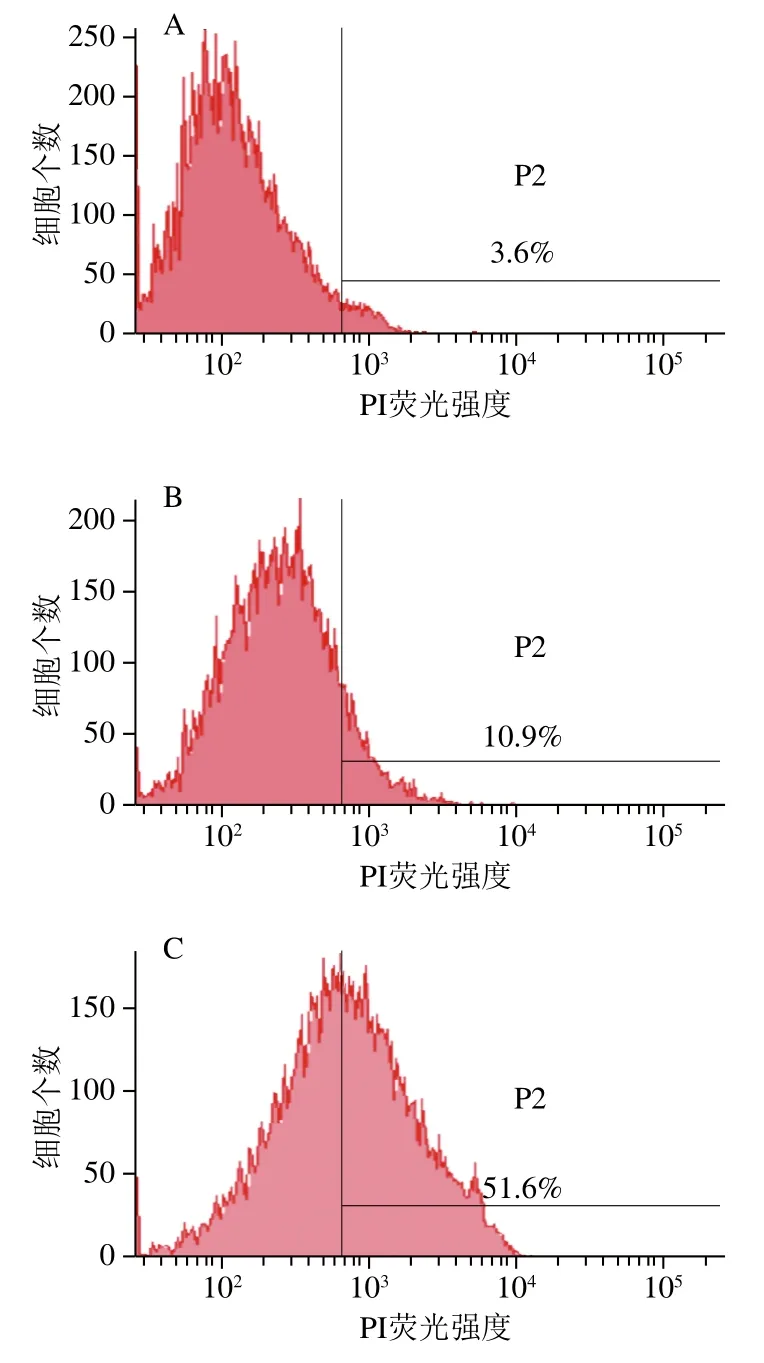

图6 流式细胞术检测苯乳酸对Fn细胞膜的影响Fig. 6 Effect of phenyllactic acid on Fn cell membrane determined by flow cytometry
2.6 苯乳酸对Fn胞内蛋白的影响
细胞膜不仅可选择性使大分子进入,也可控制胞内物质流出,检测Fn胞内蛋白的含量可反映Fn细胞膜控制物质流出的能力。可通过SDS-PAGE检测胞内蛋白分子质量及含量的变化[30],从而反映苯乳酸对Fn胞内蛋白的影响。
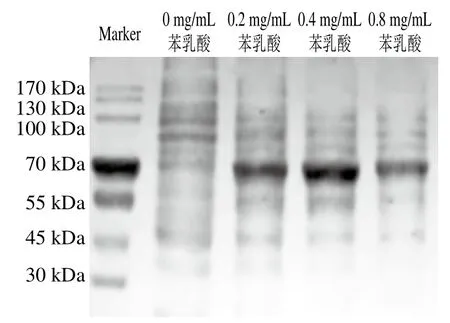
图7 Fn胞内蛋白的SDS-PAGE结果Fig. 7 Sodium dodecyl sulfate-polyacrylamide gel electrophoresis patterns of intracellular proteins from Fn
如图7所示,与空白对照组相比,经过0.2、0.4 mg/mL的苯乳酸处理后Fn中分子质量为130 kDa以上的蛋白数量减少,70 kDa左右蛋白含量增多,说明苯乳酸影响了Fn的代谢过程,改变了蛋白合成途径。0.8 mg/mL的苯乳酸使其胞内蛋白含量减少,这与之前发现的蛋白质外泄结果相一致,由于细胞膜破损严重,相对较大的蛋白分子也流出,导致细菌活性减弱,合成蛋白能力降低,蛋白含量减少。这与宁亚维等[31]探究苯乳酸对假单胞菌细胞膜影响的结果一致。由此证明苯乳酸可破坏Fn细胞膜的完整性。
2.7 苯乳酸对Fn形成生物膜的影响
以往的研究结果表明,Fn可产生大量黏多糖等物质,帮助菌体在细胞表面形成保护层[32],被归类为生物膜。生物膜通常为胞外多聚物,目前生物膜的测定公认为结晶紫法[33],该检测法价格低廉、简便且结果准确性高,可直接显示生物膜的变化[34]。本研究在由Fn形成的生物膜上加入苯乳酸,探究其对生物膜的作用。并通过扫描电子显微镜观察该膜的致密程度和菌体数量变化。
如图8A所示,经过48 h培养,空白对照组中大量Fn形成致密的生物膜,黏附在培养玻璃片(φ=8 mm)表面,Fn尖端相连,并有所缠绕,PBS清洗不易脱落;但经MIC苯乳酸处理2 h后,视野内Fn数量明显减少,且生物膜暴露出不规则孔洞,致密程度下降,菌体连接较松散,由空白对照中的缠绕形态转变为菌体之间的黏连(图8B),其胞外物质表观结构出现不规则空隙,表明苯乳酸破坏了该生物膜结构。由此可知,苯乳酸能抑制Fn的生长,进而抑制生物膜的形成,并且能使原有的生物膜脱落和破损,说明苯乳酸对Fn形成的生物膜有良好的消杀作用。
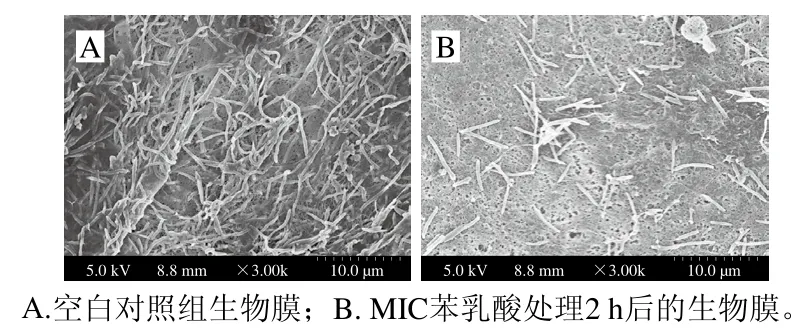
图8 苯乳酸处理对Fn生物膜形态的影响Fig. 8 Morphology of biofilm produced by Fn
苯乳酸作为有机酸的一种,使溶液呈酸性,前期研究结果显示其酸性会使蛋白沉降(体系pH值低于等电点),因此,测定相同条件和质量浓度乳酸、苯乳酸处理体系的pH值和形成生物膜含量(OD450nm),并进行对比分析。

表1 苯乳酸和乳酸对Fn形成生物膜的影响Table 1 Effect of phenyllactic acid on biofilm formation of Fn
如表1所示,与空白对照组相比,0.5 mg/mL苯乳酸处理组的生物膜含量显著降低(P<0.05)。相同质量浓度苯乳酸和乳酸处理对Fn生物膜的破坏性差异明显,0.5 mg/mL乳酸处理组的生物膜含量与空白对照组相比无显著差异(P>0.05)。0.5 mg/mL乳酸组的pH值远低于0.5 mg/mL苯乳酸组,说明苯乳酸对生物膜的破坏性来自于其本身的结构,而非由其酸性导致的。
3 结 论
苯乳酸对Fn具有良好的抑菌能力,其抑菌机制为改变细菌细胞膜的通透性,使胞内蛋白外泄;且苯乳酸降低了Fn的黏附性,对其生物膜亦具有破坏作用。因此,未来可将苯乳酸应用于调控肠道微生态及预防肠道病原菌生物膜引发疾病的功能性食品。
