α-松油醇对指状青霉抑霉唑抗性菌株Pdw03的抑制作用
2022-05-13欧阳秋丽刘洋梅陶能国
欧阳秋丽,刘洋梅,陈 悦,陶能国
(湘潭大学化工学院,湖南 湘潭 411105)
指状青霉引起的绿霉病是柑橘采后贮藏期间的主要病害,主要通过化学杀菌剂控制[1-5]。在柑橘采后商品化处理过程中,化学杀菌剂如抑霉唑等的广泛使用容易导致大量抗药性菌株的出现。有研究表明,2000—2010年的10 年间,浙江地区抗抑霉唑(imazalil-resistant,IMZ-R)菌株频率从2.1%增加到60%~84%[4]。2012年监测数据显示,江西赣州地区指状青霉的抑霉唑抗性菌系比例高达90%[5]。这些抗药菌株的出现致使原有剂量防治效果下降甚至失效,导致病害防控难度加大,同时也带来严重的食品安全问题[2-5]。研究发现,植物精油及其组分具有高活性、高安全性、不易诱导菌株产生耐药性等优点,已逐渐被应用于果蔬采后病害的防治实践[6-13]。
α-松油醇广泛存在于茶树油、松针油中,对多种细菌和真菌具有较强的抑制作用[8,14-19]。章斌等[14]测得α-松油醇对大肠杆菌(Escherichia coli)和枯草芽孢杆菌(Bacillus subtilis)的最小抑菌浓度(minimal inhibitory concentration,MIC)分别为3.9 μL/mL和1.0 μL/mL。Pinto等[15]发现α-松油醇对假丝酵母菌属(Candidaspp.)、新生隐球菌(Cryptococcus neoformans)、烟曲霉(Aspergillusfumigatus)和黄曲霉(A.flavus)有很好的抑制效果,MIC和最小杀菌浓度(minimal fungicidal concentration,MFC)的范围为0.64~1.25 μL/mL。前期研究表明,浓度分别为8.00、8.00 μL/mL和4.00 μL/mL的α-松油醇可完全抑制指状青霉(Penicillium digitatum)、意大利青霉(P. italicum)和柑橘酸腐病菌(Geotrichum citri-aurantii)的生长,并导致真菌形态发生不可逆的有害改变、膜结构紊乱和膜流动性增加[8,16-17]。尽管α-松油醇的抑菌性能已有较多报道,但其对指状青霉抑霉唑抗性菌株的抑菌机理研究较少。
麦角固醇是真菌细胞膜的重要结构物质,在维持真菌细胞膜结构完整性、流动性和细胞活力等方面起着至关重要的作用,其生物合成受到一系列基因的转录调控[1,4]。萜类物质如柠檬醛、橙花醇和芳樟醇等可显著降低多种果蔬采后病原真菌细胞膜中麦角固醇的含量,导致细胞膜功能异常[13,20-21]。固醇14-α-脱甲基酶基因(CYP51B)是真菌麦角固醇生物合成的关键基因之一,也是常见化学杀菌剂(抑霉唑和咪酰胺等)的作用靶标,该酶活性受到抑制能干扰真菌麦角固醇合成,导致细胞膜结构破损,从而引起细胞凋亡[4]。指状青霉Pdw03菌株为IMZ-R3型抑霉唑抗性菌株,因一段199bp序列插入CYP51B启动子区引起CYP51B的过度表达而产生抗药性[4]。本研究主要探讨α-松油醇对Pdw03的抑制作用及其对细胞膜结构物质麦角固醇合成的影响,以期为柑橘贮藏期间病害的可持续治理提供理论依据。
1 材料与方法
1.1 材料、菌株与试剂
抑霉唑抗性菌株指状青霉Pdw03(P. digitatumPdw03)由浙江大学李红叶教授提供,现保藏于湘潭大学生物与食品工程专业实验室,在马铃薯葡萄糖琼脂培养基上保存待用。
湘西椪柑(Citrus reticulataBlanco cv. Ponkan)果实于2019年12月21日从湖南省泸溪县张家坪村果园采摘,选择大小均一、着色均匀且无病斑果实作为后续实验材料。
α-松油醇(90%)购自美国Sigma-Aldrich公司。所有化学药品均为分析级。
1.2 仪器与设备
TDL5A台式大容量冷冻离心机 长沙英泰仪器有限公司;CoolSafe 110-4L真空冷冻干燥机 丹麦LaboGene公司;2010QP-Plus气相色谱-质谱联用仪、LC-20AT高效液相色谱(high efficiency liquid chromatography,HPLC)仪日本岛津公司;ECLIPSE TS100荧光显微镜日本NIKON公司;SPX-250B生化培养箱、MLS-3020手提式压力蒸汽无菌器 上海博迅实业有限公司;RE-2000A旋转蒸发仪 上海雅荣生化设备有限公司。
1.3 方法
1.3.1α-松油醇对Pdw03抑制作用的测定
采用琼脂稀释培养法[10]测定α-松油醇对Pdw03菌丝体生长的影响。α-松油醇终浓度分别为0(对照组)、1.00、2.00、4.00 μL/mL和8.00 μL/mL。每个培养皿中心接入1个直径为6.0 mm的菌饼,在(25±2)℃恒温培养箱培养96 h,每天固定时间测量其菌落直径,并计算其抑制率。MIC为培养2 d时完全没有生长的最低浓度,MFC为生长4 d时完全没有生长的最低浓度。对照组中加入相应体积的0.5%(体积分数)吐温-80,每一浓度进行3次重复实验。抑制率计算如公式(1)所示。

式中:dc为对照组菌落直径/mm;dt为处理组菌落直径/mm。
1.3.2α-松油醇对椪柑绿霉病发病率影响的测定
发病率测定参照OuYang Qiuli等[11]的方法。浸泡液配制:将α-松油醇均匀溶于果蜡中,最终α-松油醇的浓度为MFC和5 MFC,同时设置对照组(未添加α-松油醇)。
椪柑用自来水洗净后,在体积分数2%的NaClO溶液中浸泡2 min,用蒸馏水洗净并自然晾干。晾干后的椪柑用无菌手术刀在赤道处对称划2个伤口(3 mm×2 mm)。接种10 μL浓度为1×105个/mL的Pdw03孢子悬浮液。接种后的椪柑静置4 h后,在相应浓度的浸泡液中浸泡1 min,对照组为果蜡浸泡组。椪柑贮藏温度为(25±2)℃,相对湿度为85%~90%,每组10个果实,重复3次。每天测定椪柑发病率和病斑直径,并通风1 h。发病率计算见公式(2)。

1.3.3α-松油醇对Pdw03细胞膜完整性影响的测定
细胞膜完整性的测定参照OuYang Qiuli等[12]的方法。将Pdw03孢子在马铃薯葡萄糖肉汤培养基(potato dextrose broth,PDB)中培养48 h后,将菌丝体用无菌水洗涤3次,使用3 层纱布过滤收集菌丝体。将收集的菌丝体重悬于磷酸缓冲液(pH 7.0)中,加入终浓度为0(对照)和1/2 MIC的α-松油醇处理0、30、60 min。将处理后的菌丝体用无菌水洗涤3次后收集备用。菌丝体用质量浓度10 μg/mL碘化丙啶(propidium iodide,PI)在30 ℃下染色5 min。染色后将菌丝体用PBS洗涤两次去除残留的染料,使用荧光显微镜观察。
1.3.4α-松油醇对Pdw03麦角固醇含量影响测定
麦角固醇含量测定参照OuYang Qiuli等[13]的方法。用终浓度为0(对照)和1/2 MIC的α-松油醇处理0、30、60 min菌丝体,用真空冷冻干燥机冻干,得到干燥菌丝。取0.008 g的干燥菌丝,充分研磨后加入4 mL 25%(质量分数)NaOH溶液和8 mL无水乙醇,在85~90 ℃下水浴2 h。混合物冷却至室温后用石油醚萃取3次。将萃取液用饱和NaCl溶液洗涤3次,用旋转蒸发仪减压浓缩近干。残留物用无水乙醇溶解后用进行HPLC检测。麦角固醇含量以菌丝干质量计,单位为mg/g。
HPLC检测条件:C18柱(250 mm×4.6 mm,5 μm),柱温:30 ℃,流速:1.0 mL/min,进样体积:20 μL。流动相:纯甲醇,检测波长为282 nm。
1.3.5α-松油醇对Pdw03麦角固醇合成途径相关基因表达量的测定
收集用浓度为0(对照)和1/2 MIC的α-松油醇处理30 min的菌丝体,采用Trizol法提取总RNA,反转录成cDNA后进行荧光定量聚合酶链式反应(polymerase chain reaction,PCR)分析。荧光定量PCR程序:95 ℃预变性10 min,然后95 ℃延伸15 s循环40次,最后60 ℃延伸1 min。参照基因为actin,引物序列如下:ERG9:5’-TCTTTGTTGAGGCCGGGTTTACTTGGGGCGTTTC AACAGA-3’;ERG1:5’-ATCCCCGATAACCTGCCTC TCCCTTGACGCCTCCATTCTT-3’;ERG7:5’-GCGC TGGCGATTGGTCGATGCAGGCCCAGTTTCCGGGCT CC-3’;ERG11:5’-GCGGAATCAAGAGGGACGATGCC CTAGCACACACTTCAGA-3’;ERG24:5’-AGAGCTTC ACAGTTCCAGCCCGATGCCTCGCTGACAAATG-3’;ERG25:5’-ATCGAAAGCTTCCTACGGGGGCGCATCA ATAGGCTGAGGA-3’;ERG26:5’-ACCAGACCCCCTG CATCTATTTGGGATCCGTGCTCTAGGA-3’;ERG27:5’-TTTCGATCTGCTGCCGTCTTGCGCGCTTCGAGTTG TAAAT-3’;ERG6:5’-TCTTTGTTGAGGCCGGGTTTAC TTGGGGCGTTTCAACAGA-3’;ERG3:5’-CAGGCCAT GGCCGCAATGCCGGTGCAGGCCACGGTGGATCC-3’;ERG5:5’-TCTCGCCATTGGCGGATGCGGGCCAACA ATGGCGCCCTTG-3’;ERG4:5’-GCTGGAACCGCTA CTTCCTTAGACAAACAGGTAGGCGACG-3’;ERG2:5’-ACATCTTCGACCCGGAACACTTGGGACCGACTTT CTGCTC-3’;actin183:5’-TGCGCTGAACCGAACTGC CGTCGGGAGCCTCGAAGCGCTC-3’。用2-ΔΔCT法进行基因表达量的定量分析[22]。
1.4 数据处理与分析
所有实验均重复3次,使用Excel 2016软件处理数据,以平均值±标准差表示。采用软件SPSS 16.0进行统计分析,one-way ANOVA分析数据显著性差异(P<0.05表示差异显著)。
2 结果与分析
2.1 α-松油醇对菌株Pdw03的抑制作用
由表1可知,α-松油醇对Pdw03菌丝体的抑制作用随着浓度增加而增强。在整个培养时间内,1.00~2.00 μL/mLα-松油醇能不同程度抑制Pdw03菌丝体的生长。培养2 d和4 d时,4.00 μL/mLα-松油均能完全抑制Pdw03菌丝体生长,说明α-松油醇对Pdw03的MIC和MFC均为4.00 μL/mL。
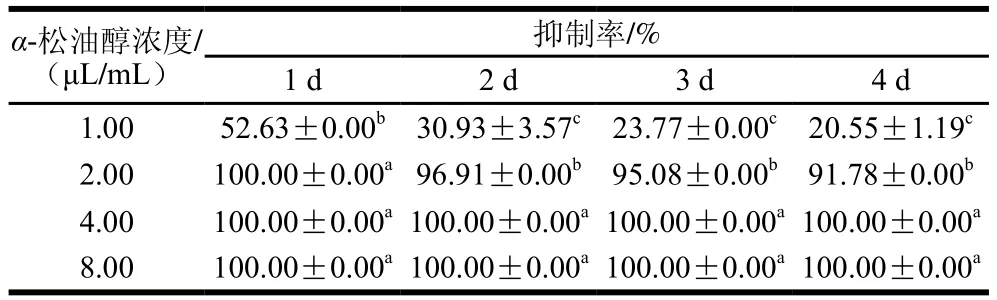
表1 α-松油醇对菌株Pdw03的抑制作用Table 1 Inhibitory effect of α-terpineol on Pdw03
2.2 α-松油醇对椪柑果实绿霉病发病率的影响
由表2、图1可知,对照组椪柑果实从接种到果实所有伤口发病需要6 d,不同浓度α-松油醇能不同程度影响椪柑果实绿霉病发生。贮藏3 d时,对照组和MFCα-松油醇处理组的椪柑果实开始发病,发病率分别为8%和3%,腐烂直径分别为(0.78±0.60)mm和(0.27±0.46)mm,此时5 MFCα-松油醇处理组未发病;贮藏4 d时,5 MFCα-松油醇处理组椪柑果实开始发病,发病率为23%,腐烂直径为(2.09±0.34)mm,而对照组果实发病率已升至73%,病斑直径达到(9.35±2.97)mm(表2、3)。发病率和发病直径的结果表明,α-松油醇处理能有效降低绿霉病的发生。

表2 α-松油醇对接种菌株Pdw03椪柑果实绿霉病发病率的影响Table 2 Effect of α-terpineol on the incidence of green mold in ponkan fruit inoculated with Pdw03

表3 α-松油醇对接种菌株Pdw03椪柑果实病斑直径的影响Table 3 Effect of α-terpineol on lesion diameter in ponkan fruit inoculated with Pdw03
2.3 α-松油醇对菌株Pdw03细胞膜完整性的影响
真菌细胞膜通透性可用PI染色的方法来判定。正常情况下,PI不能穿过完整的细胞膜,但当细胞膜完整性丧失后,PI可自由进入细胞内与DNA结合释放红色荧光,因此常用来检测细胞膜完整性[10]。α-松油醇处理对Pdw03细胞膜通透性的影响如图2所示。与对照组相比,1/2 MICα-松油醇处理30 min时可观察到大部分菌丝呈现红色荧光,表明细胞膜透性增加;随着处理时间延长到60 min,1/2 MICα-松油醇处理组菌丝出现明亮的红色荧光(图2),说明α-松油醇处理可显著破坏Pdw03细胞膜完整性。

图2 α-松油醇对菌株Pdw03细胞膜完整性的影响Fig. 2 Effect of α-terpineol on the cell membrane integrity of Pdw03
2.4 α-松油醇对菌株Pdw03麦角固醇含量的影响
麦角固醇是真菌细胞膜的重要结构物质,有助于维持真菌细胞膜结构完整性和流动性[13,20-21]。图3结果表明,随处理时间延长,对照组麦角固醇含量基本维持不变,而α-松油醇处理能急剧降低Pdw03麦角固醇含量。1/2 MICα-松油醇处理30 min后,Pdw03麦角固醇含量显著降低至对照组的40%(P<0.05),随着处理时间延长到60 min,这一下降趋势表现得更加明显。这些结果表明α-松油醇很可能通过干扰Pdw03菌株麦角固醇生物合成来降低麦角固醇含量,进而影响其细胞膜完整性。
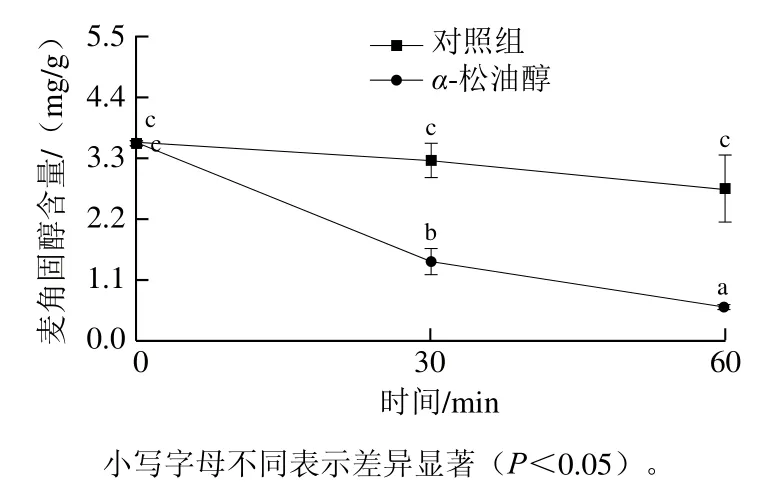
图3 α-松油醇对菌株Pdw03麦角固醇含量的影响Fig. 3 Effect of α-terpineol on the ergosterol content in Pdw03
2.5 α-松油醇对Pdw03麦角固醇合成途径相关基因表达的影响
麦角固醇生物合成是一个多基因转录调控的复杂生物学过程[13,23-24]。α-松油醇能不同程度影响Pdw03麦角固醇生物合成途径基因表达。如图4所示,1/2MICα-松油醇处理30 min后,除ERG1、ERG11、ERG26和ERG27基因表达基本未受影响外,其余基因表达均受到显著影响。其中,ERG9基因表达受到显著抑制,表明其可能为潜在作用位点;而ERG2、ERG3、ERG4、ERG5、ERG6、ERG7、ERG24和ERG25等基因表达显著增强(P<0.05)。ERG3的表达量急剧上升,其次为ERG6和ERG5,其他上调基因虽然转录水平发生显著变化,但变化幅度不如这3个基因,出现这一结果可能与真菌能通过上调麦角固醇合成途径某些基因的表达缓解麦角固醇合成抑制类药物对细胞膜的损伤有关[25-27]。
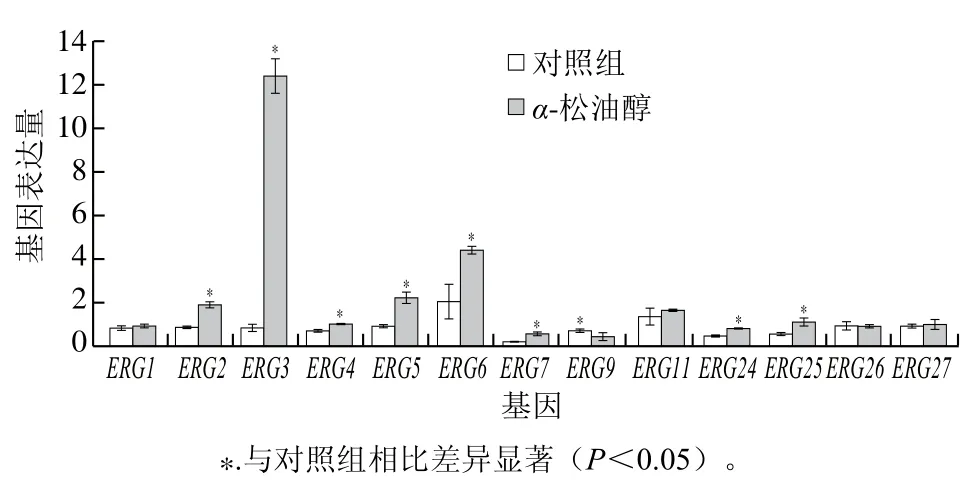
图4 α-松油醇对Pdw03麦角固醇合成途径相关基因表达的影响Fig. 4 Effect of α-terpineol on gene expression related to ergosterol synthesis pathway in Pdw03
3 讨 论
已有研究表明,α-松油醇具有显著的抑菌活性和防腐作用[8-9,14-19]。本研究结果发现4.00 μL/mL(MFC)α-松油醇能完全抑制Pdw03菌丝的生长(表1),且MFC和5 MFC浓度的α-松油醇能够有效控制绿霉病的扩展(表2、3和图1)。这一结果与Kong Qingjun等[9]在葡萄中赭曲霉(A. ochraceus)防控的研究结果相似,其发现α-松油醇能有效抑制赭曲霉的生长,并对葡萄贮藏过程中赭曲霉的生长具有显著的抑制作用。
真菌细胞膜是细胞赖以生存的重要基础[28]。有报道指出,植物精油能通过其亲脂性影响细胞膜通透性发挥抑菌作用[20,29]。前人研究发现,α-松油醇处理不仅能引起大肠杆菌细胞膜透性增加,导致β-半乳糖苷酶外流[18],而且还可以诱导赭曲霉和黄曲霉细胞膜透性增加,引起金属离子泄漏和细胞膜完整性破坏,导致代谢紊乱[9,19]。本研究也发现,2.00 μL/mL的α-松油醇处理严重地破坏了Pdw03细胞膜完整性(图2)。这一结果与本课题组前期研究结果一致,即α-松油醇可引起意大利青霉膜结构紊乱和膜流动性增加[17]。
麦角固醇是保持真菌细胞膜结构完整性的关键物质之一,参与细胞膜透性和流动性的调节[28,30-31],也是多种抗真菌药物的主要目标。防治柑橘采后绿霉病的常见化学杀菌剂(如抑霉唑和咪鲜胺)的作用靶标即为麦角固醇代谢途径,主要通过干扰麦角固醇生物合成的不同环节或直接与麦角固醇络合干扰其正常功能,从而影响病原微生物生长[21,29]。大量研究表明,植物精油及其组分如姜黄精油、柠檬醛、橙花醇和紫苏醛等也能通过干扰麦角固醇合成对细胞膜完整性产生影响,引起细胞毒害[13,20-21,25,32-34]。本研究中,α-松油醇处理能显著降低Pdw03菌株麦角固醇含量(图3),与细胞膜完整性被破坏的结果相互印证。
麦角固醇的生物合成受到ERG基因的严格调控[23-24,34]。Xu Yanqun等[21]指出,芳樟醇处理引起草莓灰霉菌的麦角固醇合成途径限速酶基因ERG1和ERG3表达下调,细胞膜中麦角固醇的含量降低,导致细胞膜完整性受损。前期研究发现,柠檬醛处理指状青霉抑霉唑敏感菌株后,ERG7基因的表达被激活,而ERG3、ERG5、ERG6和ERG11基因的表达被抑制,其中ERG11基因是导致麦角固醇含量降低的关键基因[13]。与柠檬醛不同的是,α-松油醇处理并未诱导ERG11的表达发生显著变化(图4),表明α-松油醇的作用位点可能不是ERG11,说明不同类型萜类物质对真菌麦角固醇途径的调控位点存在差别。在真菌麦角固醇代谢途径中,ERG9基因编码角鲨烯合成酶,其主要催化固醇分支途径的第一步反应,对细胞生长至关重要,当该基因被破坏时,细胞将丧失合成固醇的能力[23-24,34]。α-松油醇处理显著抑制Pdw03ERG9表达(图4),这一结果与卫梦绮[34]报道的枯茗醛能通过抑制黄曲霉ERG9基因表达下调麦角固醇含量类似,说明ERG9基因表达下调引起的麦角固醇含量降低很可能与指状青霉Pdw03菌株细胞膜完整性丧失密切相关。α-松油醇处理还诱导了多个麦角固醇合成基因的上调表达,其中ERG3、ERG5和ERG6的变化最为显著(图4)。ERG3编码C-5固醇去饱和酶,该基因一旦失活将导致麦角固醇合成不足和中间代谢产物积累[23-24]。ERG5编码的C-22固醇去饱和酶催化固醇侧链中C-22/23双键的形成,该双键在麦角固醇生物合成途径中至关重要[13],缺失该基因会导致粗糙脉孢菌和轮枝镰孢菌对酮康唑的高度敏感[24]。ERG6编码的C-24固醇甲基转移酶是麦角固醇合成代谢途径中的重要限速酶,ERG6的高表达可以有效提高细胞麦角固醇含量[24]。这些基因与其他麦角固醇合成途径基因ERG2和ERG4表达同时上调能有效增加麦角固醇含量[27]。此外,ERG7的表达能促进羊毛固醇的生成,而ERG25表达的上调有助于菌株将羊毛固醇转化为麦角固醇[26]。尽管上述基因的上调表达可部分补偿因ERG9表达受抑制对麦角固醇合成造成的不利影响,但并不能完全补偿ERG9表达下调带来的麦角固醇含量降低,随着时间延长这一现象表现的尤为明显,最终表现为麦角固醇合成途径受阻,麦角固醇含量降低,从而导致细胞膜完整性丧失和菌丝体凋亡。
