超声处理对麦醇溶蛋白/芦丁相互作用及结构特性的影响
2022-05-13薛艾莲李春翼王启明雷小娟赵吉春曾凯芳
薛艾莲,李春翼,王启明,张 驰,雷小娟,2,赵吉春,2,曾凯芳,2,明 建,2,*
(1.西南大学食品科学学院,重庆 400715;2.西南大学食品贮藏与物流研究中心,重庆 400715)
麦醇溶蛋白(gliadin,G)作为生物聚合物的一种,其因富含脯氨酸也常被称为来自小麦籽粒的脯氨酸,其为单体单链多肽,分子质量范围为28~70 kDa,其具有自组装能力[1]。将麦醇溶蛋白与其他生物聚合物络合或进行表面改性,可以调节其润湿性以改善功能特性。蛋白质的物理化学性质(如表面疏水性、游离巯基含量、Zeta电位等)可以通过与多酚形成非共价配合物或共价结合来改善[2]。酚类化合物广泛存在于水果和蔬菜中,它们具有良好的抗氧化功能,通常被加入到食品基质以改善其稳定性[3]。芦丁(rutin,R)具有优异的抗菌性和抗氧化性,对人体健康有益。芦丁在水溶液中以不溶性颗粒的形式存在。研究表明,富含脯氨酸的麦醇溶蛋白与芦丁具有强烈的相互作用,主要作用力为氢键和范德华力,芦丁与麦醇溶蛋白的结合能力大于槲皮素、异槲皮素、对香豆酸、咖啡酸以及阿魏酸与麦醇溶蛋白的结合能力[4]。
在食品加工、储存、烹饪和食用过程中,蛋白质的功能特性会影响蛋白质在食品体系的物理和化学性质,同时蛋白质的功能特性受多种因素影响,如pH值、干燥、加热、离子强度、储存条件、还原剂的存在以及物理改性[5]。在蛋白质修饰的不同物理方法中,超声处理具有操作简单、节能、环保的优势[6]。超声效果一般受压力、温度、强度和频率的影响,根据频率范围可分为高能超声波和低能超声波。高能超声波中使用的高频率(20~100 kHz)会导致空化现象,进而产生的高压(90.91 MPa)和高温(4 726.85 ℃),从而使蛋白质物理化学性质发生改变[7]。近年来,许多研究发现,超声处理对动植物蛋白质特别是大豆蛋白的起泡性、溶解性、乳化性和其他功能特性具有较大的影响[8-9]。Pan Jinfeng等[10]研究发现超声处理改变了没食子酸对鱼肌原纤维蛋白的作用方式,超声波促进了鱼肌原纤维蛋白的结构展开及其反应基团的暴露,通过触发OH·与没食子酸的作用进而产生没食子酸醌,导致了鱼肌原纤维蛋白凝胶特性的变化。目前大量的研究集中于超声改变蛋白结构及功能性质方面[8-9,11]。有关超声影响蛋白与多酚相互作用的研究相对较少。
因此,本研究通过反溶剂法制备麦醇溶蛋白-芦丁的复合物,旨在评估超声处理下麦醇溶蛋白-芦丁相互作用及其复合物功能特性的变化。旨在通过超声联合芦丁增强麦醇溶蛋白的功能特性,以拓宽麦醇溶蛋白的应用范围。
1 材料与方法
1.1 材料与试剂
麦醇溶蛋白 美国Sigma公司;芦丁 北京索莱宝科技有限公司;其他试剂均为分析纯。
1.2 仪器与设备
ZEN3690激光粒度分析仪 英国马尔文仪器公司;LGJ-10真空冷冻干燥机 北京松原华兴科技有限公司;SCIENTZ-F1500超声波分散仪 宁波新芝生物科技股份有限公司;F-2500荧光分光光度计 日本日立公司;MCR302流变仪 奥地利安东帕公司;DXR2激光拉曼光谱仪 美国Thermo Fisher公司;BX53荧光正置显微镜 日本OLYMPUS公司;Phenom Pro扫描电子显微镜(scanning electron microscope,SEM) 荷兰Phenom Pro公司;LSM800激光共聚焦显微镜 德国卡尔蔡司公司。
1.3 方法
1.3.1 醇溶蛋白-芦丁复合物的制备
采用反溶剂法制备麦醇溶蛋白-芦丁(gliadin-rutin,G-R)分散液,具体操作参考Filippidi等[12]的方法略作修改。在磁力搅拌下将0.10 g麦醇溶蛋白和0.01 g芦丁分别溶解于50 mL 10 mmol/L乙酸溶液、50 mL体积分数60%乙醇溶液中,在4 ℃下储存过夜以完全水合,然后等体积混匀(V(水相)∶V(醇相)=3∶1)。将100 mL G-R溶液逐滴加入300 mL纯水中,边加边均质(10 000 r/min、4 min)。均质完成后,将超声探头置于距离所得溶液底部1 cm的位置,分别设置超声功率为150、300、450、600 W,超声时间20 min,烧杯置于冰水浴中。经上述步骤后的样液一部分留样用作部分指标测定,另一部分于45 ℃水浴下旋转蒸发后冻干,得到固体样进行相关指标测定。在相同条件处理下,未添加芦丁的麦醇溶蛋白溶液为对照(即等体积混匀时,溶液中没有芦丁)。
1.3.2 表面疏水性测定
表面疏水性参考文献[13]的方法测定。吸取1 mL样品于离心管中,加入200 μL 1 mg/mL溴酚蓝,漩涡混匀后在8 000 r/min转速下离心10 min,将所得上清液用去离子水稀释10 倍后于595 nm波长处测定吸光度(A)。以溴酚蓝结合量表征表面疏水性,具体按公式(1)计算。

1.3.3 游离巯基含量测定
参照Wu Li等[14]的方法略作修改。在1 mL样品溶液中加入4 mL Tris-Gly缓冲液、0.05 mL Ellman试剂(含2 mmol/L 2-硝基苯甲酸和50 mmol/L乙酸钠),将混合溶液在室温下孵育20 min,然后在412 nm波长处测定吸光度。游离巯基含量按公式(2)计算。
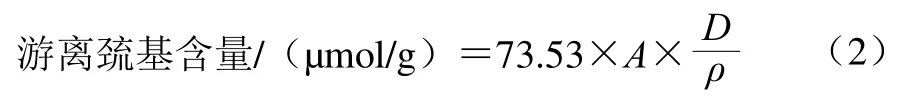
式中:A表示除去试剂空白后样品的吸光度;D表示稀释倍数;ρ表示样品中的蛋白质量浓度(mg/mL)。
1.3.4 二级结构测定
参照文献[15-16]的方法,通过拉曼光谱的酰胺I带分析蛋白质的二级结构,拉曼光谱测定条件:将冻干后的样品置于玻璃载玻片上,用激光拉曼显微镜在785 nm的激发波长下进行实验。实验参数为:显微镜物镜为20 倍,光斑尺寸为1 μm,狭缝宽度为50 μm,激光能量为15 mW,背景曝光时间为4.2 s,曝光次数为38,背景曝光次数为512,光栅为400 刻度/nm,扫描范围为500~4 000 cm-1。使用OMNIC 8.2软件进行光谱基线校正,平滑和原始数据归一化处理(以苯丙氨酸(1 003 cm-1)为内标进行归一化处理)。使用Peakfit 4.12软件进行分峰拟合,各二级结构对应的波长范围分别为:α-螺旋(1 645~1 660 cm-1)、β-折叠(16 70~1 680 cm-1)、β-转角(1 640~1 645 cm-1、1 680~1 690 cm-1)、无规卷曲(1 660~1 665 cm-1)。
1.3.5 内源荧光光谱测定
吸取1 mL处理好的样液于比色皿中,使用荧光分光光度计测定内源荧光光谱。实验条件:激发波长λex=282 nm、发射波长范围300~500 nm、电压400 V、激发狭缝与发射狭缝均为5.0 nm。
1.3.6 同步荧光光谱测定
使用荧光分光光度计测定同步荧光光谱。固定激发波长为282 nm,在250~500 nm发射波长范围内扫描样品,在25 ℃下进行同步荧光强度测定。设置波长差Δλ=15 nm和Δλ=60 nm(Δλ=最大激发波长-最大发射波长),狭缝宽度为5.0 nm,扫描速度为1 500 nm/min。
1.3.7 紫外扫描光谱测定
参考王丽颖[4]的方法略作修改。以去离子水为空白对照,依次移取3 mL处理好的样液于比色皿样品池中。采用UV-2450分光光度计测定样品在190~400 nm范围内的紫外吸收光谱。
1.3.8 SEM观察
参考Liu Rui等[17]的方法略作修改。取适量真空冷冻干燥后的麦醇溶蛋白-芦丁复合物干燥粉末样品,经喷金处理后在10 kV加速电压下扫描,观察样品的微观结构。放大倍数8 000 倍。
1.3.9 差示扫描量热法测定热特性
采用差示扫描量热仪对冻干后样品的热特性进行分析。质量为2.00 mg的样品被放置在铝锅内,并用铝盖紧密密封,以10℃/min的恒定速率从40 ℃加热到100 ℃,以空白的铝锅作为参照。利用Origin 9.0软件计算峰值温度。
1.4 数据统计及分析
每组实验3次重复,利用Origin 9.0软件处理数据与作图。使用SPSS 19.0软件对数据进行单因素方差分析,具体采用最小显著性差异法(least significant difference,LSD)进行差异显著性分析。
2 结果与分析
2.1 超声处理对G、G-R复合物表面疏水性的影响
表面疏水性可用来表征蛋白质分子表面存在的疏水基团数目[18],可用于评价蛋白质的理化和结构性质。溴酚蓝能与蛋白质中的疏水位点结合,因此可以用溴酚蓝结合量表征蛋白质的表面疏水性。如表1所示,不同超声功率条件下G-R复合物的表面疏水性均高于G,是因为酚类化合物能够诱导蛋白质的构象变化和去折叠,暴露出疏水性氨基酸[19]。随着超声功率的增加,G-R复合物的表面疏水性整体上呈现上升趋势,是因为超声波可以破坏蛋白质分子之间的氢键、静电相互作用和水合作用,使埋在分子内部的疏水基团暴露出来[20]。G-R复合物在超声处理后表面疏水性增加,芦丁的添加与超声处理可能协同促进麦醇溶蛋白的去折叠,暴露出更多的疏水基团。这一研究结果与Yang Xue等[21]的研究结果一致。超声功率为450 W时,G的表面疏水性有所下降,一方面可能是因为疏水性驱动蛋白质聚集,使暴露的疏水基团被包裹在蛋白质中[19];另一方面可能是因为高功率的超声诱导蛋白质发生变性,导致蛋白聚集体的形成,从而降低了表面疏水性。超声功率达到600 W时,G的表面疏水性呈现上升趋势,但无显著性变化。过高的超声功率产生的空化和机械效应促使疏水性基团进一步暴露[20]。总的来说,表面疏水性的增加可以通过湍流、剪切力和微流化效应来解释,这些效应是由超声过程中不同的空化水平引起的,这导致蛋白质结构的变化,暴露了分子内部最初的疏水基团和区域。

表1 超声处理后G、G-R复合物的表面疏水性与游离巯基含量Table 1 Surface hydrophobicity and free sulfhydryl content of gliadin and its complex with rutin after ultrasonic treatment
2.2 超声处理对G、G-R复合物游离巯基含量的影响
游离巯基是影响蛋白质性能的重要活性基团。如表1所示,与芦丁复合后,G的游离巯基含量提高,可能归因于芦丁作为抗氧化剂具有保护作用。与未超声相比,在150~600 W下超声后的G游离巯基含量下降,可能是因为超声波可以产生OH·,它可以促进蛋白质二硫键的形成,从而加剧了游离巯基的损失[10]。在实验的4种超声功率下,超声功率为450 W时G的游离巯基含量最高,而研究发现,超声可以降低蛋白质的粒径,使更多的内部巯基暴露在分子表面[22],因此G的游离巯基含量升高可能与超声导致的粒径降低有关。较低功率(150、300 W)的超声处理对G-R的游离巯基含量无显著影响。此外,较高功率(450 W)超声使得芦丁对·OH的清除能力增强,从而减少游离巯基的损失,因此450 W处理组的游离巯基含量高于300 W处理组。以上结果表明超声处理对G及G-R中游离巯基的作用受超声功率的影响。
2.3 超声处理对G、G-R复合物二级结构含量的影响
α-螺旋主要是由羰基氧(C=O)和亚氨基氢(—NH—)之间的分子内氢键稳定的;β-折叠是由多肽链间的氢键稳定的;β-转角结构是伸展的肽链形成180°的U型回折;无规卷曲则为未折叠的构象,其与蛋白质的柔韧性有关[23]。因此,二级结构的变化容易受到氢键的影响。之前的研究表明无规卷曲作为蛋白质中存在的一种灵活的开放结构,在蛋白质和表没食子儿茶素没食子酸酯的结合过程中发挥了重要作用[24]。如图1所示,未经超声处理G的二级结构相对含量分别为:α-螺旋38.86%、β-折叠25.49%、β-转角20.22%、无规卷曲15.43%;与G相比,G-R复合物的α-螺旋、β-折叠、β-转角、无规卷曲相对含量分别下降13.77%、3.64%、-22.23%、4.82%。如图1A所示,超声处理后G的β-折叠、β-转角与无规卷曲相对含量上升,α-螺旋相对含量下降。如图1B所示,G-R复合物在超声条件下α-螺旋、无规卷曲相对含量增加,β-转角相对含量减少,β-折叠在超声功率低于600 W时,含量减少,功率达到600 W时,其含量增加。这一现象是由于在超声过程中产生的强烈的剪切、湍流和空化力,破坏了局部氨基酸序列和分子不同部分之间的相互作用,促进了蛋白质分子的结构转变[25]。

图1 不同超声条件下G和G-R复合物的二级结构相对含量Fig. 1 Relative content of secondary structures of gliadin and its rutin complex under different ultrasonic conditions
2.4 超声处理对G、G-R复合物内源荧光光谱的影响
内源荧光光谱技术是一种通过记录从激发态到基态的分子跃迁来分析配体和蛋白质之间络合作用的分析方法。在蛋白质的内部存在色氨酸,当激发波长为280 nm时,色氨酸被激发产生荧光,荧光强度减弱,说明蛋白内部暴露的色氨酸残基减少,蛋白发生了荧光猝灭[26]。如图2所示,所有样品的最大荧光发射波长(λmax)均在340 nm波长附近被观察到。芦丁诱导的麦醇溶蛋白结构变化主要是由非共价力引起的,例如芦丁芳香环与芳香氨基酸残基之间的疏水相互作用等[27]。麦醇溶蛋白中加入芦丁后发生了明显的荧光猝灭现象,可能是芦丁与麦醇溶蛋白发生相互作用改变了蛋白的空间构象,使色氨酸残基周围环境的疏水性增强,色氨酸可能处于更加包埋的状态。超声处理后G、G-R复合物的色氨酸荧光强度均明显降低,可能是超声波促进了分子结构的展开并破坏了疏水相互作用,从而将色氨酸残基转移到更疏水的环境中。当超声功率为600 W时,G、G-R复合物在最大荧光发射波长处的荧光强度较450 W时有所增加,可能是超声作用使得色氨酸残基暴露,破坏了蛋白质分子相互作用[28]。随着超声功率的增加,样品的波长红移可能是由于蛋白质-配体相互作用使色氨酸残基暴露在亲水环境中,色氨酸残基离蛋白分子表面更近。

图2 不同超声条件下G和G-R复合物的内源荧光光谱Fig. 2 Fluorescence spectra of gliadin and rutin under different ultrasonic conditions
2.5 超声处理对G、G-R复合物同步荧光光谱的影响
同步荧光光谱技术用于研究配体对蛋白质构象的影响时,它可以通过最大发射波长和此处的荧光强度的变化,提供氨基酸残基周围环境变化的信息[26]。氨基酸残基周围环境的极性可能影响该氨基酸残基的最大发射峰位置。如图3所示,加入芦丁后蛋白质荧光强度均降低,表明酪氨酸和色氨酸均参与了芦丁与麦醇溶蛋白间的相互作用。色氨酸残基(Δλ=60 nm)的荧光强度比酪氨酸残基(Δλ=15 nm)的荧光强度弱,即色氨酸残基对固有荧光的猝灭贡献更大。当超声功率从0 W增加到150 W时,G的内源荧光光谱发生较大的蓝移(284.5 nm→282.5 nm),表明超声处理使色氨酸残基周围环境的疏水性增强,极性减小,色氨酸可能处于较少暴露的状态。经超声处理后G-R的最大发射波长均未发生明显的变化,这一现象表明,经超声处理后,在芦丁与氨基酸残基结合的过程中,酪氨酸和色氨酸残基周围环境的极性保持不变。

图3 不同超声条件下G和G-R复合物的同步荧光光谱Fig. 3 Synchronous fluorescence spectra of gliadin and its complex with rutin under different ultrasonic conditions
2.6 超声处理对G、G-R复合物紫外扫描光谱的影响
紫外光谱可以反映相互作用后的蛋白结构变化,主要是色氨酸和酪氨酸残基所处的微环境变化。苯丙氨酸(Phe)在278 nm波长处的紫外吸收强度主要受酪氨酸和色氨酸残基周围微环境变化的影响[29]。如图4所示,与R复合后,G-R的紫外吸收强度增加,278 nm处的吸收峰左移(蓝移),表明芦丁的加入引起了蛋白构象变化,氨基酸残基的微环境发生变化。随着超声功率的增大,G-R的紫外吸收强度呈现先升高后降低的趋势。紫外吸收强度的增加可能是由于超声空化效应破坏了相邻蛋白质分子间的相互作用,酪氨酸和色氨酸残基所处的微环境发生变化,引起了紫外吸收强度的变化[30-31]。当超声功率为300 W和450 W时,G和G-R的紫外吸收强度均高于其他超声功率组的样品。因此,适当的超声功率处理有利于麦醇溶蛋白分子结构的展开,暴露出更多苯丙氨酸残基,使得紫外吸收强度增加。

图4 不同超声条件下G和G-R复合物的紫外扫描光谱Fig. 4 UV-Vis spectra of gliadin and its rutin complex under different ultrasonic conditions
2.7 超声处理对G、G-R复合物微观结构的影响
如图5所示,未经超声处理的G呈现出许多不规则的片状结构、小间隙和大聚集体,表明麦醇溶蛋白不稳定,其往往通过疏水作用和氢键形成复杂结构[32]。经超声处理后,G以致密有序的结构存在,空隙增多,这可能是由于超声处理引起了微射流、剪切力、冲击波和湍流,破坏了多肽链中氢键和范德华力相互作用以及蛋白质分子之间的交联,引起了麦醇溶蛋白的膨胀和其空间构象、二级结构的其他变化[32-33]。G-R复合物的孔径较G变得小而均匀,并且样品的纹理更加松散。所有样品经超声处理后均呈现均匀松散的蜂窝状结构。本文研究与Yang Xue等[21]的研究结果相似,即适当的超声处理会使大米蛋白质的组织结构变得松散。

图5 不同超声条件下G和G-R复合物的SEM图Fig. 5 Scanning electron microscopic images of gliadin and its rutin complex after ultrasonic treatments
2.8 超声处理对G、G-R复合物热稳定性的影响
热变性温度与热稳定性密切相关。如图6所示,未经超声处理时,G-R的热变性温度高于G,表明加入R后,G-R复合物的热稳定性更好。经超声处理后,G与G-R的热变性温度均升高,表明超声处理可以提高G与G-R复合物的热稳定性。这与Qu Wenjuan等[34]的研究结果一致,其研究发现超声处理可以使菜籽分离蛋白与葡聚糖共轭物的二级结构变得更加稳定,从而改善共轭物的热稳定性。此外,研究表明超声波可以提供极瞬时的高温和高压,进一步加速肽键运动,增加多酚与蛋白质氨基的碰撞频率,增强多酚与蛋白质的相互作用[35]。因此经超声处理后,当超声功率为150、300 W和450 W时,G-R复合物的热变性温度均高于G。

图6 不同超声条件下G和G-R复合物的差示扫描量热图Fig. 6 Differential scanning calorimetry thermograms of gliadin and its rutin complex under different ultrasonic conditions
3 结 论
超声处理能对麦醇溶蛋白以及蛋白与芦丁的复合物结构产生影响。超声处理后,G-R复合物的表面疏水性均高于G。加入芦丁后,G-R的游离巯基含量增加,当超声功率为450 W时,G和G-R的游离巯基含量均大于其他超声功率组的样品。超声处理还能影响G和G-R的二级结构含量。内源荧光光谱结果表明,超声处理后G、G-R复合物的色氨酸荧光强度均明显降低。经超声处理后,在芦丁与氨基酸残基结合的过程中,酪氨酸和色氨酸残基周围环境的极性保持不变。此外,SEM与差示扫描量热分析发现,超声处理可以改变G-R的微观结构,促进疏松多孔结构的出现,还可以提高复合物的热稳定性。综上,超声波对麦醇溶蛋白与芦丁的相互作用有显著影响,该结论为揭示麦醇溶蛋白-芦丁的相互作用机理提供了理论依据,对开拓麦醇溶蛋白的市场潜力、提高麦醇溶蛋白的应用前景具有积极意义。
