琯溪蜜柚柚皮苷纯化鉴定及其对胰脂肪酶的抑制作用
2022-05-13肖文熙欧丽明上官宇晨杜希萍李利君
晏 幸,肖文熙,欧丽明,上官宇晨,杜希萍,3,4,李利君,3,4,胡 阳,3,4,倪 辉,3,4,*
(1.集美大学海洋食品与生物工程学院,福建 厦门 361021;2.集美大学港口与海岸工程学院,福建 厦门 361021;3.福建省食品微生物与酶工程重点实验室,福建 厦门 361021;4.厦门市食品生物工程技术研究中心,福建 厦门 361021)
肥胖是一种影响人们健康的全球性慢性代谢性疾病[1];会诱发心血管疾病、糖尿病、高血压、代谢综合征等慢性代谢性疾病[2]。胰脂肪酶(EC 3.1.1.3)是人体脂质消化的关键酶,抑制其活性可以有效地减少脂质吸收,从而预防及降低肥胖症状[3]。奥利司他等一些胰脂肪酶抑制剂已经被开发出来,但其会引起严重的胃肠道副作用[4]。
水果含有丰富的胰脂肪酶抑制剂,且具有毒性低、结构多样等特点[5-6]。其中,黄酮是水果中主要活性成分[7]。从石榴、草莓、葡萄等水果中提取到的多种黄酮物质显示出对胰脂肪酶良好的抑制作用[8-11],这些结果说明水果黄酮是胰脂肪酶抑制剂的来源。
琯溪蜜柚是一种特色大宗的柑橘类水果,仅福建省平和县年产量就超过170万 t[12]。琯溪蜜柚含有丰富的黄酮物质[13],但是其黄酮抑制胰脂肪酶的研究尚不够深入。本实验以琯溪蜜柚柚皮为原料,利用Sephadex LH-20葡聚糖凝胶柱分离纯化柚皮黄酮;利用液相色谱-质谱联用仪及红外光谱技术对分离纯化组分进行鉴定分析;通过酶抑制动力学和分子对接技术探究纯化组分对胰脂肪酶的抑制特征,为利用琯溪蜜柚黄酮开发新型安全的胰脂肪酶抑制剂提供理论依据。
1 材料与方法
1.1 材料与试剂
琯溪蜜柚购于福建省漳州市平和县。
无水乙醇(分析纯) 上海沃凯生物技术有限公司;柚皮苷 上海源叶生物科技有限公司;甲醇(色谱级)、乙腈(色谱级)、胰脂肪酶(来源于猪胰腺,30 units/mg)、奥利司他、4-硝基苯基丁酸脂 美国Sigma公司;对硝基苯酚(p-nitrophenol,PNP)、三羟甲基氨基甲烷、3-吗啉丙磺酸、二甲基亚砜(dimethyl sulfoxide,DMSO)、无水氯化钙 国药集团化学试剂有限公司。
1.2 仪器与设备
JP-500C型高速粉碎机 永康市久品工贸有限公司;KQ5200DE型超声波清洗器 昆山市超声仪器有限公司;RE-52AA型旋转蒸发仪 上海亚荣生化仪器厂;SHB-III型循环水式多用真空泵 郑州长城科工贸有限公司;常压层析柱(16 nm×60 nm)、BT1-100E型恒流泵上海琪特分析仪器有限公司;SBS-100N自动部分收集器上海沪西分析仪器厂有限公司;UV-8000紫外分光光度计上海元析仪器有限公司;UliMate 3000高效液相色谱仪、TQU04549质谱仪、NICOLET IS50傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)仪美国赛默飞世尔科技有限公司;Epoch 2T型酶标仪美国伯腾仪器有限公司产品;QL-901振荡器 海门市其林贝尔仪器制造有限公司。
1.3 方法
1.3.1 琯溪蜜柚黄酮的分离纯化
将新鲜柚皮清洗干净后,剪成1 cm2的小块,晒干至恒质量,粉碎,过60目筛制成柚皮粉。精确称取1.00 g柚皮粉,以70%乙醇(体积分数,下同)为提取溶剂,在液料比30∶1、超声温度30 ℃、超声功率200 W的条件下超声提取50 min,趁热过滤,经真空减压浓缩、冷冻干燥后得到黄酮粗提物,得率为10.689%。精确称取0.20 g冷冻干燥后的黄酮粗提物,溶于2 mL 15%乙醇后过0.45 μm的微孔滤膜过滤后上样于Sephadex LH-20层析柱。其中,Sephadex LH-20层析柱为自装柱,精确称取40 g Sephadex LH-20羟丙基葡聚糖凝胶,95%乙醇浸泡24 h使其充分溶胀。以湿法上柱,用15%乙醇洗脱液充满整个柱子,用4 倍柱体积的15%乙醇洗脱使柱子达到平衡效果。黄酮成分洗脱溶剂为15%乙醇,洗脱液流速0.4 mL/min,逐管收集洗脱液(8 min/管),在283 nm波长处测定吸光度并绘制洗脱曲线,收集合并相同组分,浓缩、冻干后测得柚皮苷得率为4.132%。
1.3.2 纯化组分的鉴定
参照胡阳等[14]的方法进行液相色谱分析,参照Yang Yuanfan等[15]的方法进行质谱鉴定,参照周浓等[16]的方法于4 000~400 cm-1波数范围内测定红外光谱。
1.3.3 纯化组分对胰脂肪酶抑制率的测定
参照Du Xiping等[17]的方法稍做修改。取170 μL的Buffer A、6 μL的胰脂肪酶溶液和20 μL不同质量浓度(0.2、0.4、0.6、0.8、1.0、1.2、1.4、2.5、5.0、10.0 μg/mL)的柚皮苷溶液于96 孔板中,在37 ℃的恒温振荡器中温育15 min后,加入4 μL 6 mmol/L底物4-硝基苯基丁酸酯(4-nitrophenyl butyrate,p-NPB),再次放入37 ℃恒温振荡器中温育15 min后,在405 nm波长下测定其吸光度。根据测定得到的标准曲线(Y=0.002 8X+0.007 8,R2=0.999 2)计算产物PNP的质量浓度。在实验过程中,采用奥利司他(质量浓度为0.5、1.0、2.0、2.5、3.0、3.5、4.0、4.5、5.0、7.5、10.0、12.5 μg/mL)作为阳性对照。每个实验重复3次,胰脂肪酶抑制率计算如式(1)所示。
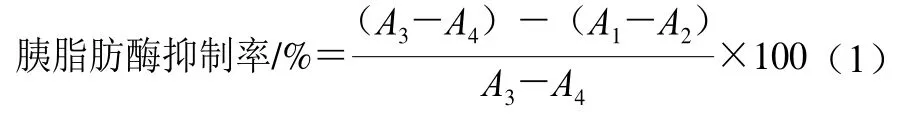
式中:A1为胰脂肪酶与样品混合物的吸光度;A2为加样品不加胰脂肪酶(PBS溶液替代)混合物的吸光度;A3为加胰脂肪酶不加样品混合物(PBS溶液替代)的吸光度;A4为不加胰脂肪酶和样品混合物(PBS溶液替代)的吸光度。
Buffer A溶液配制:称取6.05 g三羟甲基氨基甲烷,溶于450 mL超纯水中,用盐酸缓慢滴定至pH值为7.0,再加入2.775 g的无水氯化钙并使其充分溶解,待溶液冷却至室温后,定容至500 mL备用。
Buffer B溶液配制:称取1.05 g 3-吗啉丙磺酸,溶于450 mL蒸馏水,再加入100 μL 0.5 mol/L乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)的NaOH溶液,用盐酸调节至pH值为6.8,待冷却至室温后,定容至500 mL。
底物p-NPB溶液配制:称取12.55 mgp-NPB,溶于10 mL DMSO溶液,配制成浓度为6 mmol/L的p-NPB溶液。
胰脂肪酶液配制:称取20 mg胰脂肪酶,加入6 mL Buffer B缓冲液溶解,配制成浓度为100 U/mL的酶溶液。
1.3.4 纯化组分的胰脂肪酶抑制动力学测定
纯化组分的胰脂肪酶抑制动力学测定参照Moreno-Gordova等[18]的方法。取170 μL的Buffer A、20 μL不同质量浓度(0、0.6、0.8、1.0 μg/mL)柚皮苷和6 μL不同浓度胰脂肪酶(0、30、40、50、60 U/mL)于96 孔板中,在37 ℃恒温振荡器中温育15 min后,加入4 μL底物p-NPB(6 mmol/L),再次放入37 ℃的恒温振荡器中温育15 min后取出,在37 ℃下测定405 nm波长处的吸光度,确定反应速度。以不添加柚皮苷为对照组,添加不同质量浓度柚皮苷为实验组,每个实验重复3次,以胰脂肪酶溶液浓度为横坐标,酶促反应初速度为纵坐标作图,以所得线性拟合曲线是否通过坐标原点为判断依据,判断胰脂肪酶的抑制作用。根据上述的操作步骤,固定胰脂肪酶浓度为50 U/mL,改变底物p-NPB浓度(0、2、4、6、8 mmol/L),分别测定不同浓度柚皮苷(0、0.6、0.8、1.0 μg/mL)的酶促反应速率。每个实验重复3次,以p-NPB底物浓度的倒数为横坐标,反应速率的倒数为纵坐标绘制Lineweaver-Burk双倒数曲线,获得米氏常数和酶促反应的最大速率,根据拟合得到的直线与坐标轴交点位置判断胰脂肪酶的抑制类型。以奥利司他为阳性对照,方法同上,测定奥利司他的胰脂肪酶抑制动力学。以双倒数曲线的斜率(k)为纵坐标,抑制剂质量浓度为横坐标,进行二次作图绘制可得抑制常数Ki。
竞争性抑制剂的抑制常数按照式(2)进行计算。
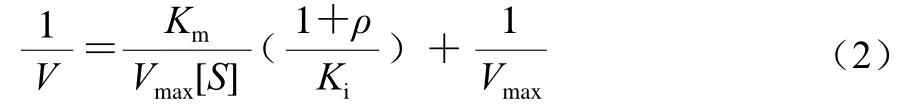
式中:1/[S]为p-NPB底物浓度的倒数/(L/mmol);1/V为反应速率的倒数/(L·min/μmol);Km为米氏常数/(mmol/L);Vmax为酶促反应的最大速率/(μmol/(L·min));ρ为抑制剂质量浓度/(μg/mL)。
非竞争性抑制剂的抑制常数可以按照式(3)进行计算。

Lineweaver-Burk双倒数曲线的斜率k计算见公式(4)。

1.3.5 纯化组分与胰脂肪酶的分子对接研究
通过Discovery Studio 2019、Auto Dock 4.2等分子对接软件进行分子对接。其中,胰脂肪酶(蛋白质结构数据库ID:1GPL)的晶体结构是从蛋白质晶体结构数据库(http://www.pdb.org/)获得的,底物p-NPB和抑制剂的结构均从NCBI数据库(https://www.ncbi.nlm.nih.gov/)获得。对接前分别对受体蛋白和配体进行删除水分子、加氢等处理,用Auto Dock 4.2软件对配体和蛋白晶体进行对接,用Discovery Studio 2019软件显示对接结果。
1.4 数据统计与分析
所有实验均重复3次,采用Microsoft Office Excel 2010软件对实验数据计算平均值、标准差,并制图。
2 结果与分析
2.1 黄酮组分的分离纯化及鉴定结果
相关研究表明,植物中普遍含有一定量的黄酮物质,甘蔗皮中黄酮含量为9.83 mg/g[19],山楂中黄酮含量为22.68 mg/g[20],琯溪蜜柚黄酮含量高达70. 69 mg/g[13]。与其他水果相比,琯溪蜜柚的黄酮含量相对较高。本研究采用Sephadex LH-20羟丙基葡聚糖柱层析对琯溪蜜柚柚皮黄酮粗提物进行分离纯化,洗脱收集得到两个组分(图1A),其中第一个组分(5~50管)含有多个没有分开的小峰,第二个组分(80~110管)峰型单一,峰面积占所有组分的50%以上,为主要黄酮成分。组分I、II的液相色谱分析结果如图1B所示,其中组分I出峰多、峰型杂,说明组分复杂。组分II只有一个峰,并且峰型好,说明是单一物质;经过与柚皮苷标准品比对,发现两者具有相同的保留时间,初步鉴定为柚皮苷。将组分II进行质谱分析,可知组分II的准分子离子峰[M+Na]+为603.00,与柚皮苷标准品的准分子离子峰一致(图1C),进一步显示组分II是柚皮苷。FTIR分析显示,组分II在3 343.29 cm-1处吸收峰为—OH的伸缩振动峰,2 932.67 cm-1处吸收峰为芳香环的C—H的伸缩振动峰,1 654.53 cm-1处吸收峰为C=O的伸缩振动峰,1 460.27 cm-1处吸收峰为苯环的伸缩振动峰,1 159.35 cm-1处吸收峰为C—O的伸缩振动峰,861.30 cm-1处吸收峰为=C—H的伸缩振动峰(图1D),这些结果与马娟娟[21]测定柚皮苷的FTIR吸收峰的振动频率相似。综上,通过保留时间、质谱和FTIR分析可得出,分离得到的组分II为柚皮苷。这一结果与张九凯[22]、田静[23]以及刘佳[24]等发现化州柚、梅州沙田柚、瓯柑和胡柚果实中含有一定含量的柚皮苷。相关研究表明,柚皮苷是一种广泛存在于柑橘水果中安全性很高的黄酮类物质,鲜有报道显示其有明显的副作用[25];因此,与奥利司他等化学合成胰脂肪酶抑制剂容易产生肠道紧迫症、胀气和腹痛等不良反应相比,本研究从琯溪蜜柚柚皮中分离纯化得到的柚皮苷具有安全性高的优点。
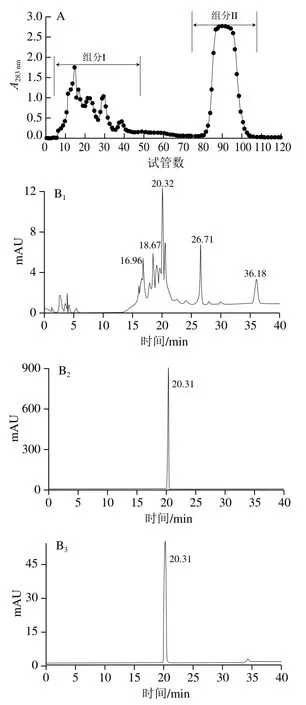

图1 琯溪蜜柚黄酮物质的葡聚糖凝胶柱层析分离(A)、液相色谱(B)、质谱(C)和FTIR(D)图Fig. 1 Separation of flavonoids from Guanxi honey pomelo by Sephadex column chromatography (A), and their analysis by liquid chromatography (B),mass spectrometry (C) and infrared spectroscopy (D)
2.2 纯化的黄酮组分对胰脂肪酶的半抑制浓度
在酶抑制剂研究中,常用半抑制浓度(halfinhibitory concentration,IC50)值(抑制酶活性50%时所需的测试样品质量浓度)评价抑制强度[15];IC50值越低,意味着抑制剂对酶活性抑制能力越强。柚皮苷对胰脂肪酶的抑制作用如图2A所示,柚皮苷随着其质量浓度(0~1.4 μg/mL)的增加,对胰脂肪酶抑制作用不断增强,抑制率与质量浓度呈现线性关系;在柚皮苷质量浓度高于1.4 μg/mL时,其抑制效果趋于平缓。根据实验数据,在线性范围内(0.4~1.5 μg/mL)进行线性拟合得到方程为Y=48.663X+1.619 7,R2=0.993 2,计算柚皮苷IC50为0.99 μg/mL。阳性对照奥利司他在线性范围内(2.0~5.0 μg/mL)拟合得到方程为Y=14.758X-8.287,R2=0.992 3,计算IC50值为3.95 μg/mL(图2B)。这说明柚皮苷对胰脂肪酶的抑制效果明显强于阳性对照奥利司他对胰脂肪酶的抑制效果。此外,柚皮苷的IC50值远远低于相关文献报道水果中提取的芦丁[26]、原花青素[27]、花色素-3-葡萄糖[28]等对胰脂肪酶的IC50值,表明从琯溪蜜柚中分离纯化得到的黄酮(柚皮苷)具有很强的胰脂肪酶抑制效果。

图2 柚皮苷(A)和奥利司他(B)对胰脂肪酶的抑制作用Fig. 2 Inhibition of naringin (A) and orlistat (B) on pancreatic lipase
2.3 纯化组分的胰脂肪酶抑制动力学特征
抑制剂对酶的抑制类型分为不可逆抑制和可逆抑制两种[27]。不同抑制剂浓度下的酶促反应速度曲线不通过坐标原点为不可逆抑制类型;不同抑制剂浓度下的酶促反应速率曲线均通过坐标原点则为可逆抑制类型[29]。而可逆抑制类型又可根据动力学特征分为竞争性抑制、非竞争性抑制和混合性抑制[30]。绘制Lineweaver-Burk图,对照组和实验组的直线相交于纵轴为竞争性抑制,直线相交于横轴为非竞争性抑制,直线相交于象限内为混合性抑制[31]。相关研究表明,甜橙皮提取物对胰脂肪酶抑制为非竞争性抑制[32],黑苦莓黄酮提取物对胰脂肪酶表现为混合性抑制[33]。如图3A所示,不同浓度的柚皮苷在不同胰脂肪酶质量浓度下反应速率的回归曲线均通过原点,表明柚皮苷对胰脂肪酶的抑制是可逆的。如图3B所示,1/V和1/[S]的回归模型是一组交于横轴的直线,表明柚皮苷对胰脂肪酶的抑制作用类型是可逆非竞争性抑制。该结果与香水莲花提取物[34]、霜桑叶提取物[35]、金银花提取物花青素[36]等对胰脂肪酶的抑制类型相似。相关文献报道非竞争型抑制剂的抑制程度取决于抑制剂的浓度,但底物浓度增加并不能降低抑制剂对酶的抑制程度;而竞争性抑制易受到底物浓度的影响,高浓度底物将减小抑制作用,甚至完全消除抑制效果[37]。本研究表明琯溪蜜柚黄酮提取物对胰脂肪酶是典型的非竞争抑制类型,因此,其抑制作用不会随着食物中脂肪的浓度增加而减弱,该特性比竞争型抑制剂更有利于控制餐后血脂的增高。
Ki是反映酶和抑制剂复合物的解离难易程度的重要指标,其数值越小,说明抑制剂与酶结合越紧密,酶与抑制剂越难分离,抑制作用越强。霍世欣等[38]发现荷叶黄酮化合物对胰脂肪酶抑制类型为非竞争性抑制,Ki=42.2 mg/mL;任秀娟等[39]发现葡萄籽中提取物对胰脂肪酶的抑制类型为非竞争性抑制,Ki=0.94 mg/mL。根据图3C、D的直线方程可计算出,柚皮苷对胰脂肪酶的抑制常数Ki为0.58 μg/mL;阳性对照奥利司他对胰脂肪酶的抑制常数Ki为6.63 μg/mL。柚皮苷的抑制常数小于阳性对照奥利司他的抑制常数,说明柚皮苷对胰脂肪酶的抑制作用强于阳性对照奥利司他。此外,柚皮苷抑制常数小于霍世欣[38]和任秀娟[39]等测定的荷叶和葡萄籽黄酮对胰脂肪酶的Ki值,表明柚皮苷和胰脂肪酶结合紧密,因此抑制效果强。
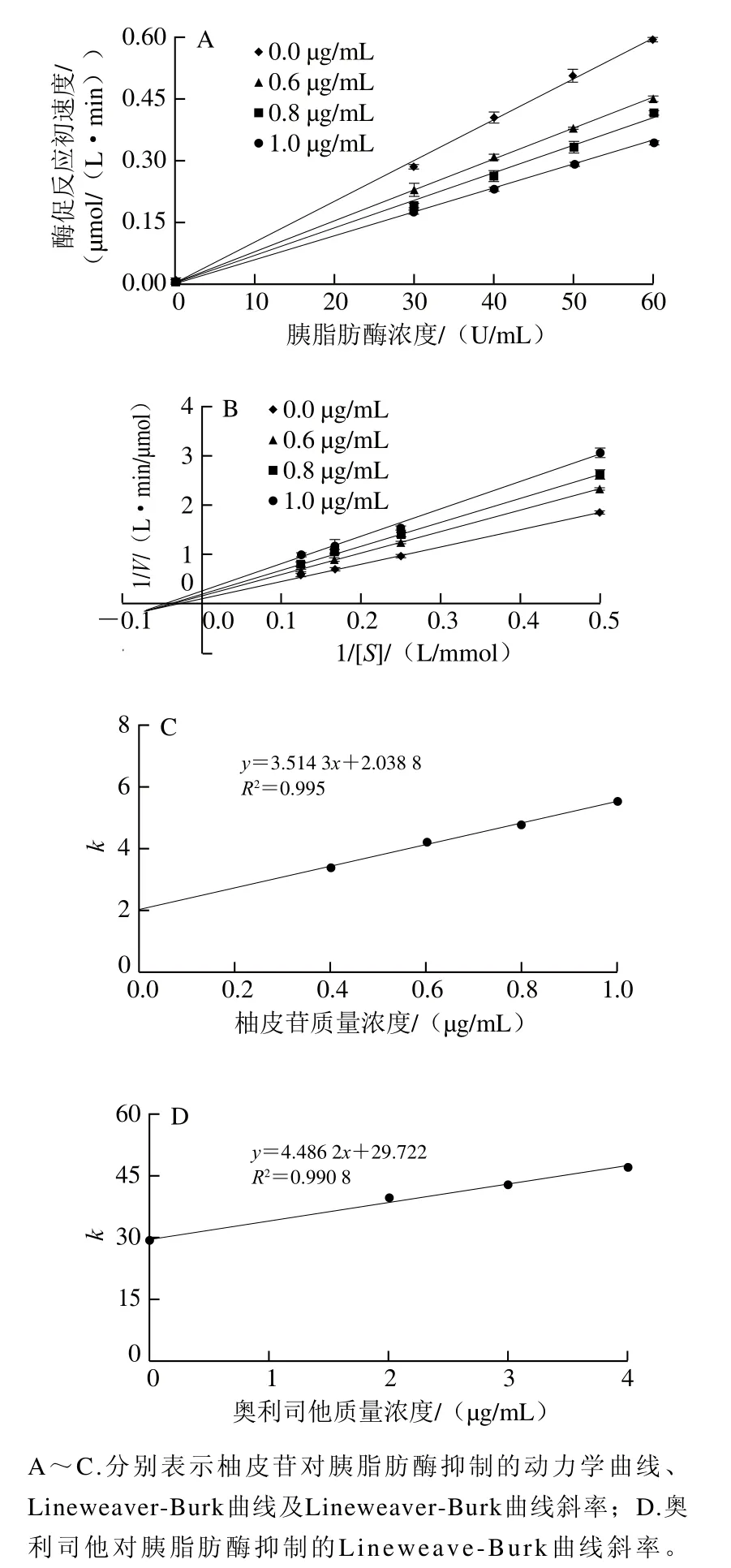
图3 柚皮苷及奥利司他的胰脂肪酶抑制动力学Fig. 3 Pancreatic lipase of naringin and orlistat inhibition kinetics
2.4 纯化组分与胰脂肪酶分子作用特征
酶和抑制剂的分子间相互作用有助于从微观状态解释酶的抑制特性,目前研究酶与抑制剂相互作用的技术手段有分子对接、分子动力学模拟、晶体衍射、冷冻电子显微镜等技术。在有蛋白晶体结构的条件下,通常采用分子对接分析酶与抑制剂之间的相互作用特征[40]。相关研究表明,当抑制剂直接与底物竞争酶活性中心位点时,抑制类型为竞争性抑制[41];当抑制剂与酶活性中心外部位点结合,则为非竞争性抑制[42-43];而当抑制剂与胰脂肪酶的活性位点和非活性中心结合,出现双重抑制能力时表现为混合性抑制[1]。结合自由能是小分子配体与蛋白受体之间的相互作用,自由能越小,配体与蛋白结合得越紧密[44]。目前,相关研究已经测定了胰脂肪酶的晶体结构,其催化活性中心是一个催化三联体结构,由丝氨酸(serine,SER)-组氨酸(histidine,HIS)-天冬氨酸(aspartic acid,ASP)组成,具体催化活性位点为SER152、HIS263、ASP176[17]。根据该模型,柚皮苷和胰脂肪酶分子对接结果如图4所示,其中底物p-NPB与酶的氨基酸残基苏氨酸(threonine,THR)78、酪氨酸(tyrosine,TYR)114、SER152、脯氨酸(proline,PRO)180、异亮氨酸(isoleucine,ILE)209、亮氨酸(leucine,LEU)213形成范德华力,与HIS263形成氢键相互作用力,与苯丙氨酸(phenylalanine,PHE)77和PHE215形成Pi-Pi T型键(图4A);柚皮苷与酶的氨基酸残基色氨酸(tryptophan,TRP)85、ASP88、甲硫氨酸(methionine,MET)89、天冬酰胺(asparagine,ASN)92、谷氨酰胺(glutamine,GLN)95、ILE267、谷氨酸(glutamic acid,GLU)268、SER272、ASN276、SER332形成范德华力,与ASN334、HIS264、ASP333形成氢键相互作用力,与PHE335形成Pi-烷基键,与HIS271形成Pi-碳离子键,与LEU275形成Pi-阴离子键(图4B)。对比发现,底物p-NPB与酶活性中心催化位点SER152、HIS263相结合,而抑制剂柚皮苷与酶催化活性中心之外的位点结合,符合非竞争性抑制作用特征,此分子对接结果与图3B所示的抑制动力学结果一致。此外,柚皮苷与胰脂肪酶结合的自由能为-30.14 kJ/mol,胰脂肪酶与底物p-NPB的结合自由能为-27.21 kJ/mol,而阳性对照奥利斯他与胰脂肪酶结合的自由能为-19.25 kJ/mol,该结果说明柚皮苷对脂肪酶的结合能力明显强于底物p-NPB和阳性对照奥利司他,该结果与图3C所示的柚皮苷Ki结果相一致。
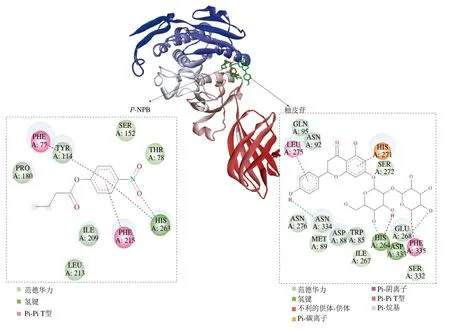
图4 胰脂肪酶与底物p-NPB(A)和柚皮苷(B)的分子对接2D模型Fig. 4 2D model of molecular docking between pancreatic lipase and the substrates 4-nitrophenyl butyrate (p-NPB) (A) and naringin (B)
3 结 论
本文通过Sephadex LH-20葡聚糖凝胶色谱法分离纯化以及用液相色谱、液相色谱-质谱联用、FTIR等方法鉴定了从琯溪蜜柚中纯化得到的主要黄酮组分为柚皮苷,其对胰脂肪酶IC50为0.99 μg/mL,抑制类型为可逆非竞争型,抑制常数Ki=0.58 μg/mL,结合自由能为-30.14 kJ/mol,主要通过范德华力、疏水相互作用、氢键、π键等作用力与酶催化活性中心之外的位点相结合。该结果说明琯溪蜜柚主要黄酮成分柚皮苷是一种高效安全的胰脂肪酶抑制剂,可为深入理解琯溪蜜柚及其他柑橘类水果抑制肥胖的功能提供理论依据,同时有助于从琯溪蜜柚等水果中开发安全高效的胰脂肪酶抑制剂。
