原生态与人工添加二十二碳六烯酸羊乳制品贮藏期脂肪酸稳定性比较
2022-05-13朱辉权王晓丹苏世灿王建烽逄晓阳张书文吕加平
朱辉权,王晓丹,苏世灿,王建烽,逄晓阳,张书文,芦 晶,*,吕加平,*
(1.中国农业科学院农产品加工研究所,北京 100193;2.厦门汇盛生物有限公司,福建 厦门 361000)
二十二碳六烯酸(docosahexaenoic acid,DHA)是人体必需的多不饱和脂肪酸(polyunsaturated fatty acids,PUFA),对大脑健康、人体生长发育,尤其婴儿的健康成长有至关重要的作用[1-2]。研究表明,向孕妇饮食中添加DHA会提高婴儿的认知能力[3],如果孕期DHA供给不足,可造成胎儿的脑细胞生长与发育不正常,导致婴儿智力低下;严重缺乏DHA时还可能导致胎儿中枢神经系统控制的代谢异常[4-5]。研究发现,通过持续喂食富含DHA的配方奶粉,婴儿在52周后视觉灵敏度显著提高[6]。母乳中的DHA由饮食中的亚麻酸在去饱和酶的作用下合成,主要以甘油三酯的形式存在,但婴儿体内去饱和酶的活性很低,无法满足合成需求[7-8],因此越来越多强化DHA的婴幼儿配方奶粉先后在日本、美国等地问世[9],我国对DHA在婴幼儿食品中的添加量规定为不超过0.5%(以总脂肪酸质量计),目前DHA的允许来源有裂壶藻油、金枪鱼油等[10-11]。
微藻是一种优质生物质资源,被广泛应用于生物能源、制药、食品、水处理、染料和饲料等领域[12]。微藻油脂中富含PUFA,其中DHA和二十碳五烯酸(eicosapentaenoic acid,EPA)是最有价值的功能成分。微藻被广泛应用于鱼类和反刍动物饲料中,以生产含有较高含量ω-3脂肪酸的鱼、蛋、奶和其他食物[12],目前被应用于动物饲料成分的微藻有螺旋藻、钝顶螺旋藻和裂壶藻[13]。
近20 年来,人们对提高反刍动物奶中不饱和脂肪酸(unsaturated fatty acid,UFA)含量进行了大量的研究[13]。在常规饲料中添加鱼油或微藻粉可以在反刍动物乳中富集UFA,且微藻比鱼油富集效果更好[14]。微藻中富含的ω-3脂肪酸能有效地转移到反刍动物乳中,研究表明,向奶牛瘤胃中注射藻油,牛乳中ω-3脂肪酸的增加量为161%[15],而在日粮中添加微藻粉,牛乳中ω-3脂肪酸增量最高可达131%[16],羊乳中的ω-3含量可增加32%[17]。DHA在牛乳中的增加量范围为100%~1 000%或者更多[16-18],在山羊乳和绵羊乳中增加量分别为100%和660%[17,19]。此外,研究发现饲喂微藻后所产牛乳的感官评分与未饲喂组无明显区别[20],且饲喂鱼油后所产牛乳制作的巴氏杀菌乳、黄油等乳制品也无腥味[21-22]。
直接向牛奶中添加藻类油会引起一些问题。DHA含有碳碳双键,不饱和程度较高,容易与氧化剂发生氧化还原反应,同时更容易受到外界因素(氧气、温度、光照及金属离子等)影响,导致含量降低;雷媛媛等[23]还发现随着乳粉中DHA添加量的增加,乳粉感官评分明显降低,这是由于DHA添加剂本身带有一定腥味,添加到配方乳粉中会对原本乳粉体系的滋味和气味产生不利影响。因此,寻找一种DHA含量高的天然奶制品尤为重要。本实验通过向奶山羊饲料中添加微藻粉获得原生态DHA羊乳,并设立人工添加DHA组进行比较,探究DHA及其他脂肪酸在室温和高温环境下的贮藏稳定性,以期为制备富含DHA的天然奶制品提供理论参考。
1 材料与方法
1.1 动物、材料与试剂
崂山奶山羊(40只)饲养于山东潍坊优佳牧场。
裂壶藻粉 厦门汇盛生物有限公司;DHA微胶囊粉(DHA质量分数不低于10%) 青岛海智源生命科技有限公司。
盐酸、硫代硫酸钠、乙醚、异丙醇(均为分析纯),正己烷(色谱纯) 国药集团化学试剂有限公司;甲醇(色谱纯) 美国Fisher Scientific公司;37种脂肪酸混合标准品 上海安普实验科技有限公司。
1.2 仪器与设备
旋转蒸发器(SHB-B95型循环水式多用真空泵+DL10-2000循环冷却器+R-1010旋转蒸发仪) 郑州长城科工贸有限公司;MOILE MINORTM-2000喷雾干燥塔 德国GEA公司;中试超高温瞬时灭菌(ultrahigh temperature instantaneous sterilization,UHT)生产线(APV1000均质机 丹麦APV公司;PT-20TS LAB TIT UHT Sterilization杀菌机 日本Powerpoint International公司;无菌填充室 上海沃迪智能装备股份有限公司);8890B气相色谱仪 美国Agilent公司;AH100D高压均质机加拿大ATS工业系统有限公司;MVS-1涡旋振荡器 北京金北德工贸有限公司;ZDJ-4A自动电位滴定仪 上海雷磁股份有限公司。
1.3 方法
1.3.1 样品的制作与贮藏
1.3.1.1 奶山羊饲喂与原料奶收集
挑选胎次、产奶量等相似的崂山奶山羊40只,将其随机均分为空白组和实验组,每组20只奶山羊。各组奶山羊饲喂相同的浓缩饲料及牧草,同时每天向每只实验组奶山羊饲料中添加25 g裂壶藻粉,饲喂40 d,并使羊乳的DHA含量达到30 mg/100 g,挤奶机采集羊乳后将空白组与实验组的羊乳于低温(0~4 ℃)条件下冷藏,全程低温运送至北京及时加工处理。
1.3.1.2 UHT乳的制作
在空白组原料乳中添加DHA微胶囊粉(人工添加组),使其DHA含量与实验组(原生态组)山羊乳DHA含量相近,并对其进行均匀搅拌。将人工添加组及原生态组的山羊乳进行UHT处理:羊乳经预热至70~80 ℃后,采用二级均质(一级均质压力20 MPa+二级均质压力5 MPa)处理,然后进行(127±1)℃、7 s热处理,灭菌后的羊乳无菌冷灌装。将制得的UHT乳分别在25 ℃和37 ℃条件下进行保存。UHT乳各项指标的测定从制样当天开始进行,记为0 d,此后在贮藏第7、14、21、28天时进行相关指标检测。
1.3.1.3 全脂乳粉的制作
将空白组及实验组羊乳进行喷雾干燥处理,处理过程为:羊乳经预热杀菌(93 ℃、3 min)后进行蒸发浓缩,待羊乳中固形物质量分数达到(45±2)%时进行均质处理(20 MPa),之后再升温至72 ℃,进行喷雾干燥(进口温度180 ℃、出口温度80 ℃,压力喷嘴雾化)后,取空白组乳粉,向其中添加DHA微胶囊粉(人工添加组),使其DHA含量与实验组(原生态组)相近。将制得的两组羊乳粉样品分别在25 ℃和37 ℃条件下储存,进行各指标的检测,检测取样时间与UHT乳一致。
1.3.2 指标的测定
1.3.2.1 脂肪酸含量的测定
参考Cruz-Hernandez等[24]的方法和GB 5009.168—2016《食品安全国家标准 食品中脂肪酸的测定》[25],将31 mg十三碳酸甘油三酯放入10 mL容量瓶中,用正己烷溶解定容至10 mL,作为内标液。以HCl-甲醇混合液(1∶3,V/V)为催化剂制备脂肪酸甲酯。具体步骤如下:取250 μL样品、300 μL内标液、2 mL甲醇、2 mL HCL-甲醇混合液、1 mL正己烷加入到15 mL的旋盖玻璃试管中,涡旋振荡1 min。然后将试管在100 ℃的水浴中加热1 h。冷却至室温后,在试管中加入2 mL水,剧烈摇晃试管30 s后再1 200×g离心5 min,取上层清液(正己烷)过0.22 μm滤膜注入到气相色谱瓶中。
色谱条件:进样口和检测器的温度均为250 ℃,载气为氮气,流速为0.8 mL/min,分流比为1∶20。柱温箱升温程序:初始温度为50 ℃,保持1 min,然后加热到175 ℃,升温速率为20 ℃/min,最后加热到230 ℃后保持5 min,升温速率为1.3 ℃/min。
使用内标法对DHA进行定量,其余脂肪酸使用面积归一法进行相对含量的计算。
1.3.2.2 过氧化值的测定
采用GB 5009.227—2016《食品安全国家标准 食品中过氧化值的测定》[26]中电位滴定法测定样品中过氧化值(peroxide value,POV)。
1.3.2.3 酸价的测定
采用GB 5009.229—2016《食品安全国家标准 食品中酸价的测定》[27]中冷溶剂自动电位滴定法测定样品中酸价(acid value,AV)。
1.4 数据处理与分析
采用SPSS 24.0软件对数据进行处理,结果以平均值±标准差表示;采用Excel软件进行作图;采用SPSS软件通过单因素方差分析方法进行显著性分析,以P<0.05表示差异显著。
2 结果与分析
2.1 羊乳制品贮藏期DHA含量变化
由表1和表2可见,人工添加DHA组UHT乳及全脂乳粉在不同温度条件下贮藏0、7、14 d与21、28 d时DHA含量总体有显著差异(P<0.05),原生态组乳制品与人工添加组变化趋势相似,但原生态全脂乳粉在37 ℃条件下贮藏期内无显著性差异。贮藏第0天时原生态组UHT乳和全脂乳粉中DHA含量分别达到31.82、215.03 mg/100 g。同时,随着贮藏时间的延长,人工添加与原生态组乳制品DHA含量均降低,但原生态组的DHA含量下降速率明显低于人工添加组,与室温(25 ℃)贮藏条件相比,高温(37 ℃)下各组乳制品中DHA含量降低更明显,这表明温度会加速DHA的氧化速率。DHA是一种PUFA,极易受到外界因素(如氧气、光照、温度及金属离子)的影响而发生氧化反应,造成DHA含量的下降[28]。

表1 UHT乳贮藏期DHA含量变化Table 1 Changes in content of DHA in UHT-sterilized goat milk during storage mg/100 g
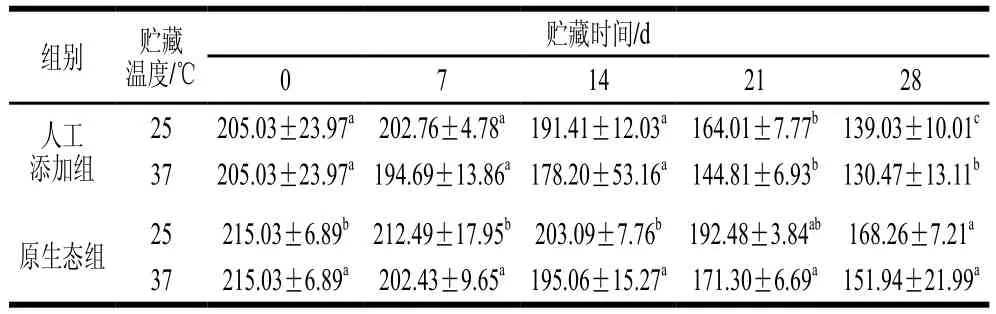
表2 全脂乳粉贮藏期DHA含量变化Table 2 Changes in content of DHA in goat milk powder during storage mg/100 g
由图1可见,在UHT乳中,人工添加组和原生态组DHA含量的降低率在第28天时均可达到30%以上,其中37 ℃下人工添加组UHT乳DHA含量降低率(与0 d相比,下同)最高,为(40.92±3.52)%,原生态组UHT乳DHA含量降低率为(36.70±4.84)%;同时,在37 ℃条件下贮藏第14天时,原生态组DHA含量降低率最高,而贮藏14 d后,原生态组降低速率减缓,人工添加组降低速率增加,这说明与人工添加组相比,在贮藏前期原生态组中DHA更容易受到高温条件的影响,但随贮藏时间的延长,DHA含量降低速率会低于人工添加组,这可能是由于前期人工添加组DHA受到微胶囊保护氧化速率较慢,随着贮存时间的延长,包埋壁材被破坏,DHA暴露于空气中,加速了氧化。相比于UHT乳,贮藏前期全脂乳粉人工添加组与原生态组DHA降低率均较低,在常温(25 ℃)贮藏第14天时,人工添加组与原生态组DHA含量降低率分别为6.64%和5.55%。而在14 d后,人工添加组与原生态组DHA含量降低率呈现急剧上升趋势,在贮藏结束时(第28天),人工添加组和原生态组在37 ℃条件下的DHA含量降低率则分别为36.37%和29.34%,DHA含量降低率小于UHT乳。张鹏等[1]选择不同添加量的DHA含量婴幼儿配方奶粉进行为期48 d的贮藏实验,结果显示样品中DHA含量降低速率随贮藏时间的延长有所变化,最高可达14.3%;李佳梅等[29]发现45 ℃条件下贮藏6个月后婴幼儿配方奶粉中DHA含量的降低率仅为1.94%,本实验中人工添加组全脂羊乳粉在37 ℃下贮藏28 d后,DHA含量的降低率为36.37%,这与之前文献报道有所不同,可能与所选的外添加粉DHA包埋方式及乳原料品种及用量不同有关。
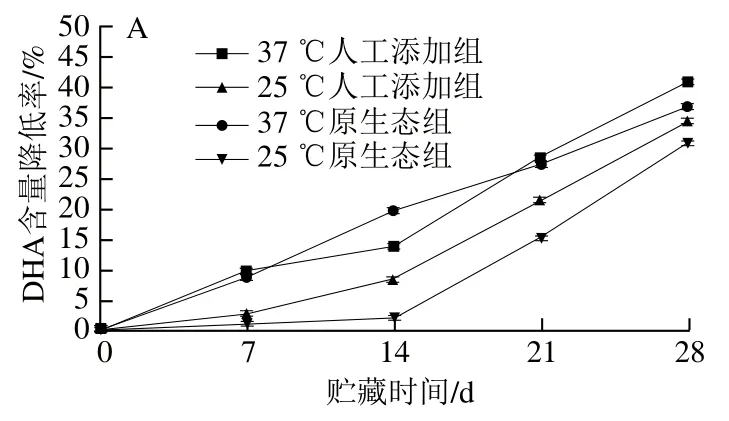

图1 UHT乳及全脂乳粉中DHA含量降低率Fig. 1 Change in percentage decrease of DHA content in UHT-sterilized goat milk and milk powder during storage
2.2 羊乳制品脂肪酸贮藏稳定性分析结果
由表3和表5可知,贮藏时间及贮藏温度对人工添加DHA的全脂乳粉及UHT乳的脂肪酸相对含量均有明显影响。在贮藏期间,人工添加DHA的UHT乳中中短链饱和脂肪酸如丁酸(C4:0)、己酸(C6:0)、辛酸(C8:0)、癸酸(C10:0)相对含量在所有温度下基本均呈现先增加后降低再增加,而全脂乳粉中的中短链饱和脂肪酸相对含量呈现先降低后增加的趋势。人工添加DHA的UHT乳中长链不饱和脂肪酸如十五碳烯酸(C15:1)、十六碳烯酸(C16:1)在所有温度下相对含量均增加,且在高温下增加速率更高,油酸(C18:1n9c)含量则一直降低。人工添加DHA的全脂乳粉中十四碳烯酸(C14:1)、十六碳烯酸(C16:1)、油酸(C18:1n9c)的相对含量则呈现降低趋势。棕榈酸(C16:0)、十七烷酸(C17:0)在人工添加DHA的UHT乳和全脂乳粉中相对含量保持稳定。牛乳中的脂质在贮藏期间会发生自动氧化,其中不饱和脂肪酸自动氧化加氢断裂形成饱和脂肪酸及更短的脂肪酸[30],在人工添加DHA的UHT乳及全脂乳粉中,随贮藏期的延长,不同脂肪酸表现出不一样的变化规律,中短链饱和脂肪酸相对含量整体增加,UHT乳中长链不饱和脂肪酸相对含量增加,全脂乳粉中长链不饱和脂肪酸相对含量则降低。
由表4和表6可见,贮藏时间及贮藏温度对原生态DHA组全脂乳粉及UHT乳的脂肪酸含量有明显影响。随贮藏时间的延长,原生态DHA组UHT乳中饱和脂肪酸如C4:0、C6:0相对含量上升,而在全脂乳粉中,C4:0、C6:0相对含量减少。此外,原生态DHA组UHT乳和全脂乳粉中C8:0和C10:0相对含量在贮藏期间呈基本稳定状态。这可能是由于全脂乳粉中C4:0、C6:0进一步氧化生成碳链更短的脂肪酸如乙酸、丙酸等。原生态DHA组UHT乳中不饱和脂肪酸C15:1相对含量增加,C16:1、C18:2n6c相对含量减少,C18:3n3相对含量保持稳定。全脂乳粉中C14:1、C15:1、C18:1n9c、C18:2n6c相对含量均降低。长链饱和脂肪酸C16:0相对含量在UHT乳和全脂乳粉中含量均保持稳定。与人工添加组相比,原生态DHA乳制品的PUFA含量降低速率会更高,这可能是由于饲喂微藻会增加羊乳中PUFA的含量[17],因此原生态羊乳制品中在贮藏开始时(第0天)PUFA含量就明显高于人工添加组,而PUFA在贮藏过程中会受到空气、光照水分等因素的影响被氧化成碳链更短的脂肪酸,进而导致PUFA相对含量降低。

表3 人工添加组UHT乳贮藏期脂肪酸相对含量变化Table 3 Changes in fatty acid contents in UHT-sterilized milk artificially added with DHA during storage %
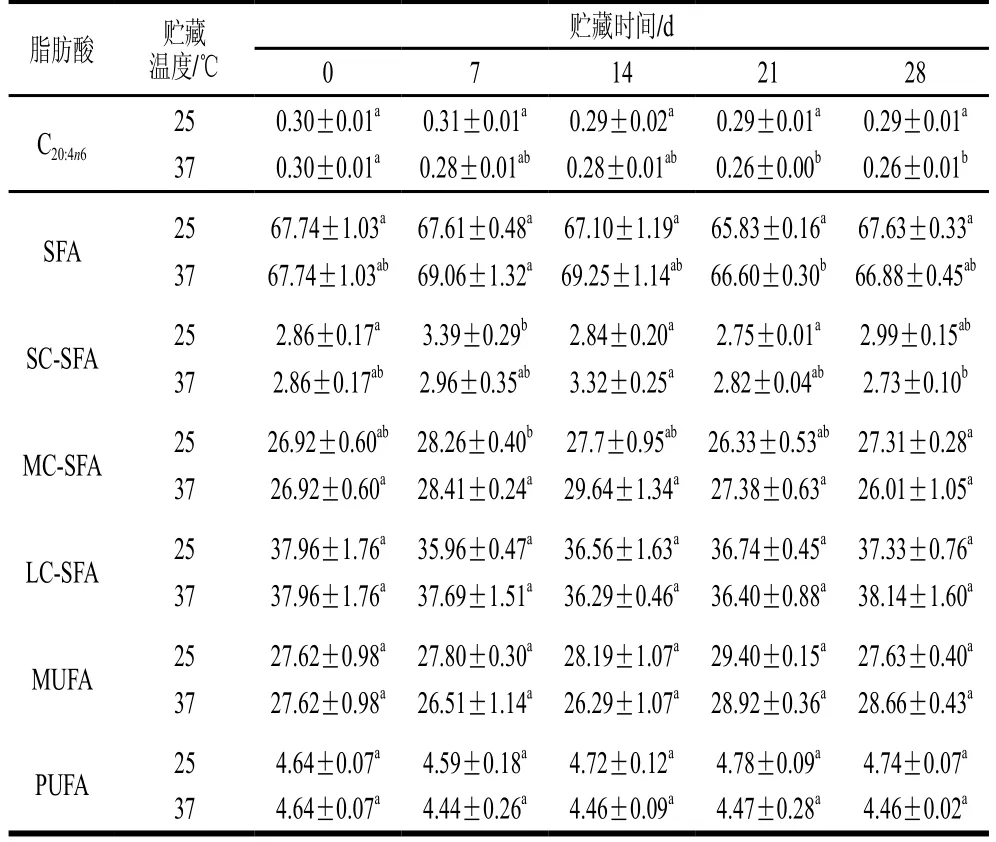
续表3 %

表4 原生态组UHT乳贮藏期脂肪酸相对含量变化Table 4 Changes in fatty acid contents in UHT-sterilized milk naturally enriched with DHA during storage %
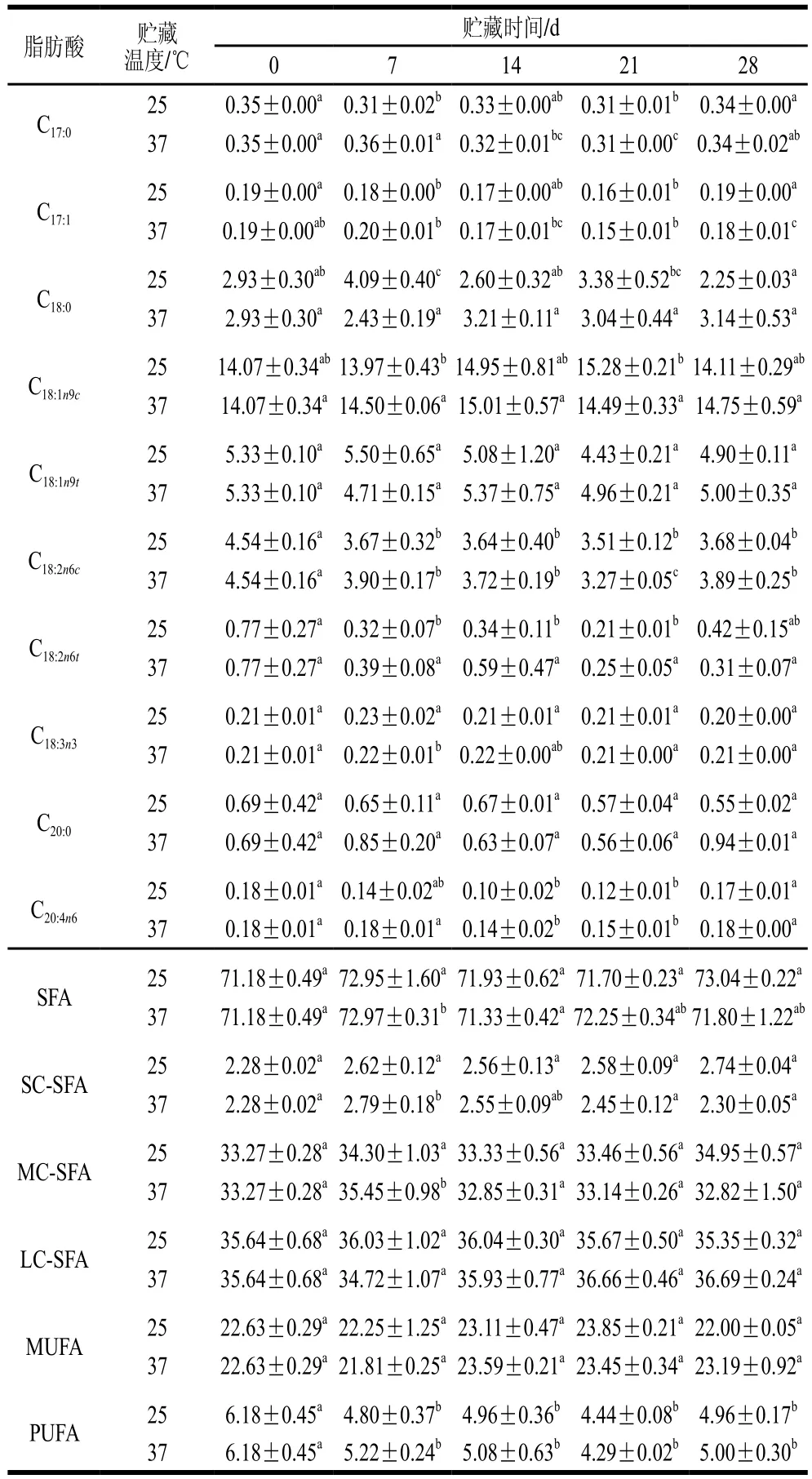
续表4 %
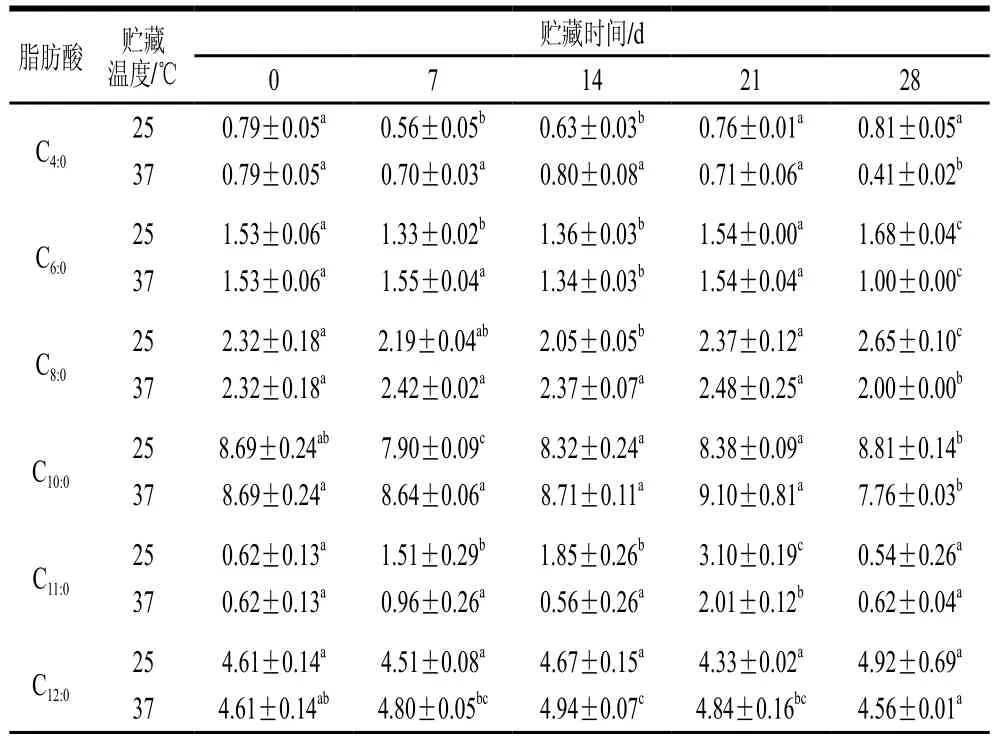
表5 人工添加DHA全脂乳粉贮藏期脂肪酸相对含量变化Table 5 Changes in fatty acid contents in milk powder artificially added with DHA during storage %
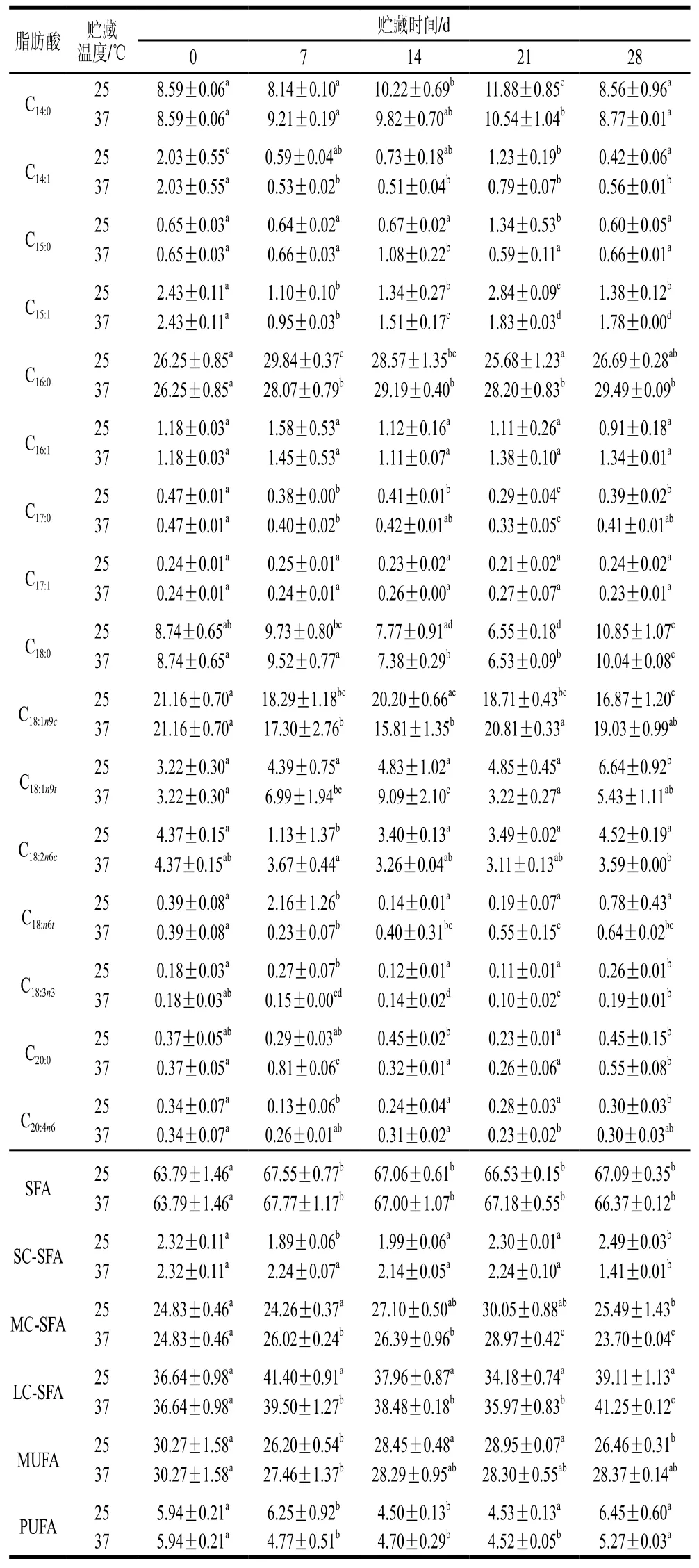
续表5 %
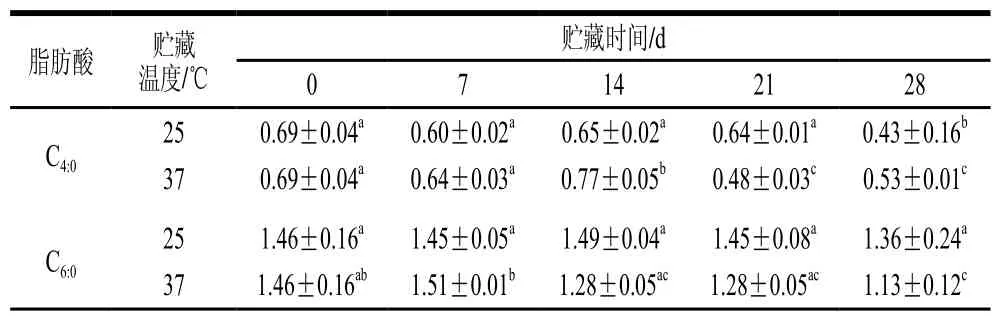
表6 原生态DHA全脂乳粉贮藏期脂肪酸相对含量变化Table 6 Changes in fatty acid contents of milk powder naturally rich in DHA during storage %

续表6 %
2.3 羊乳制品贮藏期POV及AV的变化规律
POV和AV是衡量贮藏期食品中油脂氧化程度的重要指标。由图2可知,各组UHT乳及全脂乳粉在常温(25 ℃)及高温条件(37 ℃)下POV总体均呈现上升趋势,且高温会加速乳制品POV的升高。UHT乳中人工添加组在37 ℃条件贮藏末期POV可达8.35 meq/kg,同期原生态组中POV为3.71 meq/kg;与UHT乳相比,乳粉POV上升趋势较缓,且原生态组乳粉在25 ℃贮藏期内无明显变化,说明与人工添加DHA乳制品相比,原生态DHA乳制品抗氧化能力更强。乳制品在贮藏期间脂质会发生自动氧化产生过氧化物[30],引起POV升高,同时,高温会加速脂肪的共价键发生断裂,生成自由基,引起脂肪的氧化,因而降低贮藏温度可减缓脂质的氧化速度[31]。

图2 UHT乳及全脂乳粉贮藏期POV的变化Fig. 2 Variation in POV of UHT-sterilized milk and milk powder during storage
由图3可知,UHT乳及全脂乳粉贮藏期间AV均上升,说明贮藏期间样品中脂肪发生了一定程度的水解。37 ℃下人工添加DHA组UHT乳与其他组相比,AV上升明显,且在第21天后急速增加,在贮藏第28天时达到最高(4.48 mg/g);与UHT乳相比,全脂乳粉AV则相对上升缓慢,这可能是与全脂乳粉中水分活度低有关。同时,与POV相似,原生态组AV上升速率较人工添加组缓慢,在37 ℃贮藏28 d时,人工添加组UHT乳和全脂乳粉中AV分别可达原生态组的503%和142%。此外,对于全脂乳粉来说,在贮藏第28天时,原生态DHA组全脂乳粉在高温条件下POV和AV分别为1.16 meq/kg和1.11 mg/g,此时人工添加DHA组全脂乳粉中POV和AV分别是原生态组的179%和142%。Celestino等[32]研究发现,鲜乳中含有微生物产生的耐热性脂肪酶,这些酶可耐受高温而残留在乳粉中,在贮藏过程中可分解乳脂中的甘油三酯,生成游离脂肪酸和甘油等物质,造成全脂羊乳粉脂肪AV上升,而高温可加速水解反应,游离脂肪酸生成积累速度加快,AV上升速度较快,同时游离脂肪酸含量的增加对全脂羊乳粉脂肪的氧化有一定的促进作用。
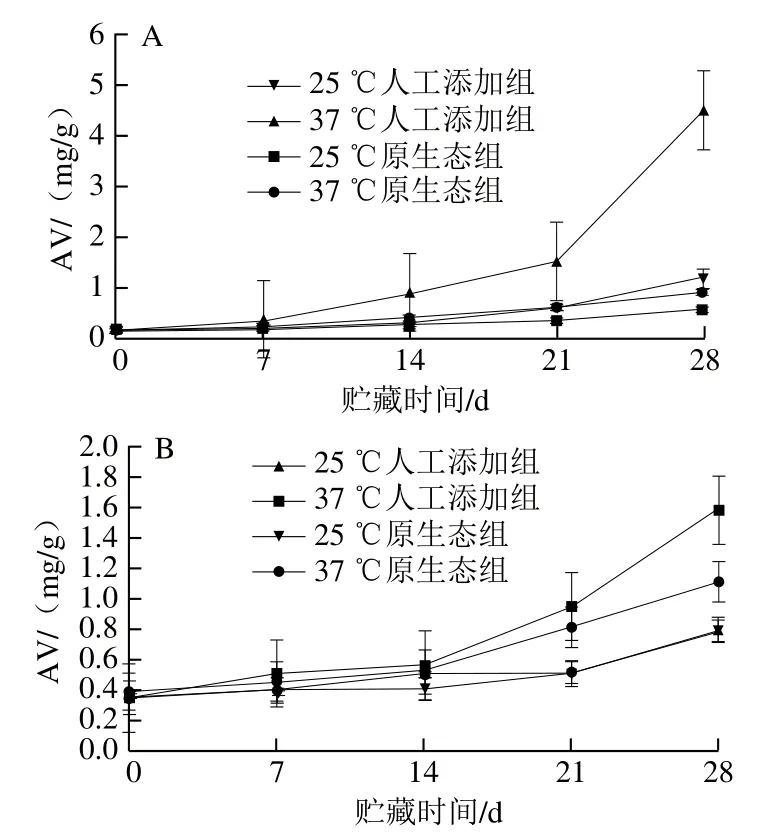
图3 UHT乳及全脂乳粉贮藏期AV的变化Fig. 3 Variation in AV of UHT-sterilized milk and milk powder during storage
3 结 论
本研究通过向奶山羊饲料中添加DHA微藻粉获得天然原生态DHA羊乳,将其制作成UHT乳及全脂乳粉,同时设立人工添加DHA微胶囊粉的UHT乳及全脂乳粉作为对照组,在常温(25 ℃)与高温(37 ℃)下进行为期28 d的贮藏实验,并进行相关指标的检测。结果表明,随贮藏时间的延长,原生态组UHT乳和全脂乳粉中的DHA含量降低率低于人工添加组,且在贮藏前期,原生态组UHT乳中DHA含量更易受到高温影响。POV和AV是评定贮藏期油脂氧化程度的重要指标,在贮藏期间,原生态DHA组UHT乳及全脂乳粉POV和AV上升速率明显低于人工添加DHA组,在贮藏第28天时,原生态DHA组全脂乳粉在高温条件下POV和AV分别为1.16 meq/kg和1.11 mg/g,此时人工添加DHA组全脂乳粉中POV和AV分别是原生态的179%和142%。通过UHT乳和全脂乳粉贮藏期间脂肪酸含量变化研究可知,原生态与人工添加DHA的UHT乳和全脂乳粉中PUFA含量下降,且与人工添加DHA的全脂乳粉相比,原生态组乳制品中多不饱和脂肪酸含量更高,更易氧化生成碳链更短的脂肪酸,这与脂肪酸的自动氧化紧密相关。
