铁棍/佛手山药粗多糖的抗糖尿病作用效果比较
2022-04-28蔡羽植飞陈运中刘思敏颜春潮万未希佘雅茹曾珉
蔡羽,植飞,2,陈运中*,刘思敏,颜春潮,万未希,佘雅茹,曾珉
(1.湖北中医药大学药学院,湖北省中药保健食品工程技术研究中心,湖北武汉 430065)
(2.武汉轻工大学生物与制药工程学院,湖北武汉 430023)
2型糖尿病(Type 2 diabetes,T2DM)是一种代谢综合症,目前T2DM患者大约占糖尿病患者总人数的90%[1],且比例不断上升。因此,找到治疗T2DM患者的特效药刻不容缓。
目前治疗T2DM的药物主要有磺酰脲类、二肽基肽酶Ⅳ抑制剂、内酯类、α-葡萄糖苷酶抑制剂、噻唑烷二酮类、双胍类、胰高血糖素样肽-1、受体激动剂和钠-葡萄糖协同转运蛋白2抑制剂等。但这些药物的靶点和通路比较单一,长期使用会产生不良反应。例如,长期服用噻唑烷二酮类药物会导致骨折、膀胱癌,尤其是对于心血管的损害比较严重[2],故有些国家禁止使用此类药物。而常用于治疗胰岛素抵抗的双胍类药物会导致胃肠道反应,同时不耐受双胍类药物的患者不宜使用胰岛素敏化剂治疗。因此,有必要开发出来自于天然且能够维持等效、副作用较小的抗糖尿病药物[3]。
从天然植物中提取的功能性多糖易于获得,价格合理,作为临床阶段药物对预防并发症也有不可替代的优势。近年来,天然植物功能性多糖的提取,以及筛选出治疗糖尿病的有效多糖技术受到越来越广泛的关注[4]。山药作为中国的一种传统药食同源植物[5],块茎常用于治疗食欲不振、慢性腹泻、哮喘、干咳、尿频、尿失禁和糖尿病[6]。由于山药品种繁多,生长条件不同,其结构和生物活性存在较大差异。大量研究表明,山药多糖是山药增强免疫力、降血糖的主要活性成分,并具有药理作用[7-11]。到目前为止,中国药典所记载的山药多糖的降血糖活性多是来自于铁棍山药,对于其他来源山药的降血糖活性报道较少,关于不同品种山药的降血糖活性比较研究报道更少,而河南省焦作市温县的“铁棍山药”及湖北省武穴市的“佛手山药”均为国家地理标志物,且两种山药的功能成分含量十分相近[12,13],因此,可合理地推测,佛手山药多糖的降血糖活性或与铁棍山药相近。本实验通过两种山药粗多糖在体外对自由基的清除作用和对α-葡萄糖苷酶的抑制作用,以及在体内对大鼠血糖、血脂和抗氧化活性的影响,来比较两者的抗糖尿病作用机制,为治疗T2DM提供更多的候选药物。
1 材料与方法
1.1 实验材料
50只2月龄无特定病原体(Specific pathogen Free,SPF)级雄性SD大鼠,体质量190 g,购于湖北省疾病预防与控制中心,实验单位使用许可证号为SYXK(鄂)2012-0068,实验动物生产许可证号为SCXK(鄂)2015-0018。在治疗期结束时,用二氧化碳使大鼠安乐死。实验方案经湖北中医药大学动物实验伦理委员会批准。
铁棍山药粗多糖及佛手山药粗多糖均由实验室自制,铁棍山药和佛手山药分别收集于河南省焦作温县和湖北省武穴市,由湖北中医药大学药学院胡志刚老师鉴定,鉴定结果铁棍山药与佛手山药皆为薯蓣科植物薯蓣Dioscorea opposita的根茎;单糖标准品(鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、木糖、阿拉伯糖),中国食品药品检定研究院;链脲佐菌素(Streptozotocin,STZ),美国Sigma公司;柠檬酸,天津永大化学试剂有限公司;柠檬酸三钠,中南化工试剂有限公司;盐酸二甲双胍,深圳海王药业有限公司;生理盐水,河南科伦药业有限公司;肝素钠、牛血清白蛋白(Bovine Serum Albumin,BSA)均购自国药集团化学试剂有限公司;胰岛素酶联免疫试剂盒,武汉基因美科技有限公司;甘油三酯(Triglyceride,TG)试剂盒、总胆固醇(Total cholesterol,TC)试剂盒、高密度脂蛋白胆固醇(High-density lipoprotein cholesterol,HDL-C)试剂盒、低密度脂蛋白胆固醇(Low-density lipoprotein cholesterol,LDL-C)试剂盒、超氧化物歧化酶(Superoxide dismutase,SOD)试剂盒、过氧化氢酶(Catalase,CAT)试剂盒、谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)试剂盒、肝糖原测定试剂盒均购自南京建成生物工程研究所;纯水由Milli-Q超纯水一体化机制得。
1.2 仪器与设备
AL104电子天平,梅特勒-托利多上海有限公司;CR21G II冷冻高速离心机,日本HITACHI公司;UV-3200紫外可见分光光度计,上海美普达仪器有限公司;Nicoletis10傅里叶红外光谱仪,赛默飞世尔科技(中国)有限公司;XW-80A涡旋混合仪,江苏海门其林贝尔仪器有限公司;GZX-9146MBE电热鼓风干燥箱,上海博讯实业有限公司医疗设备厂;HH-2数显恒温水浴锅,国华电器有限公司;其余仪器为实验室常规仪器。
1.3 实验方法
1.3.1 山药粗多糖的制备
将铁棍山药和佛手山药清洗、去皮并在121 ℃下蒸30 min灭酶。在60 ℃下干燥并研磨,将山药干粉各1.80 kg在60 ℃下用80%乙醇提取3次,每次1 h。然后在60 ℃下用蒸馏水将残留物萃取3次,每次3 h。将水提取物减压浓缩至1800 mL,与95%乙醇(1:4,V/V)混合24 h,以沉淀多糖化合物。收集沉淀,依次用乙醇、丙酮洗涤,在60 ℃下真空干燥,得到多糖的粗样品:铁棍山药粗多糖的质量为108 g,佛手山药粗多糖的质量为82 g。
1.3.2 山药粗多糖的分离纯化
将以热水萃取法(60 ℃)制得的粗多糖4 mg溶解在2 mL的2 mol/L三氟乙酸于密封试管,在110 ℃条件下水解6 h,完成后蒸发多余的酸,再加入2 mL甲醇干燥,重复三次,去除三氯乙酸。取水解物200 μL与50 μL的2 mol/L氢氧化钠混合,再加入50 μL 0.5 mol/L的1-苯基-3-甲基-5-吡唑啉酮(PMP)甲醇溶液,充分混合后于70 ℃水浴中浸泡30 min。冷却后以50 μL的0.3 mol/L盐酸中和,用水稀释至1 mL。然后加入1 mL氯仿。经过强烈的摇动和分层,将有机相分离去除[4]。
上述操作重复三次后,将最终得到的溶液注入HPLC进行分析。使用Silgreen ODS C18(250×4.6 mm,5 μm),30 ℃,流动相为20 mm醋酸铵-乙腈(78:22,V/V),流速为1.0 mL/min[14]。
将含有七种单糖(鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、木糖、阿拉伯糖)的标准溶液同样进行上述处理。得到结果对比后分析山药多糖的单糖组成。
1.3.3 山药粗多糖中总碳水化合物和蛋白质含量的测定
以葡萄糖为标准品,选用苯酚-浓硫酸法估算总糖含量[15]。在室温下将1 mL样品溶液、50 µL 80%苯酚和5 mL浓硫酸充分混匀,5 min后,于波长490 nm处测量吸光度,然后根据葡萄糖的标准曲线进行定量。以BSA为标准品,利用Bradford方法估算蛋白质的含量[16]。
1.3.4 山药粗多糖体外抗氧化活性的比较研究
1.3.4.1 清除DPPH自由基的能力
用Gao等[17]的研究方法,对山药粗多糖清除DPPH自由基的效果进行评估。将粗多糖样品用蒸馏水溶解,配制成50 mg/mL的样品溶液,然后分别精密吸取0.00、0.20、0.40、0.60、0.80、1.00 mL样品溶液于试管中,用蒸馏水补足至1 mL,加入1 mL新制备的0.10 mmol/L DPPH,震荡摇匀,室温下孵育30 min,在波长517 nm处测量吸光度,0.25 mg/mL的抗坏血酸(Vc)用做阳性对照药。
式中:
A0——无样品溶液时的吸光度;
A1——样品的吸光度。
1.3.4.2 清除PTIO自由基的能力
先将山药粗多糖样品用蒸馏水溶解,配制成50 mg/mL的样品溶液,然后精密吸取0.00、0.20、0.40、0.60、0.80、1.00 mL样品溶液,用蒸馏水补足至1 mL,加入1 mL新制备的0.05 mg/mL PTIO,充分混匀,并在37 ℃下孵育2 h,随后在波长557 nm处测量吸光度,0.25 mg/mL的Vc用做阳性对照药。
式中:
A0——无样品溶液时的吸光度;A1——样品的吸光度。
1.3.5 山药粗多糖抑制α-葡萄糖苷酶的活性比较研究
使用李鹏程[18]等的方法,对山药粗多糖抑制α-葡萄糖苷酶的活性进行测定。将40 µL 0.10 mol/L的磷酸盐缓冲液(pH 6.8)、30 µL 1 u/mL的α-葡萄糖苷酶溶液(pH 6.8)与30 µL 10 mmol/L的麦芽糖溶液(pH 6.8)混匀,然后精密吸取40 µL 0.00、0.60、1.30、2.50、5.00、10.00 mg/mL的样品溶液分别加入其中,并在37 ℃下孵育30 min,随后在沸水浴中孵育5 min终止反应,冷却至室温,于5000 r/min离心2 min,取10 µL上清液用试剂盒测定葡萄糖含量,在波长505 nm处测量吸光度,阿卡波糖用做阳性对照药。抑制α-葡萄糖苷酶的活性计算公式如下:
式中:
A0——无样品溶液时的吸光度;
A1——样品的吸光度。
1.3.6 糖尿病大鼠模型体内降血糖、血脂及抗氧化活性的测定
1.3.6.1 造模方法
大鼠饲养于湖北中医药大学实验动物中心SPF级实验动物房,室温22±2 ℃,光/暗周期为12 h。实验进行前,所有大鼠均适应性饲养7 d,实验期间均自由进食、饮水。将大鼠随机分为正常对照组和实验组,正常对照组给予普通饲料,实验组给予高脂饲料(68%的基础饲料,15%的糖,10%的成熟猪油,5%的蛋黄粉,1%的胆固醇和1%的胆酸钠)。将大鼠饲喂28 d后,后续12 h禁食(不禁水),实验组大鼠腹腔注射1% STZ溶液40 mg/kg,正常对照组腹腔注射等剂量柠檬酸-柠檬酸钠缓冲液。注射后使大鼠饥饿3 h,然后给予3%葡萄糖溶液以防止低血糖。3 d后,将大鼠禁食(不禁水)12 h,测量空腹血糖浓度、空腹胰岛素(Fasting serum lisulin,FINS)活力。计算胰岛素敏感指数(Insulin sensitivity index,ISI)的公式为:
FBG超过11.10 mmol/L且ISI显著降低并保持稳定水平两周的大鼠被认为是成功模型,然后纳入本实验。
1.3.6.2 分组与给药
将造模成功的大鼠随机分为模型组、二甲双胍组、铁棍山药粗多糖组和佛手山药粗多糖组,另取空白鼠设为正常组,每组均为8只。二甲双胍组用药剂量为150 mg/(kg·d),铁棍山药粗多糖组和佛手山药粗多糖组用药剂量为400 mg/(kg·d),给药体积均为1 mL/100 g,正常组和模型组给予等体积的0.90%生理盐水,连续灌胃6周。
1.3.6.3 体重和空腹血糖的测定
每两周记录体重并测定血糖浓度。
1.3.6.4 口服葡萄糖耐量试验(Oral glucose tolerance test,OGTT)
给药第35 d,进行口服葡萄糖耐量试验。大鼠经12 h禁食后,将1 g/kg b.w.葡萄糖灌胃后,分别在0、30、60、90 min用血糖仪测定尾静脉血糖含量。
1.3.6.5 检测样品的制备
治疗结束后,大鼠眼球取血,于4000 r/min、4 ℃离心10 min得到血清,分装后于-20 ℃冷冻备存。
1.3.6.6 肝糖原含量的测定
按肝糖原测定试剂盒方法检测。
1.3.6.7 TG、TC、HDL-C和LDL-C的含量测定
按相应试剂盒方法检测。
1.3.6.8 SOD、CAT和GSH-Px的活性测定按相应试剂盒方法检测。
1.4 统计分析
处理实验数据选用IBM SPSS Statistics 19统计软件。计量资料用均量±标准差(ˉx±s)表示。为了进行多次比较,使用了单向方差分析,并进行了Tukey检验;为了比较两组之间的差异,使用了t检验。当p<0.05时,数值被认为具有统计学意义(p<0.05,差异显著;p<0.01,差异极显著)。
2 结果与讨论
2.1 铁棍山药和佛手山药粗多糖的多糖与蛋白质含量
如表1所示,铁棍山药粗多糖和佛手山药粗多糖的主要成分是多糖,多糖含量分别为61.34%、40.95%,可溶性蛋白含量分别为4.62%、14.55%。铁棍山药粗多糖中的多糖含量高于佛手山药粗多糖(p<0.01),而总蛋白含量低于佛手山药粗多糖(p<0.01)。佛手山药与铁棍山药粗多糖中多糖含量较低的原因可能为提取方法尚未完善所致,而多糖确为山药的主要活性成分[4]。佛手山药与铁棍山药的可溶性蛋白含量差异可能是由于品种不同所致。

表1 铁棍山药粗多糖和佛手山药粗多糖的多糖与蛋白质含量测定Table 1 Determination of polysaccharides and protein contents of crude polysaccharides of iron stick yam and bergamot yam
2.2 铁棍山药和佛手山药粗多糖中单糖的组成
如表2所示,铁棍山药和佛手山药粗多糖中单糖的主要组成为葡萄糖,含量分别为73.88 mol%、60.79 mol%。其中佛手山药多糖中葡萄糖、半乳糖及半乳糖醛酸的含量显著低于铁棍山药多糖(p<0.05),鼠李糖、木糖、阿拉伯糖及葡萄糖醛酸的含量显著高于铁棍山药多糖(p<0.05)。有研究提示,阿拉伯糖的长期干预可以有效缓解T2DM大鼠的葡萄糖耐量受损[19],木糖通过再生受损的胰腺和肝脏组织和调节糖异生过程,有效调节血糖水平,从而在体内发挥抗糖尿病作用[20]。

表2 铁棍山药和佛手山药粗多糖中单糖的组成(mol%,n=3)Table 2 Composition of monosaccharides in crude polysaccharides of iron stick yam and bergamot yam (mol%, n=3)
2.3 山药粗多糖的体外抗氧化活性
研究认为,2型糖尿病与机体的氧化应激密切相关。细胞内的自由基可分为两类:活性氧(ROS)和活性氮(RNS)。ROS主要包括羟基自由基(HO·)、过氧化物自由基(O2-·)和脂质过氧化物自由基(LOO-·),RNS主要包括一氧化氮(NO·)。这些ROS和RNS在体内积累过多会引起氧化应激和各种病理变化[21]。当氧化应激发生后,胰岛β细胞容易发生损伤及凋亡,原因是胰岛β细胞中超氧化物歧化酶与抗氧化物的含量相对较低,且对RNS和ROS具有高敏感性。并且,氧化应激与糖尿病微血管病变及大血管病变均紧密相关。综上,2型糖尿病的发病与氧化应激密切相关,在糖尿病的早期、进程及并发症的发生中,氧化应激都为重要原因之一[22,23]。RNS和ROS都不稳定,并且难以直接评估。由于DPPH自由基的单电子位于N原子上,说明它是RNS而不是ROS。因此,DPPH只能用于评估RNS清除级别,而不能用于评估ROS清除级别。在本实验中,将DPPH与PTIO自由基清除法结合使用来全面地评估山药粗多糖的抗氧化活性。
表3说明了山药粗多糖对DPPH和PTIO自由基的清除作用。两种粗多糖的清除能力与Vc的清除能力显著不同(p<0.01),且两者对于DPPH自由基的清除作用均强于PTIO自由基(p<0.01)。铁棍山药粗多糖对DPPH自由基的清除作用弱于佛手山药粗多糖(p<0.01),而对PTIO自由基的清除作用则强于佛手山药粗多糖(p<0.01)。
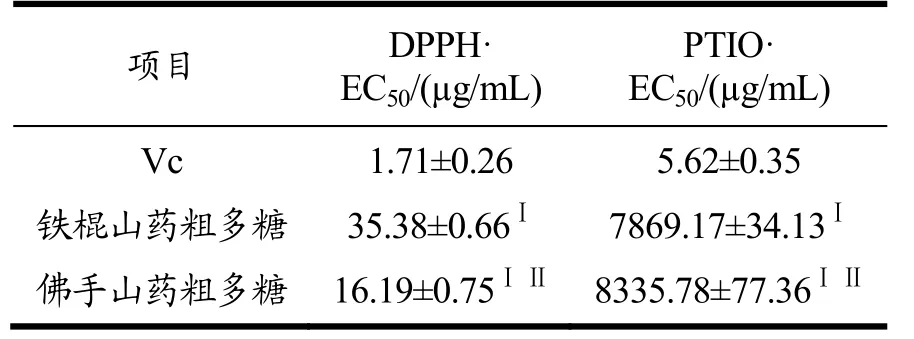
表3 铁棍山药粗多糖和佛手山药粗多糖对DPPH和PTIO自由基的清除作用Table 3 Scavenging effects of crude polysaccharides of iron stick yam and bergamot yam on DPPH and PTIO free radicals
2.4 山药粗多糖抑制α-葡萄糖苷酶的活性
α-葡萄糖苷酶存在于人的肠道中,可催化含有α-糖苷键的底物产生葡萄糖,从而促进碳水化合物的吸收和利用[24]。α-葡萄糖苷酶的抑制剂可与α-葡萄糖苷酶结合,降低其活性,延迟或抑制消化道中葡萄糖的吸收,从而控制餐后血糖浓度[25]。
铁棍山药粗多糖和佛手山药粗多糖在体外对α-葡萄糖苷酶的抑制作用如图1所示。阿卡波糖和两种山药粗多糖对α-葡萄糖苷酶的抑制作用存在显著差异(p<0.01),铁棍山药粗多糖和佛手山药粗多糖的抑制率分别为18.85%和15.73%。两种多糖在0.60~10.00 mg/mL的范围内无显著差异(p>0.05)。
2.5 山药粗多糖的体内抗糖尿病作用
2.5.1 糖尿病大鼠模型的建立
正常对照组大鼠强壮、皮毛有光泽、精神状态很好、反应迅速;而实验组大鼠与正常对照组相比:瘦弱、皮肤暗沉、气味加重、有“三多”(多饮、多食、多尿)等典型的糖尿病症状。在腹腔注射STZ 3 d后,正常对照组大鼠体重增加,但实验组大鼠体重无明显变化。如表3所示,与正常对照组相比,实验组大鼠的FBG、FINS显著增加,而ISI显著降低,由此说明成功建立了T2DM大鼠模型。

表4 建立T2DM模型后大鼠的FBG、FINS与ISI测定Table 4 Determination of FBG, FINS and ISI contents after establishing the T2DM model
2.5.2 铁棍山药粗多糖和佛手山药粗多糖对T2DM大鼠体重的影响
如图2所示,给药结束时,与正常组相比,模型组、二甲双胍组、铁棍山药粗多糖组和佛手山药粗多糖组的体重显著降低(p<0.01),且这4组的体重差异不显著(p>0.05)。
2.5.3 铁棍山药粗多糖和佛手山药粗多糖对T2DM大鼠空腹血糖的影响
如表5所示,给药前,与正常组相比,模型组、二甲双胍组、铁棍山药粗多糖组及佛手山药粗多糖组的空腹血糖值均极显著上升(p<0.01)。给药结束后,二甲双胍组、铁棍山药粗多糖组和佛手山药粗多糖组空腹血糖较模型组分别下降49.59%、24.38%和25.62%,有显著差异(p<0.01,p<0.05),且二组间无显著差异(p>0.05);与二甲双胍组相比,铁棍山药粗多糖组及佛手山药粗多糖组无显著差异(p>0.05)。以上结果表明,铁棍山药粗多糖与佛手山药粗多糖均能降低T2DM大鼠空腹血糖值,且效果相近。Li等人[26]的研究证明,山药多糖的降血糖作用与1→3糖苷键有关,同时最终消化产物形成短链寡糖,有利于有益肠道细菌的生长。
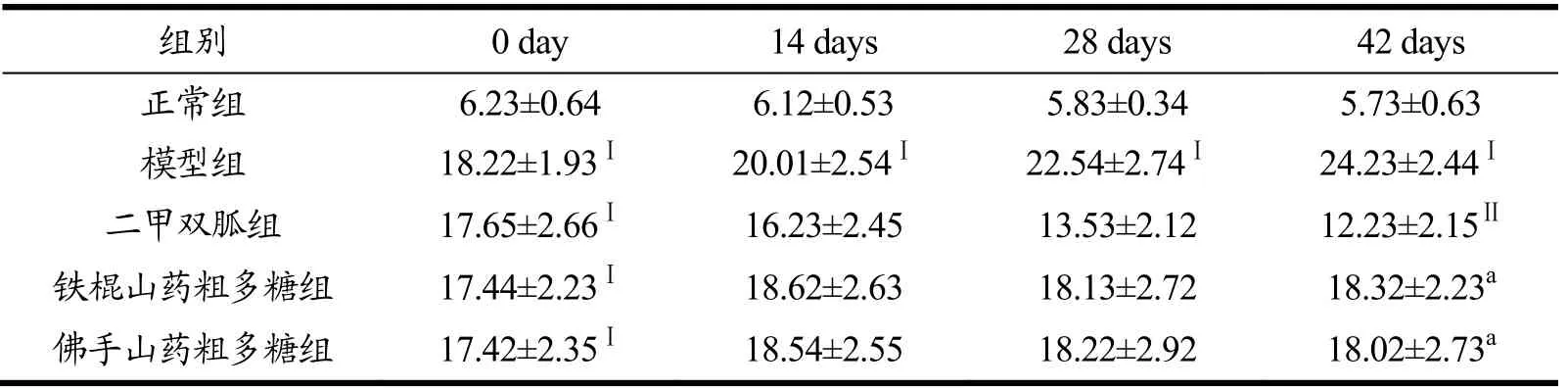
表5 铁棍山药粗多糖和佛手山药粗多糖T2DM大鼠空腹血糖的影响(mmol/L)Table 5 Effects of Tiegun DOTPs and Foshou DOTPs on the FBG of diabetic rats (mmol/L)
2.5.4 铁棍山药粗多糖和佛手山药粗多糖对糖尿病大鼠口服糖耐量的影响
如表6所示,与正常组大鼠相比,模型组、二甲双胍组、铁棍山药粗多糖组和佛手山药粗多糖组大鼠的血糖值在0、30、60、90 min均极显著增加(p<0.01),表明糖尿病大鼠出现明显的葡萄糖耐量受损。与模型组大鼠相比,二甲双胍组、铁棍山药粗多糖组和佛手山药粗多糖组大鼠的血糖值于30 min分别下降10.6%、17.5%和14.2%,有显著差异(p<0.05);在60、90 min均极显著降低(p<0.01);二甲双胍组、铁棍山药粗多糖组和佛手山药粗多糖组的血糖值无明显差异(p>0.05)。以上结果提示,两种山药粗多糖均具有改善T2DM大鼠糖耐量受损的作用,且效果与二甲双胍接近。
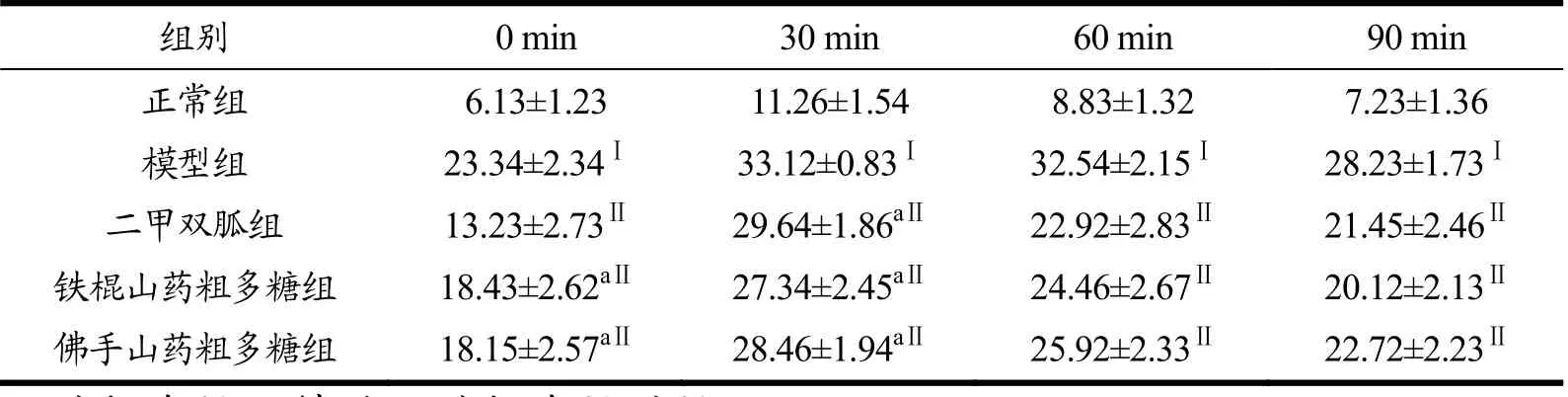
表6 铁棍山药粗多糖和佛手山药粗多糖对糖尿病大鼠口服糖耐量的影响(mmol/L)Table 6 Effects of Tiegun DOTPs and Foshou DOTPs on the OGTT of T2DM rats (mmol/L)
2.5.5 铁棍山药粗多糖和佛手山药粗多糖对T2DM大鼠肝糖原含量的影响
如表7所示,给药结束后,铁棍山药粗多糖组与二甲双胍组的肝糖原含量较模型组分别上升21.83%、14.85%,具有显著差异(p<0.05);佛手山药多糖组肝糖原含量较正常组下降10.06%,具有显著差异(p<0.05),同时较模型组上升3.71%,无显著差异(p>0.05)。可认为铁棍山药粗多糖降低T2DM大鼠肝糖原分解的能力强于佛手山药粗多糖,而与二甲双胍接近。
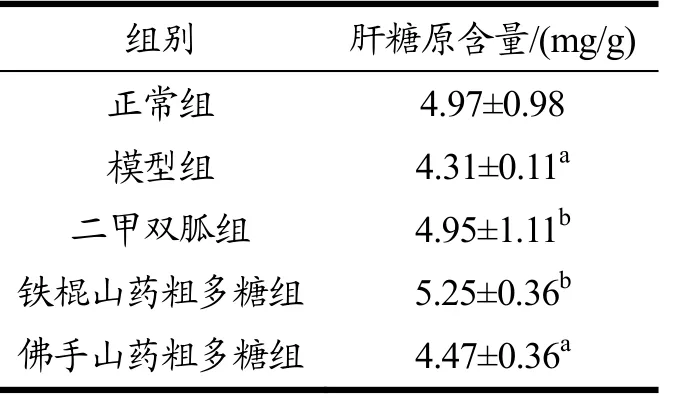
表7 铁棍山药粗多糖和佛手山药粗多糖对T2DM大鼠肝糖原含量的影响Table 7 Effects of Tiegun DOTPs and Foshou DOTPs on the hepatic glycogen contents in T2DM rats
2.5.6 铁棍山药粗多糖和佛手山药粗多糖对T2DM大鼠TG、TC、LDL-C和HDL-C的影响
糖尿病患者常伴有脂质代谢异常的症状,与胰岛素失调有关,称为“高脂血症”。糖尿病合并高脂血症导致出现并发症的几率增加,例如中风、冠心病和肢体坏死,这些是糖尿病患者致残甚至死亡的主要原因。目前,改善血脂异常是治疗糖尿病和评价疗效的一种方法[27,28]。
如图3所示,模型组大鼠相对于正常组,TG、TC和LDL-C的含量均升高,HDL-C的含量降低(p<0.01),表明模型组大鼠血脂异常。治疗6周后,与模型组相比,铁棍山药粗多糖组的TG、TC和LDL-C分别降低了6.31%、28.44%、44.68%,佛手山药粗多糖组的TG、TC和LDL-C分别降低了28.52%、22.79%、44.73%。铁棍山药粗多糖组和佛手山药粗多糖组的TG有显著性差异(p<0.05),而TC和LDL-C没有显著性差异(p>0.05)。Cheng等[29]的研究证明,山药多糖能够通过降低LDL-C及TC的水平减少炎症蛋白产物,提高胰岛素敏感性来改善肥胖诱导的胰岛素抵抗。
2.5.7 铁棍山药粗多糖和佛手山药粗多糖对T2DM大鼠氧化应激的影响
多项研究表明,组织抗氧化剂与糖尿病的病因密切相关[30,31]。氧化应激和抗氧化防御系统之间的不平衡会导致细胞和组织损伤,并加速糖尿病并发症的发生[32-35]。因而氧化应激是各种干预和治疗协同作用的重点,抗氧化剂对糖尿病及其并发症的治疗有很大作用[36]。
如表8所示,模型组大鼠较正常组大鼠,SOD、CAT和GSH-Px活力均显著降低(p<0.01),表明T2DM大鼠的氧化应激反应表现异常。灌胃6周后,与模型组相比,铁棍山药粗多糖组大鼠的CAT活力增加了363.36%、且GSH-Px活力增加了43.67%(p<0.01),而佛手山药粗多糖组大鼠的SOD和CAT水平分别增加了7.22%和69.76%(p<0.05)。
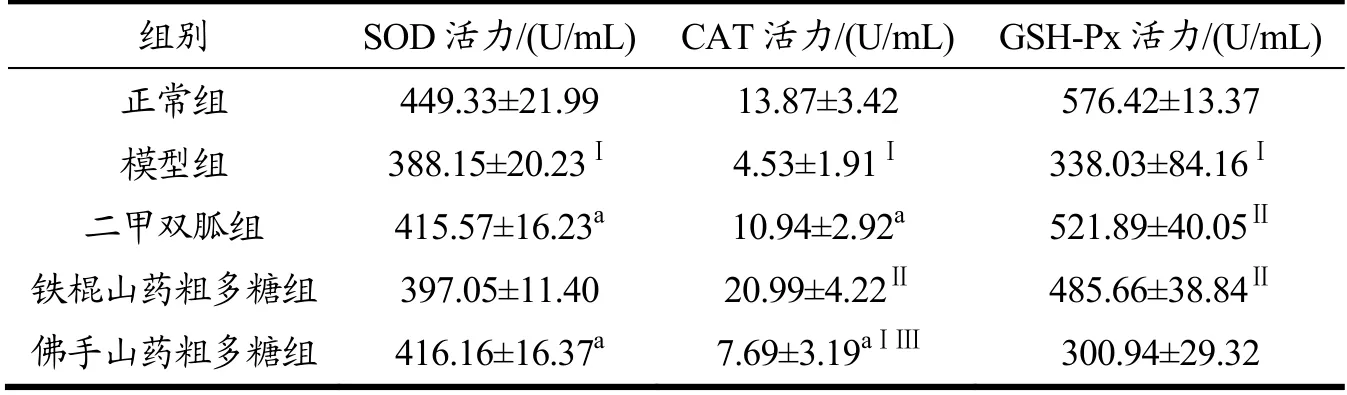
表8 铁棍山药粗多糖和佛手山药粗多糖对T2DM大鼠SOD、CAT及GSH-Px活力的影响Table 8 Effects of crude polysaccharides of iron stick yam and bergamot yam on the activities of SOD, CAT and GSH-Px in T2DM rats
3 结论
本研究表明,尽管两种山药粗多糖均可在一定程度上改善二型糖尿病,但二者发挥作用的具体机制有所不同。主要差别在于铁棍山药粗多糖在清除PTIO自由基(EC50=7869.17 µg/mL)、减少肝糖原分解(21.83%)、增强CAT(363.36%)和GSH-Px(43.67%)的活性方面更有优势,而佛手山药粗多糖则在清除DPPH自由基(EC50=16.19 µg/mL)、降低TG的含量(28.52%)、增强SOD(7.22%)与CAT(69.76%)的活性方面发挥更大作用。由于铁棍山药粗多糖和佛手山药粗多糖潜在的抗糖尿病特性以及在整个实验过程中没有表现出明显的副作用,因此可以合理地假设这两种山药粗多糖可能是临床上预防和治疗糖尿病的很有希望的候选药物。
