具有α-葡萄糖苷酶抑制活性的苦杏仁醇溶蛋白酶解物制备及稳定性表征
2022-04-28武安琪衣春敏赵学旭马培轩武蕊单良
武安琪,衣春敏,赵学旭,马培轩,武蕊,单良
(1.新疆农业大学食品科学与药学学院,新疆乌鲁木齐 830052)(2.江南大学食品学院,江苏无锡 214122)
糖尿病(Diabetes mellitus,DM)是一种由胰岛素代谢障碍或分泌不足引起的以血糖浓度偏高为特征的代谢性疾病[1],作为威胁人类健康的三大慢性疾病之一,糖尿病的患病人群已超过2亿,而我国是全球糖尿病患者人数最多的国家,因此,预防及治疗糖尿病已刻不容缓[2,3]。市面上现已存在阿卡波糖等降血糖药物,虽然治疗效果较好,但其存在着价格昂贵和有恶心呕吐的不良反应[4]。因此,许多具有生物亲和性的天然活性物质被用于治疗糖尿病,其中酶解制备生物活性肽是当前研究的热点。张灿等[5]利用木瓜蛋白酶对银杏蛋白进行酶解制备α-葡萄糖苷酶抑制肽,测得其抑制率为17.18%;邓艳群[6]采用复合酶酶解牡蛎,并进一步利用葡聚糖凝胶层析法对牡蛎肽进行分离纯化,测得其IC50值为20.62 mg/mL;李艳敏[7]利用碱性蛋白酶酶解裙带菜,在最佳工艺条件下制备的酶解肽IC50值为46.079 mg/mL。王晟等[8]利用木瓜蛋白酶对苦杏仁粗蛋白进行酶解制备α-葡萄糖苷酶抑制肽,该试验证明苦杏仁蛋白经酶解之后得到的肽具有降血糖活性,但抑制效果较低,IC50值仅为80 mg/mL。
有研究表明,疏水性氨基酸在许多具有降血糖功能活性的多肽中发挥较为显著的作用。袁晓晴[9]对癞葡萄蛋白及其酶解产物癞葡萄降血糖肽进行氨基酸检测,发现二者氨基酸组成差别不大,且都含有高比例的疏水性氨基酸。包美丽[10]通过对马鹿茸降血糖肽进行氨基酸序列分析得出,降血糖肽与氨基酸的疏水性可能有一定的关系。赵红星[11]对制备的大豆多肽进行了氨基酸分析,结果显示该多肽的疏水性氨基酸含量占比较高为27.57%,从而推断疏水性氨基酸对于多肽α-葡萄糖苷酶抑制活性有重要作用。因此,选用疏水性氨基酸含量高的原料制备降血糖肽具有重要意义。苦杏仁蛋白中疏水性氨基酸(丙氨酸、异亮氨酸、缬氨酸、亮氨酸、甲硫氨酸等)含量为9.374%[12-17],其主要存在于苦杏仁醇溶蛋白中[18,19],这些氨基酸的存在可能使得苦杏仁醇溶蛋白成为制备降血糖肽的良好原料。由此可见,提取苦杏仁醇溶蛋白进行酶解制备降血糖肽有望提高其降血糖活性。
因此,本研究以苦杏仁醇溶蛋白为原料、α-葡萄糖苷酶抑制率和水解度为评价指标,筛选适宜的蛋白酶,采用响应面法进行工艺优化,制备具有α-葡萄糖苷酶抑制活性的苦杏仁醇溶蛋白水解物,然后研究温度、pH和模拟胃肠道消化对制得α-葡萄糖苷酶抑制酶解物(AGIH)活性的影响,为开发和利用苦杏仁蛋白的降血糖肽提供试验依据。
1 材料与方法
1.1 材料与设备
苦杏仁,购自蔚县丰润农产品加工有限公司;木瓜蛋白酶(800 U/mg)、中性蛋白酶(100 U/mg)、碱性蛋白酶(200 U/mg)、风味蛋白酶(20 U/mg)、复合蛋白酶(120 U/mg)、菠萝蛋白酶(300 U/mg)、胃蛋白酶(1:15000)、胰蛋白酶(2.5 U/mg)、α-葡萄糖苷酶(25.4 U/mg)、4-硝基苯-α-D-吡喃葡萄糖苷(pNPG),均购自上海源叶生物科技有限公司;其余试剂均为分析纯。
DZKW-S-4恒温水浴锅,北京市永光明医疗仪器有限公司;TD5.5低速离心机,上海卢湘仪离心机仪器有限公司;TGL-16高速冷冻离心机,上海沪粤明科学仪器有限公司;THYS-15数控恒温槽,宁波天恒仪器厂;ST3100 pH计、e-G51HSRDM加热磁力搅拌器,奥克斯仪器(常州)有限公司;LCJ-10D冷冻干燥机,北京四环科学仪器厂有限公司;UV-1200紫外可见分光光度计,上海美谱达仪器有限公司;Multiskan GO全波长酶标仪,赛默飞世尔(上海)仪器有限公司。
1.2 实验方法
1.2.1 苦杏仁醇溶蛋白的制备
(1)脱脂脱苷苦杏仁粉的制备[20]。
(2)苦杏仁粗蛋白的制备,具体参考碱溶酸沉法[21]。
(3)醇溶蛋白的制备,具体参考Osborne方法[22]。
1.2.2α-葡萄糖苷酶活性抑制酶解物的制备工艺优化
1.2.2.1 蛋白酶的筛选
称取适量苦杏仁醇溶蛋白,配制成4.0%(m/V)的蛋白溶液。95 ℃加热10 min,后调节溶液的pH值和温度至所添加酶的最适酶解条件,加入一定量的酶,使酶/底物比值(E/S)为6000 U/g。整个酶解过程需维持恒定最适条件。最后将溶液pH值回调至7.0,沸水浴灭酶后高速离心(8000×g,15 min)取上清液(酶解产物),并以α-葡萄糖苷酶抑制率和水解度为评价指标,筛选最佳蛋白酶。每种蛋白酶的用量(加酶量以底物蛋白含量计)和反应的最适作用条件见表1。
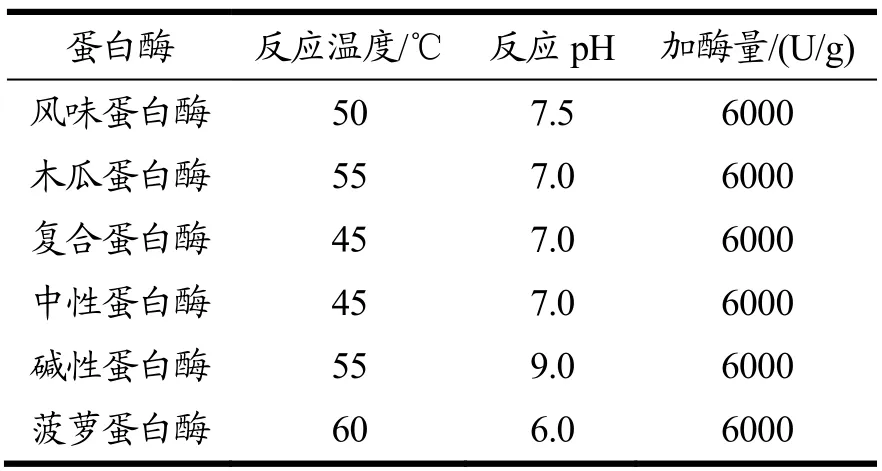
表1 不同蛋白酶的最适作用条件Table 1 Optimal enzymatic reaction conditions for various proteases
1.2.2.2 苦杏仁蛋白酶解单因素试验
选取上述最佳蛋白酶进行酶解,并选定温度、pH值、底物浓度、加酶量、酶解时间为单因素,以α-葡萄糖苷酶抑制率和水解度为评价指标,筛选最佳酶解条件。
1.2.2.3 苦杏仁蛋白酶解工艺优化
根据上述实验结果,选定酶解反应时间为6 h,并选取其余单因素变量进行Box-Behnken响应面实验设计,具体实验设计如表2所示,响应值为苦杏仁醇溶蛋白酶解产物的α-葡萄糖苷酶抑制率,分析各试验因素及交互作用对α-葡萄糖苷酶抑制率的影响,对酶解工艺进行优化。

表2 响应面试验设计因素水平表Table 2 Factors and levels in Box-Behnken experimental design
1.2.3 测定方法
(1)水解度的测定
采用pH-stat法进行水解度的测定[23]。
(2)α-葡萄糖苷酶活性抑制率的测定
参照Boath等[24]和Raju等[25]的测定方法,略加修改。用0.2 mol/L,pH 6.8的磷酸盐缓冲液将α-葡萄糖苷酶和D-吡喃葡萄糖苷(pNPG)分别配制成0.2 U/mL和1 mg/mL的溶液。移取50 μL磷酸盐缓冲液,50 μL pNPG溶液及50 μL酶解物溶液于96孔酶标板中,在37 ℃下孵育10 min,充分混合,然后再加入100 μLα-葡萄糖苷酶溶液启动反应,相同温度下继续孵育30 min,完成后终止此次酶解,所用到的溶液为150 μL 0.2 mol/L Na2CO3溶液。空白组用去离子水代替样品溶液,在405 nm波长下测定吸光值并记录。测定反应体系如表3所示。抑制率计算公式为:

表3 α-葡萄糖苷酶抑制率检测反应体系的组成Table 3 The composition of α-glycosidase inhibition testing system
式中:
A空白——空白组对应的吸光度值;
A样品——样品组对应的吸光度值。
(3)α-葡萄糖苷酶抑制酶解物的热稳定性表征
将AGIH配制成一定浓度的溶液,调节酶解物溶液的pH至7.0后进行加热保温30 min,加热温度分别是37、50、70、90、110、121 ℃,测定所采集反应液的α-葡萄糖苷酶抑制率,计算AGIH活性的保留率。
(4)α-葡萄糖苷酶抑制酶解物的酸碱稳定性表征
将AGIH溶液调节至不同的pH值(1.0、3.0、5.0、7.0、9.0和11.0),然后在室温下反应30 min,测定所采集反应液的α-葡萄糖苷酶抑制率,计算AGIH活性的保留率。
(5)α-葡萄糖苷酶抑制酶解物的体外消化稳定性表征
参考Wu等[26]的方法,根据试验情况略加调整。先将AGIH溶液的pH值调至2.0,温度调到37 ℃,添加一定量胃蛋白酶进行酶解反应,2 h后,胃模拟消化结束;随后将反应体系的pH调至7.0,添加一定量胰蛋白酶进行酶解反应,4 h后,肠道模拟消化结束,在95 ℃下进行灭酶,时间10 min,整个反应过程中每30 min采集一次反应液样品,测定所采集反应液的α-葡萄糖苷酶抑制率,计算AGIH活性的保留率。
1.2.4 数据处理
实验数据采用SPSS Statistics Base 20、Origin Pro 2019b、Design Expert 8.0.5进行分析处理。
2 结果与讨论
2.1 蛋白酶的筛选
由于不同蛋白酶的酶切作用方式及酶切位点不同,苦杏仁蛋白酶解产物对α-葡萄糖苷酶抑制率强弱也有很大的差异,短肽容易以完整的形式被吸收进入人体代谢循环中,从而其生物活性较容易保持[27]。蛋白的酶解效果与生成产物中肽链的长短直接相关[23],因而,要制备大量的小分子肽,就必须达到一定的酶解程度。此次筛选所用到的指标为α-葡萄糖苷酶抑制率和水解度,结果见图1。
本研究选取的6种蛋白酶均具有制备抑制α-葡萄糖苷酶活性酶解物的功效,其中木瓜蛋白酶催化水解产物的α-葡萄糖苷酶抑制率显著高于其它五种酶,抑制率为18.82%,其次是碱性蛋白酶催化水解产物,抑制率为13.42%;碱性蛋白酶的水解度显著高于其它五种酶为39.78%,木瓜蛋白酶位居第二,水解度为26.45%。因而,综合功能活性和水解效果,本研究选取木瓜蛋白酶作为最佳用酶。
2.2 单因素实验
2.2.1 pH对酶解产物抑制活性的影响
pH值在5.0~9.0范围内时,酶解产物的α-葡萄糖苷酶抑制率总体表现出先升高后降低的趋势。其中,在酸性条件下(pH 5.0~7.0),酶解产物的整体抑制效果随酸性的减弱而逐步增强,在中性条件下,抑制率达到最大值,而当pH值在7.0~9.0范围内时,抑制率显著降低(图2)。这种现象的原因可能是酸或碱环境会影响酶的活性和底物的构象[28],从而导致抑制率低。因而,pH 7.0为木瓜蛋白酶最佳酶解pH。
2.2.2 酶解温度对酶解产物抑制活性的影响
当温度在40~55 ℃之间时,酶解产物的α-葡萄糖苷酶抑制率与温度的升高呈正相关,并在55 ℃时达到最大值,继续升高温度则抑制率呈现下降趋势(图3)。可能是由于温度过高,酶分子吸收了过多的能量,使得维持酶分子结构的肽键断裂,导致酶的构型发生改变,进一步导致酶变性失活,从而影响了酶解速率[29]。因此,55 ℃为最适酶解温度。
2.2.3 酶解时间对酶解产物抑制活性的影响
整个反应阶段,酶解产物的α-葡萄糖苷酶的抑制活性呈现先逐渐升高,6 h时达到顶点值,随后降低的趋势,(图4)。在0~6 h时,蛋白酶不断切割目标肽键,隐藏于蛋白序列内部的活性肽段被逐步释放[30],因而,酶解产物所具备的抑制α-葡萄糖苷酶活性呈现逐步上升趋势。而在酶解6 h后,酶解产物的抑制效果显著性降低,原因可能是,酶解时间过长,原本具有功能活性的肽段受到了蛋白酶的进一步切割,从而破坏了肽序列的结构,进而导致了酶解产物的抑制活性大大降低。因此,6 h为最佳木瓜蛋白酶最佳酶解时间。
2.2.4 底物浓度对酶解产物抑制活性的影响
底物浓度在4.0%时,产物的抑制活性达到最高点,当底物浓度大于4.0%后,抑制率反而呈下降趋势(图5)。可能的原因是,在整个酶解体系中,木瓜蛋白酶添加量固定,当底物浓度过高时,酶的含量不足以与底物充分接触,进而无法发挥较高的酶切作用[28],甚至可能出现酶活性钝化的现象。因而,4.0%为最佳底物添加浓度。
2.2.5 加酶量对酶解产物抑制活性的影响
加酶量为6000 U/g时,酶解产物的抑制活性达到最高点,高于6000 U/g时,抑制活性反而下降(图6)。这可能是因为加酶量在过高时,生成的α-葡萄糖苷酶抑制酶解物被酶过度切割,从而导致酶解物的抑制活性降低。因此,选择最佳加酶量为6000 U/g。
2.3 酶解工艺条件优化
2.3.1 Box-Behnken试验结果
结合制备AGIH所筛选的试验结果,响应值为α-葡萄糖苷酶抑制率,对pH值、温度、加酶量和底物浓度进行考察,通过Box-Behnken试验进一步优化酶解条件,使其具备较高的制备效率和工业应用价值。具体试验方案及结果如表4所示。
2.3.2 Box-Behnken试验结果方差分析
利用Design expert软件对表4数据进行多元回归拟合,得到响应值Y对α-葡萄糖苷酶抑制率为响应关键因素的二次多项回归模型为:Y=17.85+0.30A-0.39 B+0.96C-0.39D-0.025AB+0.071AC+0.24AD-0.075BC-0.057BD-0.050CD-1.96A2-2.64B2-1.10C2-1.44D2
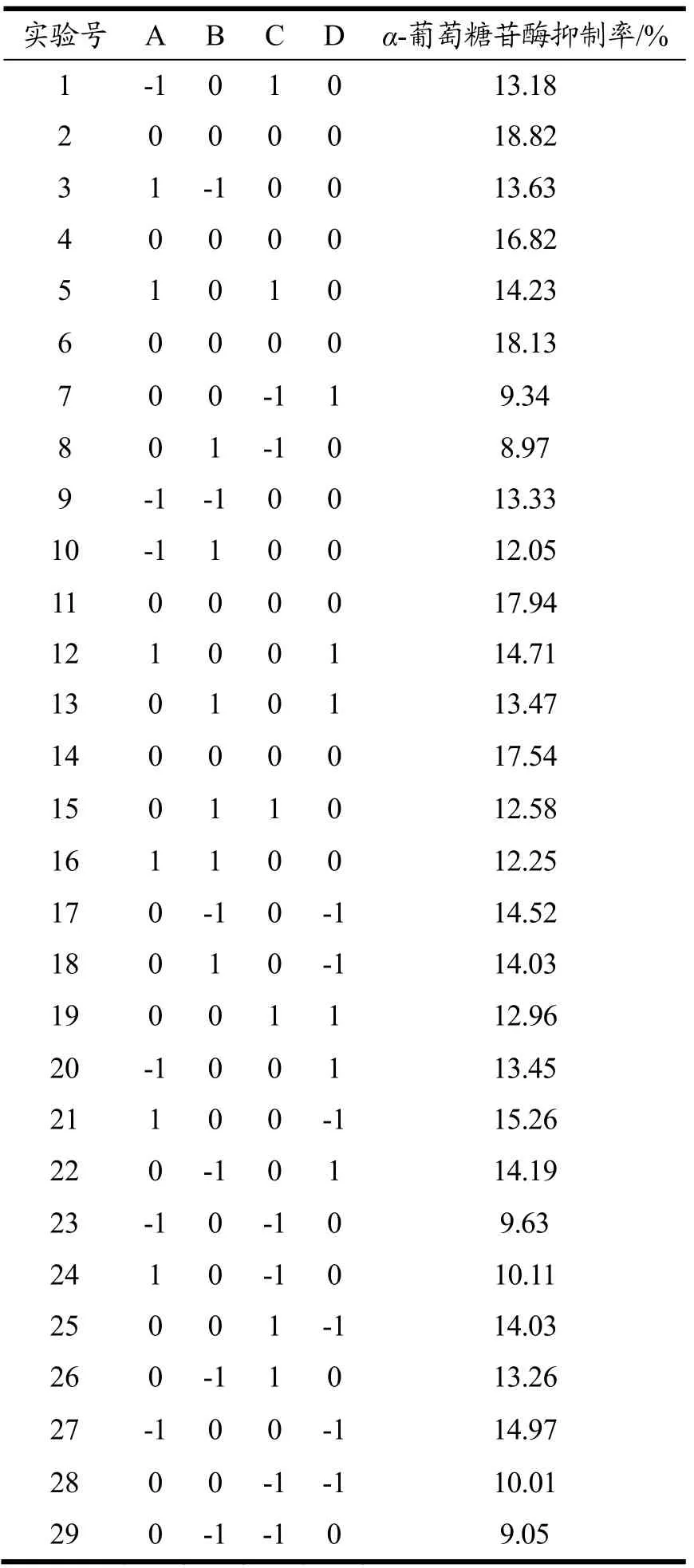
表4 Box-Behnken响应面分析试验设计及结果Table 4 The design and results of the Box-Behnken experiment
回归模型方差分析结果如表5所示。该回归方程的决定系数为0.9481,表明采用该回归模型能够反映整个酶解过程中94.81%的变化,因而该回归模型具有较高的准确度。且p<0.0001,表明该模型是极显著的。一次项中,C影响极显著,B、D影响显著,二次项中,A2、B2、C2、D2影响极显著,而交互项的影响相对较小。各因素对酶解所得AGIH的活性影响的大小各不相同,具体表现为:XC>XD>XB>XA,即加酶量>底物浓度>温度>pH。

表5 回归模型方差分析Table 5 Significance test of the regression model
2.3.3 响应面分析及最佳酶解工艺条件的确定
酶解产物的α-葡萄糖苷酶活性抑制率对pH(A)、温度(B)、加酶量(C)、底物浓度(D)的响应见图7~图12。
利用Design Expert 8.0.5软件对工艺条件进行优化,得到的苦杏仁AGIH的最佳酶解条件为:底物浓度3.73%,加酶量6447.15 U/g,pH 7.08,温度54.61 ℃;在此条件下,产物抑制活性的预测值为18.12%。实际操作过程中酶解设备往往不具备极高的分辨度,因而将上述最佳工艺条件修正为:底物浓度4.0%,加酶量6000 U/g,pH 7.0,温度55 ℃。通过多次平行实验对其结果进行验证,得出酶解产物的α-葡萄糖苷酶活性抑制率为18.10%,与模拟预测值十分接近。将此条件下得到的酶解液冻干复配后,测得其IC50值为17.66 mg/mL。王晟等[8]利用木瓜蛋白酶酶解山杏仁蛋白同样制得了α-葡萄糖苷酶抑制酶解物,其抑制率和IC50值分别为14.22%、80 mg/mL,与本研究相比,抑制率低3.90%、IC50值高62.34 mg/mL,可见,本研究制备的AGIH具有更高的抑制活性。
2.4 α-葡萄糖苷酶抑制酶解物的稳定性分析
2.4.1 热稳定性
当将酶解液置于37 ℃环境时,AGIH的抑制活性的保留率为97.89%,当环境温度为50、70、90、121 ℃时,AGIH活性有所降低,且温度越高,抑制率越低,最低的为121 ℃,但此时AGIH的抑制活性的保留率为90.17%(图13),表明AGIH有较好的热稳定性。
2.4.2 pH稳定性
当酶解液的pH值为7.0时,AGIH的抑制率几乎保持不变,抑制活性高保留率为98.80%(图14)。而在pH 1.0和pH 11.0时,AGIH的抑制效果最低,保留率分别为81.45%和83.02%。可见,强酸和强碱条件会在一定程度上破坏酶解物的功能活性,甚至使酶解物结构发生降解[31]。而AGIH的活性在pH 3.0~9.0范围内较为稳定,表明AGIH具有较好的pH稳定性。
2.4.3 体外模拟胃肠道消化稳定性
在模拟消化过程中,AGIH对α-葡萄糖苷酶的抑制效果会发生一定程度的改变。在模拟胃阶段时,AGIH的抑制活性保留率为75.29%,而在模拟肠道阶段时,AGIH的抑制活性保留率有所上升,为原来的82.24%(图15)。这说明酶解物在这两种酶的作用下一定程度上被降解[32,33],在胃消化后,可能产生了一些新的活性酶解物,这些酶解物具有较高的α-葡萄糖苷酶活性,因此在进入肠道消化后,抑制率有所上升。因此,可以认为AGIH可以抗胃肠道消化。
3 结论
基于苦杏仁醇溶蛋白制备α-葡萄糖苷酶抑制酶解物的最佳工艺条件为:底物浓度4.0%(m/V),加酶量6000 U/g,酶解温度55 ℃,酶解pH 7.0,酶解时间6 h。此时得到的AGIH的抑制率为18.10%,IC50值为17.66 mg/mL。AGIH在极端高温、低pH、高pH或胃肠道模拟消化条件下,其抑制活性保留率较高,具有较好的稳定性。本研究制备的苦杏仁酶解物因其α-葡萄糖苷酶活性抑制作用,通过后续分离纯化、结构鉴定、功效学评价,可望在天然降血糖保健食品或者药物开发方面得到应用。
