高产糖苷酶非酿酒酵母菌株筛选、鉴定及其发酵过程中酶活性变化
2022-10-31任学梅姚红红严幻汝杨学山
任学梅,姚红红,严幻汝,祝 霞,2,杨学山,2,
(1.甘肃农业大学食品科学与工程学院,甘肃 兰州 730070;2.甘肃省葡萄与葡萄酒工程学重点实验室,甘肃 兰州 730070)
源自葡萄果实的香叶醇、芳樟醇、-松油醇等挥发性单萜类物质,具有多种花香和水果气息,是决定干白葡萄酒品种香气特征的关键性化合物。但它们多以无味的糖苷键合态香气前体形式存在,其中双糖苷约占80%以上,其次为单糖苷形式(约10%),三糖苷含量最低。键合态前体物可在发酵过程中由--葡萄糖苷酶(EC 3.2.1.21)和其他糖苷酶的协同作用下水解释放。在葡萄酒酿造过程中添加外源性--葡萄糖苷酶可能引发非特异性水解反应或形成不良风味,而使用可以分泌--葡萄糖苷酶的酵母菌作为发酵剂,能引发键合态品种香气物质的充分释放,提升葡萄酒的区域典型性和感官复杂性。与酿酒酵母()不同,一些非酿酒酵母(non-)菌株可以分泌高活性的--木糖苷酶(EC 3.2.1.37)、--阿拉伯呋喃糖苷酶(EC 3.2.1.55)和--鼠李糖苷酶(EC 3.2.1.40),先裂解双糖苷键生成相应的单萜基--葡萄糖苷,再通过--葡萄糖苷酶的作用释放单萜,从而提高葡萄酒品种的香气和风味。López等筛选出高产--葡萄糖苷酶和--木糖苷酶酵母菌株,通过酿酒实验发现,接种优选非酿酒酵母进行发酵,总萜烯含量增加1.1~1.3 倍,Padilla等研究发现,由于--葡萄糖苷酶的活性,接种菌株增加了-松油醇、香叶醇和橙花醇的浓度。总体而言,现在大部分研究主要集中在非酿酒酵母菌株分泌的--葡萄糖苷酶活性对葡萄酒香气复杂性的影响,然而对菌株的双糖苷酶活性,特别是发酵过程中酶活性的菌株差异探究还十分欠缺。
本实验从宁夏贺兰山东麓葡萄酒产区自然发酵葡萄汁中分离酵母菌株,以WL培养基和七叶苷培养基初步评价非酿酒酵母菌株的--葡萄糖苷酶活性,再通过对硝基苯酚(-nitrophenol,-NP)法定量测定并筛选双糖苷酶活性较高的菌株;利用模拟干白葡萄酒发酵体系,评估优选本土非酿酒酵母菌株在模拟葡萄汁发酵过程中酶活性动态变化。本实验旨在获得酿造适应性优良的高产糖苷酶非酿酒酵母菌株,为进一步提升葡萄酒香气品质提供技术支持。
1 材料与方法
1.1 材料与试剂
1.1.1 葡萄样品与商业酵母
葡萄样品均采自宁夏贺兰山东麓不同葡萄酒产区。采自闽宁立兰酒庄的霞多丽、赤霞珠,还原糖质量浓度分别为243.06、241.52 g/L,pH值分别为3.91、3.74,可滴定酸质量浓度(以酒石酸计)分别为5.15、5.81 g/L;采自青铜峡西鸽酒庄的霞多丽、赤霞珠,还原糖质量浓度分别为246.37、234.42 g/L,pH值分别为3.86、3.94,可滴定酸质量浓度分别为5.64、5.09 g/L;采自甘城子古城人家酒庄的赤霞珠,还原糖质量浓度为236.21 g/L,pH值为3.89,可滴定酸度质量浓度为5.71 g/L。
346商业非酿酒酵母 法国Lallema公司。
1.1.2 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:2%葡萄糖、2%蛋白胨、1%酵母浸粉、2%琼脂,自然pH值(5.4),121 ℃灭菌20 min。
WL培养基购自北京奥博星生物技术有限责任公司。称取80.25 g WL培养基,加入1 000 mL蒸馏水中,加热煮沸溶解,分装,121 ℃高压灭菌20 min,pH 5.5±0.2。
赖氨酸培养基购自青岛日水生物技术有限公司。称取66.3 g赖氨酸培养基于1 L含8.4 mL乳酸钾的蒸馏水中,用乳酸调节pH值(pH 5.0±0.2),121 ℃灭菌20 min。
七叶苷筛选培养基:0.3%七叶苷、0.05%柠檬酸铁、0.2% NaCl、0.05% MgSO·7HO、0.1% KHPO,121 ℃灭菌20 min。
发酵培养基:1%吐温80、1%酵母浸粉、2%蛋白胨、2%葡萄糖、0.3%硝酸铵、0.05% MgSO·7HO、0.4% KHPO。
模拟葡萄汁:240 g/L葡萄糖、1.5 g/L酵母浸粉、0.3 g/L柠檬酸、5 g/L酒石酸、5 g/L-苹果酸、2 g/L(NH)SO、5 g/L KHPO、0.4 g/L MgSO、0.2 g/L NaCl、0.05 g/L MnSO、50 mg/L SO,用0.5 mol/L NaOH调pH值至3.2,121 ℃灭菌20 min。
1.1.3 试剂
七叶苷、NP、对硝基苯基---葡萄糖苷(-nitrophenyl---glucopyranoside,NPG)、对硝基苯基---鼠李糖苷(-nitrophenyl--rhamnopyranoside,NP-Rha)、对硝基苯基---阿拉伯糖苷(-nitrophenyl---arabinopyranoside,NPAra)、对硝基苯基---木糖苷(-nitrophenyl--xylopyranoside,NP-Xyl) 上海源叶生物科技有限公司;酵母浸粉、蛋白胨 北京奥博星生物技术有限责任公司。
1.2 仪器与设备
SW-CJ-2FD超净工作台 苏州安泰空气技术有限公司;500051S立式高压灭菌锅 上海申安医疗器械厂;SPX-300-II生化培养箱 上海跃进器械医疗有限公司;H2050R高速冷冻离心机 长沙湘仪离心机仪器有限公司;Genesis 10S紫外-可见分光光度计 美国赛默飞世尔科技公司;9700型聚合酶链式反应(polymerase chain reaction,PCR)扩增仪 美国ABI Veriti公司。
1.3 方法
1.3.1 葡萄汁自然发酵过程中还原糖测定及酵母菌株的分离纯化
自然发酵:在葡萄成熟期采收葡萄并运回实验室。无菌状态下将新鲜成熟度好的葡萄破碎,装入5 L无菌发酵罐中,添加30 mg/L SO,进行自然发酵。霞多丽葡萄于20 ℃发酵,赤霞珠葡萄于25 ℃发酵,每天定期摇瓶2 次。
于不同发酵时期(2、4、6、8、11、15 d)定时取样,利用梯度稀释涂布平板法,依次稀释6 个梯度,振荡摇匀后吸取100 μL 3 个梯度(10、10、10)稀释液涂布于WL培养基,28 ℃培养5 d,每个梯度做3 个重复。
菌株分离与纯化:根据WL固体培养基菌落的颜色及形态,对菌株进行初步区分,分别放在40%的灭菌甘油中,于-80 ℃保存备用,用于后续实验。
参考GB/T 15038—2006《葡萄酒、果酒通用分析方法》测定不同发酵时期葡萄汁的还原糖含量。
1.3.2 菌株产--葡萄糖苷酶定性筛选
将200 μL灭菌的七叶苷培养基添加到96 孔培养板中,接入20 μL活化后的供试菌液,于28 ℃培养24 h。按照显色等级测定供试菌株产--葡萄糖苷酶的活性,深黑色记为“++++”表示最高酶活性,黑色记为“+++”表示中酶活性,深灰色记为“++”表示低酶活性。
1.3.3 糖苷酶活性定量测定
1.3.3.1--葡萄糖苷酶活性测定
参考钱超方法绘制NP标准曲线,以NP浓度为横坐标,吸光度为纵坐标。
参考López等方法测定酶活性并略作修改。供试菌株在YPD培养基培养48 h后,按5%的接种量接种于发酵培养基中,200 r/min、28 ℃下摇床培养72 h。取5 mL发酵液于离心管中,8 000 r/min、4 ℃离心10 min,取上清液,即得粗酶液。取0.5 mL粗酶液、1.2 mL pH 5.0柠檬酸-磷酸缓冲液(含0.1 mol/L柠檬酸和0.2 mol/L磷酸氢二钠)、0.25 mL 5 mmol/L-NPG混合,于50 ℃培养30 min,加入1 mL 1 mol/L NaCO终止反应,在400 nm波长处测定吸光度。对照组为未进行反应的样品。
根据标准曲线计算最终酶活性。酶活性单位(U)定义为pH 5.0、50 ℃条件下,1 min水解-NPG产生1 μmol-NP所需的酶量。
1.3.3.2 双糖苷酶活性定量测定
参考López等方法,并略作修改。取0.25 mL粗酶液,0.6 mL柠檬酸-磷酸缓冲液(0.1 mol/L柠檬酸和0.2 mol/L磷酸氢二钠,pH 5.0),分别与0.13 mLNP-Rha、NP-Ara、NP-Xyl(5 mmol/L)混合后,于50 ℃反应30 min,加入1 mL 0.5 mol/L NaCO终止反应,在400 nm波长处测定吸光度。对照组为未进行反应的样品。
根据标准曲线计算最终酶活性。酶活性单位(U)定义为pH 5.0、50 ℃条件下,1 min水解NP-Rha、NPAra、NP-Xyl产生1 μmol-NP所需酶量。
1.3.4 菌株的分子生物学鉴定
参考田进等方法,并略作修改,提取基因组DNA,并进行PCR扩增及测序。
1.3.5 优选非酿酒酵母在模拟葡萄汁发酵中发酵动力学及糖苷酶活性动态变化
1.3.5.1 模拟葡萄汁发酵过程中发酵动力学
在20 mL固相微萃取(solid-phase micro-extraction,SPME)小瓶中进行纯菌种微规模发酵(3 个独立的重复),发酵小瓶中含有16 mL模拟葡萄汁。将6 株优选非酿酒酵母、、3 株、于YPD液体培养基活化,以1×10CFU/mL接种量接种。用顶部装有穿孔硅塞和一次性注射器针头密封小瓶,并在20 ℃下进行发酵。通过质量减轻监测发酵过程,如果连续3 d没有观察到进一步的质量减轻,则发酵被评估为“停滞”。每天通过测定CO释放造成的瓶子质量损失监测发酵动力学。
1.3.5.2 模拟葡萄汁发酵过程中糖苷酶活性测定
选择产酶性能较好的6 株非酿酒酵母菌株,按1×10CFU/mL接种量接种于500 mL含有400 mL模拟葡萄汁的锥形瓶,以商业非酿酒酵母346做对照,于20 ℃恒温发酵。每天监测各发酵液--葡萄糖苷酶、--木糖苷酶、--鼠李糖苷酶、--阿拉伯糖苷酶的活性变化,酶活性测定参考1.3.3节的方法进行。
1.4 数据处理
采用Excel 2010、Origin 2018软件对实验数据进行处理和作图,利用Tbtools v1.09876软件对酶活性测定结果进行聚类分析并绘制热图。
2 结果与分析
2.1 葡萄汁自然发酵期间还原糖变化和WL培养基形态鉴定
由图1可知,随着发酵时间的延长,来自宁夏贺兰山东麓不同葡萄酒产区的霞多丽和赤霞珠葡萄汁在自然发酵条件下还原糖质量浓度逐渐降低;且发酵15 d,霞多丽和赤霞珠葡萄汁均在本土菌株的作用下,顺利完成自然发酵(还原糖质量浓度≤4 g/L)。

图1 不同发酵时期霞多丽(A)和赤霞珠(B)葡萄发酵醪液还原糖变化Fig.1 Changes in reducing sugar in fermented must as a function of fermentation time
根据不同酵母菌株在WL营养琼脂培养基上的形态和颜色,对其进行初步区分。如图2所示,将分离的酵母菌株分为20 类。每一类别随机挑取15~20 株具有代表性的单菌落,共计分离并收集821 株酵母菌株。发酵前期(1~4 d)主要以和发挥主导作用,发酵中期(5~8 d)酵母多样性增加,出现、、、等酵母菌株,随着发酵的进行,酵母菌株的多样性降低,逐渐占据主导地位,完成后续乙醇发酵。
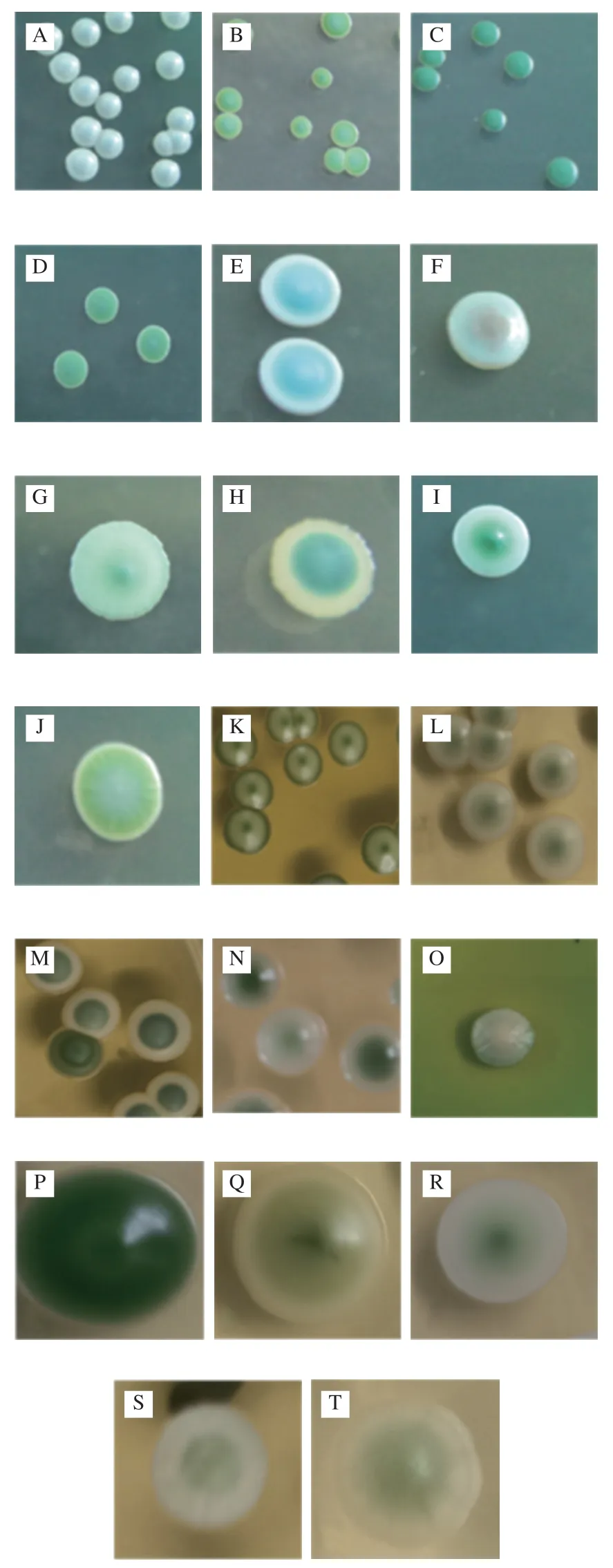
图2 自然发酵液中分离得到的酵母菌在WL培养基上的形态Fig.2 Colonial morphology of yeasts isolated from spontaneously fermented grape must on WL medium
2.2 酵母菌株产β-葡萄糖苷酶定性筛选分析
酵母菌株可以水解糖苷配基和低聚糖之间的-糖苷键,其中起作用的第一类酶是--鼠李糖苷酶、--阿拉伯糖苷酶等双糖苷酶;随后,--葡萄糖苷酶作用于--葡萄糖苷释放葡萄糖和芳香糖苷配基。因此,--葡萄糖苷酶是芳香配基释放的重要限止因子。将保存备用的821 株酵母菌株活化,以七叶苷为底物,通过显色反应对酵母菌株产--葡萄糖苷酶水平进行筛选。如图3所示,将96 孔板中显色较深的菌株挑选出在赖氨酸培养基划线培养,能够在赖氨酸培养基上生长的菌株为非酿酒酵母,共从821 株酵母菌株中分离出120 株--葡萄糖苷酶活性较高的非酿酒酵母。
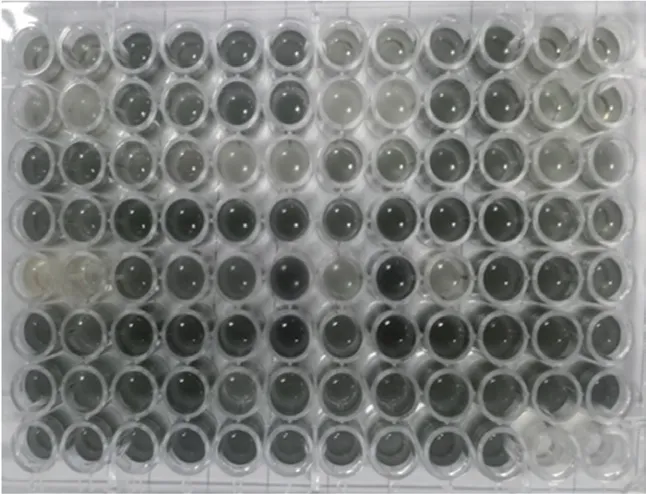
图3 96 孔板初筛显色结果Fig.3 Chromogenic results of primary screening in 96-well plates
为进一步利用七叶苷培养基筛选出高产糖苷酶的非酿酒酵母菌株,将培养时间从48 h降低为24 h,对前期筛选出的120 株酵母菌株进行再次筛选培养。观察七叶苷培养基显色程度,对120 株酵母菌株产--葡萄糖苷酶能力进行具体划分。由表1可知,分离自赤霞珠葡萄产-葡萄糖苷酶的供试菌株共75 株。其中,闽宁立兰酒庄无高产--葡萄糖苷酶的菌株;青铜峡西鸽酒庄高产--葡萄糖苷酶的菌株有4 株,中产5 株,低产10 株;甘城子古城人家酒庄有3 株高产--葡萄糖苷酶的菌株,中产菌株4 株,低产菌株21 株。第2天取样,产--葡萄糖苷酶菌株总数为20 株;取样第4天,产--葡萄糖苷酶菌株数为30 株;第6、8、11天取样,产--葡萄糖苷酶菌株数分别为14、6、5 株。综上所述,相比于闽宁立兰酒庄,青铜峡西鸽酒庄与甘城子古城人家酒庄分离菌株--葡萄糖苷酶活性较高;在第4天取样,分离菌株产--葡萄糖苷酶的能力最强。
由表1可知,自霞多丽葡萄分离的菌株中,共筛选出45 株--葡萄糖苷酶活性较高的菌株。闽宁立兰酒庄高产-葡萄糖苷酶的菌株有1 株,中产菌株9 株,低产菌株12 株;青铜峡西鸽酒庄高产--葡萄糖苷酶的菌株有2 株,中产10 株,低产11 株。第2天取样,产--葡萄糖苷酶菌株总数为11 株;第4天取样,产--葡萄糖苷酶的菌株总数为22 株;第6天取样,产--葡萄糖苷酶的菌株总数为3 株;第8、15天取样,产--葡萄糖苷酶的菌株总数分别为6、3 株。综上所述,闽宁立兰酒庄与青铜峡西鸽酒庄-葡萄糖苷酶水平差距相对较小,第4、6天取样,菌株产--葡萄糖苷酶能力较强。
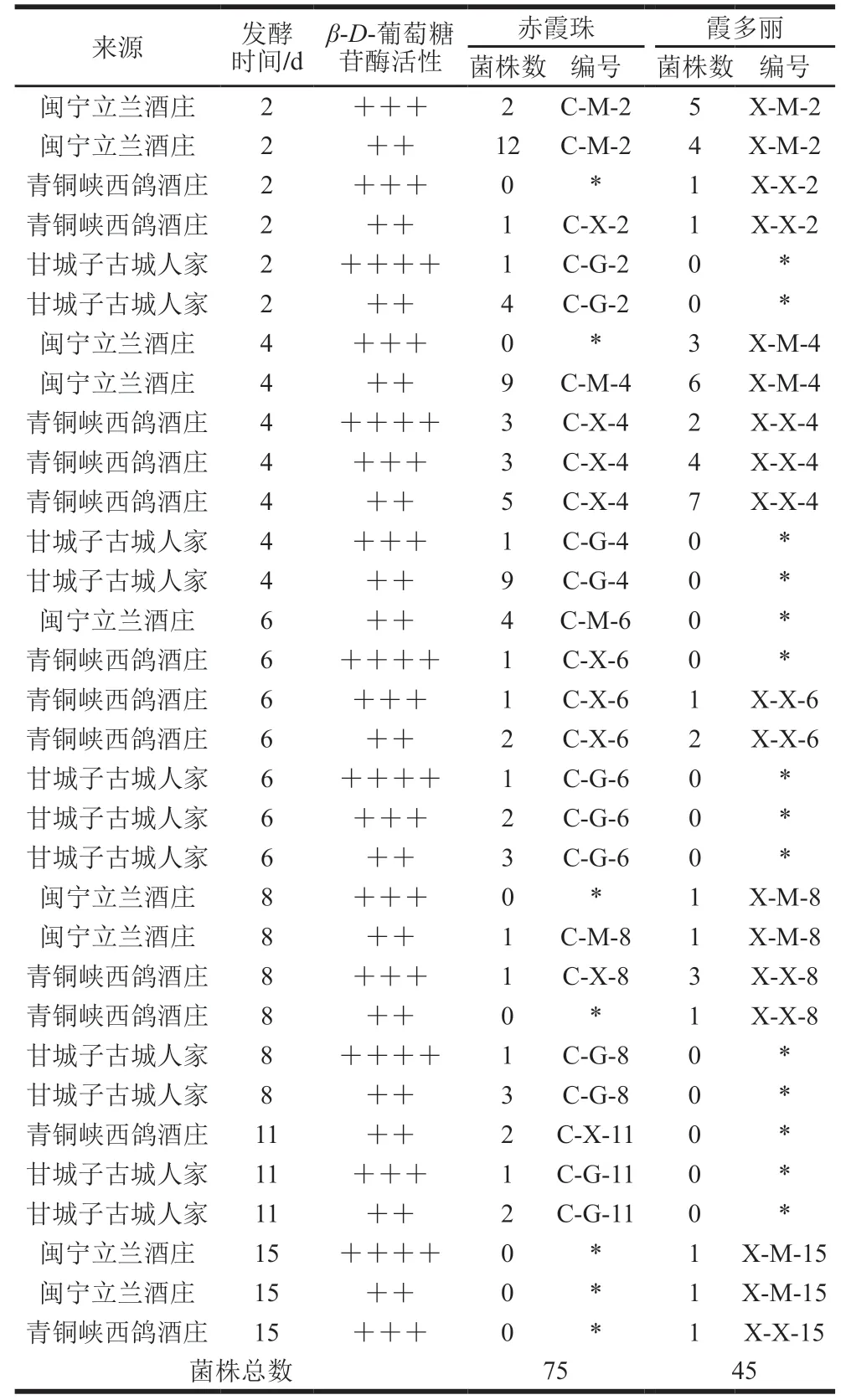
表1 分离自不同产区赤霞珠、霞多丽产β-D-葡萄糖苷酶酵母菌株初筛结果Table 1 β-D-Glucosinase-producing capacity of yeast strains isolated from Cabernet Sauvignon and Chardonnay from different production areas
2.3 酵母菌株糖苷酶活性定量分析
采用-NP半定量比色法评估了41 株本土非酿酒酵母菌株和1株商业346糖苷酶活性。根据标准曲线=0.009 0+0.086 7(相关系数为0.999 5),计算最终酶活性。研究表明,非酿酒酵母在发酵前期能够产生较多的胞外水解酶,提高最终产品的感官特性,但具有很强的菌株依赖性。以商业346为对照,对供试菌株糖苷酶粗提取液中--葡萄糖苷酶、--阿拉伯糖苷酶、--鼠李糖苷酶、--木糖苷酶活性进行测定。如图4所示,菌株C-X-4-1(49.669 mU/mL)、X-M-8-1(20.067 mU/mL)、C-X-6-3(19.091 mU/mL)、C-X-4-7(20.278 mU/mL)、X-X-15-1(17.889 mU/mL)、X-X-4-5(18.473 mU/mL)产--葡萄糖苷酶活性较高;高产--木糖苷酶菌株有C-X-4-1(28.450 mU/mL)、C-X-2-4(23.383 mU/mL)、X-X-15-1(30.884 mU/mL)、X-X-4-5(28.850 mU/mL)、C-X-6-3(38.953 mU/mL)、X-M-8-1(32.048 mU/mL)、C-X-4-7(26.366 mU/mL)、X-M-2-6(32.048 mU/mL)、X-M-2-4(26.366 mU/mL)。少数菌株对所有底物都具有高活性,这一事实证明了菌株选择的重要性,如菌株C-X-4-1、X-M-8-1、C-X-4-7、C-X-6-3、X-M-2-6、X-M-2-4等产--木糖苷酶、--鼠李糖苷酶、--阿拉伯糖苷酶活性均表现出较高水平。综合考虑酵母菌株4 种糖苷酶活性,筛选出菌株C-X-4-1、X-M-8-1、X-M-2-6、X-M-2-4、C-X-6-3、C-X-4-7,且这6 株菌株产--葡萄糖苷酶、--阿拉伯糖苷酶、--鼠李糖苷酶、--木糖苷酶活性均高于对照菌株。将这6 株菌株用于后续实验。

图4 本土酵母菌株粗酶液糖苷酶活性热图聚类分析Fig.4 Cluster analysis of glycosidase activity in crude enzyme solutions of native yeast strains
2.4 酵母菌株的分子生物学鉴定
通过对上述筛选的6 株非酿酒酵母进行DNA提取及26S rDNA基因PCR扩增,将纯化后的PCR产物进行上机检测,测序结果进行对比分析。在GenBank数据库中与已发表的26S rDNA的D1/D2区域序列进行同源性比较,构建系统发育树。如图5所示,包括3 个属的4 个种,分别为(X-M-8-1)、(X-M-2-6)、(C-X-4-1、C-X-6-3、X-M-2-4)、(C-X-4-7)。

图5 基于26S rDNA序列的酵母菌株的系统发育树Fig.5 Phylogenetic tree based on 26S rDNA sequences of the yeast strains
2.5 模拟葡萄汁发酵过程中发酵动力学与糖苷酶活性分析
2.5.1 模拟葡萄汁发酵过程中发酵动力学分析
选择6 株非酿酒酵母分离菌株,分别为、、3 株、,以商业346为对照,在模拟葡萄汁中进行纯菌种发酵。发酵过程中质量损失如图6所示,菌株CO质量损失最大,即发酵能力最强;其次,-2和-3也表现出较好的发酵能力;但所有菌株几乎均在17 d出现发酵停滞。
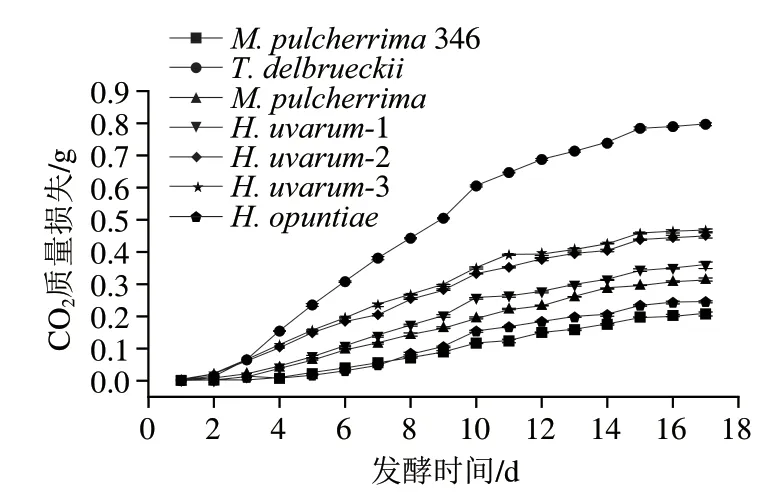
图6 模拟葡萄汁乙醇发酵过程中CO2质量损失Fig.6 CO2 loss in synthetic grape must during alcoholic fermentation
2.5.2 模拟葡萄汁发酵过程中糖苷酶活性分析
为了在乙醇发酵过程中利用非酿酒酵母的糖苷酶活性,需了解在真实葡萄酒条件下这些酶活性的动态变化。由图7可知,不同非酿酒酵母发酵时,糖苷酶活性变化趋势大致相同;在发酵8~11 d酶活性达到最大值,随后逐渐下降,直至发酵结束。但不同菌株处理间,酶活性水平表现出一定差异。在葡萄糖质量浓度240 g/L、SO质量浓度50 mg/L、pH 3.2、发酵温度20 ℃条件下,供试菌株的--葡萄糖苷酶和双糖苷酶(--木糖苷酶、--鼠李糖苷酶、--阿拉伯糖苷酶)活性分别在10(16.512 mU/mL)、9(9.574 mU/mL)、11(14.366 mU/mL)、9 d(11.735 mU/mL)达到最大,且明显高于其他菌株。对照菌株346的糖苷酶活性相对较低,尤其是--葡萄糖苷酶、--木糖苷酶、--阿拉伯糖苷酶。
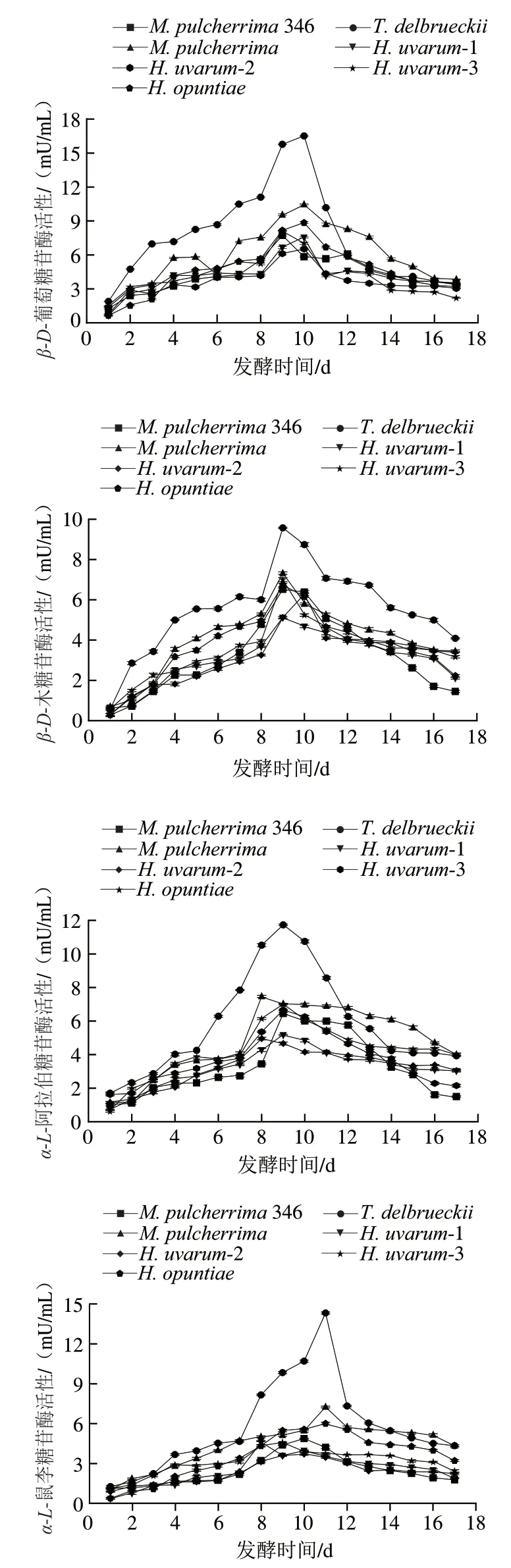
图7 模拟葡萄汁乙醇发酵过程中糖苷酶活性变化Fig.7 Evolution of glycosidase activity in synthetic grape must during alcoholic fermentation
供试非酿酒酵母菌株--葡萄糖苷酶、--木糖苷酶、--鼠李糖苷酶、--阿拉伯糖苷酶累积酶活性如图8所示。、、1、2、3、、346菌株发酵过程中糖苷酶的总累积活性之间具有显著差异(<0.05),分别为419.353、326.945、246.144、256.668、216.20、213.88、224.48 mU/mL,且、、1、2这4 株菌株的总累积活性显著高于对照(224.48 mU/mL)(<0.05)。7 个非酿酒酵母菌株处理中,--葡萄糖苷酶累积活性(127.70 mU/mL)>(101.44 mU/mL)>(78.76 mU/mL)>346(72.51 mU/mL)>3(70.15 mU/mL)>1(69.23 mU/mL)>2(62.06 mU/mL);--阿拉伯糖苷酶累积活性(99.04 mU/mL)>(81.48 mU/mL)>(71.28 mU/mL)>3(62.72 mU/mL)>2(55.36 mU/mL)>346(55.31 mU/mL)>1(54.32 mU/mL);不同菌株--木糖苷酶和--鼠李糖苷酶累积活性与--阿拉伯糖苷酶变化趋势相同。

图8 模拟葡萄汁乙醇发酵过程中糖苷酶累积活性Fig.8 Evolution of glycosidase accumulation in synthetic grape must during alcoholic fermentation
3 讨论
在葡萄汁中接种酿酒酵母进行乙醇发酵是世界各地酿酒企业的普遍做法。然而越来越多的研究发现酿酒葡萄表面的一些特定种属的非酿酒酵母菌株,可以合成和分泌胞外糖苷酶,是提高葡萄酒复杂性和区域特色的良好助剂。同时,胞外糖苷酶的活性因酵母种类的不同而差异显著,有些菌株可能根本不产生这种酶。因此,分离筛选高产糖苷酶的非酿酒酵母菌株是提高葡萄酒感官复杂性的重要手段。Escribano等采用API-ZYM半定量测试系统,筛选了酵母菌株酯酶、酯酶-脂肪酶、脂肪酶--葡萄糖苷酶活性。Hong Mengnan等分别以熊果苷和木聚糖为底物,对分离自冰葡萄汁的酵母菌株的--葡萄糖苷和--木糖苷酶进行定性分析,共鉴定出11 株产香性能优的非酿酒酵母。本研究采用七叶苷培养基96 孔板半定量显色法初步筛选高产--葡萄糖苷酶的非酿酒酵母,获得了6 株高产--葡萄糖苷酶及双糖苷酶的酵母菌株,为葡萄酒的增香酿造奠定了基础。
在葡萄酒中,一些次级代谢产物以游离或结合态存在,后者可在酵母菌分泌酶的作用下被水解。糖苷酶,特别是--葡萄糖苷酶和--木糖苷酶、--鼠李糖苷酶和--阿拉伯糖苷酶等,参与单萜前体物质的水解释放。虽然一些酿酒酵母菌株产生--葡萄糖苷酶,但一些非酿酒酵母菌株分泌的糖苷酶活性更高。前人研究发现,、、、和的菌株能分泌--葡萄糖苷酶。本研究也发现,、、、等菌株均表现出较高的--葡萄糖苷酶活性。酵母菌株糖苷酶活性分布情况不仅在酿酒酵母与非酿酒酵母之间存在差异,而且不同非酿酒酵母之间也存在多样性。Escribano等在对97 株非酿酒酵母菌株酶活性的分析中发现,具有-葡萄糖苷酶活性的菌株比例最高(63%),其次是sp(60%),其他多数酵母则没有或仅有极少比例的菌株具有该酶活性。Bokulich等研究发现葡萄酒酵母产生--木糖苷酶的能力非常罕见,目前仅在、、、和中发现。Manzanares和Zott等研究发现和具有较高水平的--鼠李糖苷酶、--阿拉伯糖苷酶活性。Cordero-Bueso等研究发现,表现出--木糖苷酶、--鼠李糖苷酶、--阿拉伯糖苷酶活性。本研究中,、和表现出较高--木糖苷酶活性,而346则表现出相对较低的活性。同时,的--鼠李糖苷酶、--阿拉伯糖苷酶活性与其他菌株也具有差异显著性(<0.05)。
研究酿酒过程中酶活性的演替变化对葡萄酒香气品质调控非常重要,因为它们的水平在整个过程中不一定是恒定的。本实验发现糖苷酶活性与乙醇发酵过程酵母菌的生长密切相关,在8~12 d,CO质量损失的变化量达到最大,而不同菌株糖苷酶活性也分别在此发酵阶段达到最大值,这与发酵动力学结果一致。Maturano等研究发现,酶活性的最高水平与生物量有关,并在生物量下降之前检测到最大值。接种时,模拟葡萄汁pH 3.2,葡萄糖质量浓度240 mg/L、SO质量浓度50 mg/L,20 ℃恒温发酵,大部分菌株均能正常生长,且表现出较好的糖苷酶活性水平。López等研究发现非酿酒酵母分泌的一些胞外酶,可以耐受葡萄酒的酿造条件,如低pH值、低温、高糖或乙醇。有研究发现大部分菌株能产生--葡萄糖苷酶、-鼠李糖苷酶和--阿拉伯糖苷酶,其中以--葡萄糖苷酶活性最高,其次为木糖苷酶和--阿拉伯糖苷,只有一部分具有--鼠李糖苷酶活性。本研究发现,相比于对照菌株,供试菌株均表现出较高水平的糖苷酶活性。不同菌株间酶活性具有一定差异,且同一菌株间不同糖苷酶也表现出一定差异,从发酵过程中累积糖苷酶活性整体结果可知,--葡萄糖苷酶>--阿拉伯糖苷酶>--木糖苷酶>--鼠李糖苷酶。
4 结论
利用WL培养基和七叶苷筛选培养基对自然发酵液中高产糖苷酶菌株进行筛选,并对初步筛选出菌株的糖苷酶活性进行定量测定,共筛选出6 株高产糖苷酶的本土非酿酒酵母菌株。在模拟汁发酵过程中,6 株优选本土非酿酒酵母菌株均能正常生长,且表现出相对较高的酶活性;尤其是菌株表现出良好的发酵能力、最高的--葡萄糖苷酶和双糖苷酶累积活性;其次,菌株的--木糖苷酶和--阿拉伯糖苷酶累积活性显著高于对照菌株,菌株与3表现出较高的--木糖苷酶和--阿拉伯糖苷酶活性。综合分析,菌株、、3、具有与酿酒酵母进行混合发酵,提高葡萄酒的风味复杂性和区域特色的应用潜力。
