恶性心包积液细胞蜡块联合基因检测在明确肿瘤来源及肺腺癌个体化治疗中的应用
2022-04-28张连美朱亚宁孙苏安
张连美,朱亚宁,孙苏安
南京医科大学附属淮安第一医院病理科,江苏 淮安 223300
心包积液在临床中较为常见,其中恶性肿瘤性心包积液的比例约为20%,恶性肿瘤性心包积液可能导致患者出现心脏压塞及血流动力学改变,甚至可能是肿瘤患者的首发症状[1]。因此,临床上快速准确地找到恶性心包积液的肿瘤来源,对后续治疗和预后具有重要意义。心包积液较为隐匿,直接穿刺心包,获取心包积液并进一步鉴定其理化性质和细胞学成分是诊断恶性心包积液最主要的方法[2]。然而,目前尚无特异性的检测指标和明确的诊断标准,这给恶性心包积液的诊断造成了困难[3]。本研究对50例恶性心包积液标本给予细胞蜡块联合基因检测,以确定肿瘤来源,并分析肺腺癌标本的肿瘤基因突变情况,以期为肺腺癌的个体化治疗提供帮助,现报道如下。
1 对象与方法
1.1 研究对象
选取2015年1月至2020年12月南京医科大学附属淮安第一医院送检至病理科的50例恶性心包积液患者的恶性心包积液标本。纳入标准:年龄≥18岁;临床资料完整。排除标准:合并其他恶性肿瘤。50例患者中,男31例,女19例;年龄26~85岁,平均(65.4±4.6)岁。本研究经医院伦理委员会审批通过,所有患者均对本研究知情同意并签署知情同意书。
1.2 研究方法
细胞学涂片及蜡块制备:收集200~500 ml心包积液,室温静置20 min后,去除一半上清液,再次室温静置20 min,去除一半上清液,直至液体量少于50 ml,将液体收集至10 ml离心管中,共5管,室温3000 r/min离心5 min后,去除上清液,吸取沉淀进行细胞涂片,固定后进行染色。在沉淀物中轻轻加入95%酒精,3000 r/min离心5 min,室温下静置2 h,去除上清液,取出沉淀物,经常规石蜡包埋制备蜡块,苏木素-伊红(hematoxylin and eosin,HE)染色后在光镜下进行观察,记录并分析结果。
细胞蜡块免疫组化染色:采用全自动免疫组化染色仪进行免疫组化染色,所有抗体均购自北京中杉金桥生物技术有限公司,常规设置阳性和阴性对照。细胞蜡块切片厚度为2.0~3.0 μm,60℃放置1 h后,根据细胞学涂片、细胞蜡块切片中的细胞学形态以及患者的临床病史选择相应的特异性免疫组化抗体,主要包括钙网膜蛋白(calretinin,CR)、间皮细胞(mesothelial cell,MC)、肾母细胞瘤基因1(Wilms tumor 1,WT1)、癌胚抗原M2A单克隆抗体D2-40、尾型同源盒转录因子2(caudate homeobox transcription factor 2,CDX2)、绒毛蛋白(villin)、黏蛋白5AC(mucin 5AC,MUC5AC)、甲状腺转录因子-1(thyroid transcription factor-1,TTF-1)、天冬氨酸肽酶A(napsin A)、细胞角蛋白7(cytokeratin 7,CK7)、癌胚抗原(carcinoembryonic antigen,CEA)、神经细胞黏附分子(neural cell adhesion molecule,NCAM,又称 CD56)、嗜铬粒蛋白 A(chromogranin A,CgA)、突触素(synapsin,Syn)、细胞角蛋白 5/6(cytokeratin 5/6,CK5/6)、p63、p40、p16、雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人表皮生长因子受体 2(human epidermal growth factor receptor 2,HER2)、GATA结合蛋白3(GATA binding protein 3,GATA3)、叉 头 框 蛋 白 A1(forkhead box A1,FOXA1)、配对盒转录因子8(paired box 8,PAX8)、糖类抗原125(carbohydrate antigen 125,CA125)、广谱细胞角蛋白(pan cytokeratin,p-CK)、上皮细胞膜抗原(epithelial membrane antigen,EMA)、波形蛋白(vimentin)等,根据细胞蜡块的免疫组化阳性结果判断肿瘤来源及病理分型。
基因突变检测:将诊断为肺腺癌来源的恶性心包积液的细胞蜡块切成切片卷,置于1.5 ml离心管中,提取表皮生长因子受体(epidermal growth factor receptor,EGFR)、棘皮动物微管相关样蛋白4(echinoderm microtubule associated protein like 4,EML4)-间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)的DNA,试剂盒购自厦门艾德生物医药科技有限公司,具体步骤按试剂盒说明书进行操作,提取后确定DNA样本的浓度与质量。采用安捷伦Mx3000P实时荧光定量聚合酶链反应(polymerase chain reaction,PCR)仪检测EGFR突变情况,采用逆转录聚合酶链反应(reverse transcription PCR,RT-PCR)分析EML4-ALK融合基因情况,设立阴性、阳性对照,记录两种基因类型的阳性范围Ct值。
2 结果
2.1 恶性心包积液细胞蜡块组织切片观察
恶性心包积液细胞蜡块组织切片中,腺癌细胞呈腺样、乳头状、条索状排列或单个散在,细胞异型性明显,核质比例增大;鳞状细胞癌细胞聚集呈巢团状或片巢状排列,细胞质嗜酸性,细胞核深染,可见细胞间桥;小细胞癌细胞表现为细胞较小,但较背景淋巴细胞大,呈圆形或卵圆形、细胞质极少,细胞核深染,部分细胞呈拉长、变形、挤压的燕麦状;恶性间皮瘤上皮成分常呈乳头状、腺样、实性、腺泡样、微乳头样排列,肉瘤区常见梭形细胞呈短束状排列。(图1)
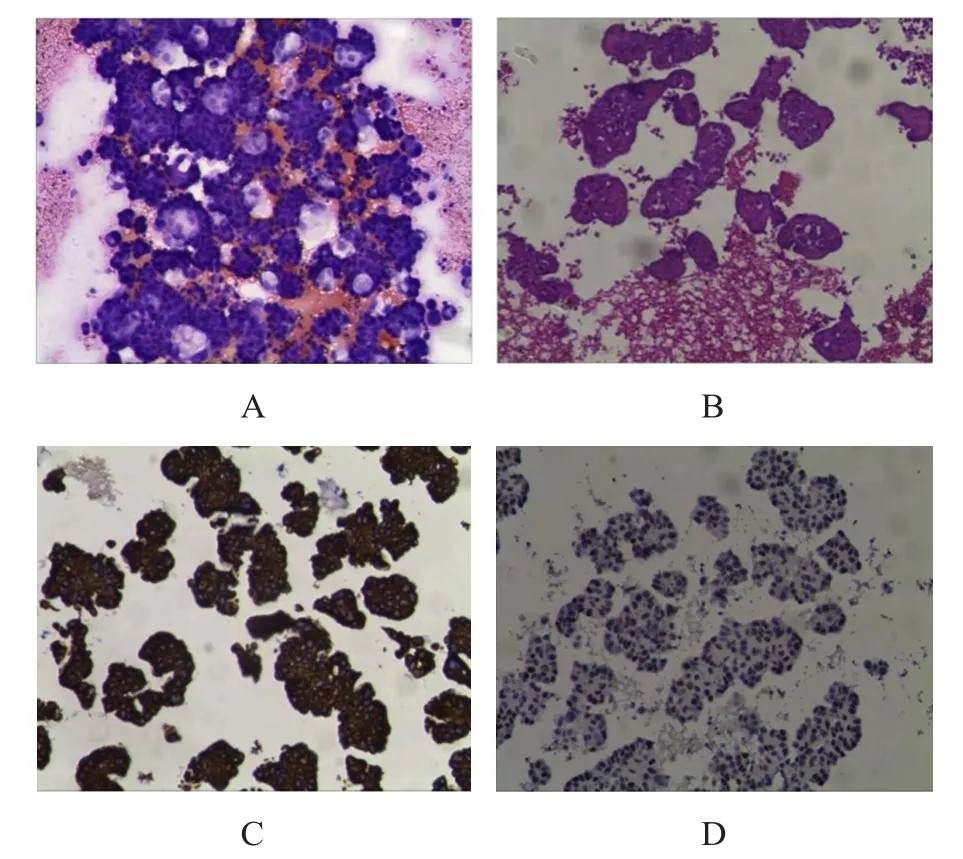
图1 转移性肺腺癌的恶性心包积液涂片、细胞蜡块组织切片及免疫组化染色结果
2.2 50例恶性心包积液经细胞蜡块结合免疫组化染色的分型诊断结果
50例恶性心包积液经细胞蜡块联合免疫组化染色,结果显示,腺癌40例,小细胞癌4例,鳞状细胞癌5例,恶性间皮瘤l例,其中腺癌来源:肺30例,乳腺3例,消化道5例,卵巢2例。肺腺癌30例,TTF-1、napsin A、CEA均呈阳性表达;乳腺癌3例,GATA3、FOXA1均呈阳性表达,ER、PR、HER2均呈不同程度表达;消化道腺癌5例,CDX2、villin、MUC5AC均呈阳性表达;卵巢癌2例,PAX8、CA125、p16、WT1均呈阳性表达;小细胞癌4例,CD56、Syn均呈阳性表达,CgA呈不同程度表达;鳞状细胞癌5例,CK5/6、p63、p40均呈阳性表达;恶性间皮瘤l例,CR、MC、WT1、D2-40均呈阳性表达。
2.3 肿瘤基因突变检测结果
30例源于肺腺癌的恶性心包积液细胞蜡块中,EGFR基因突变11例,其中19del突变5例、L858R突变6例,EML4-ALK融合基因1例,其余18例未见EGFR基因突变及EML4-ALK融合基因。(图2)
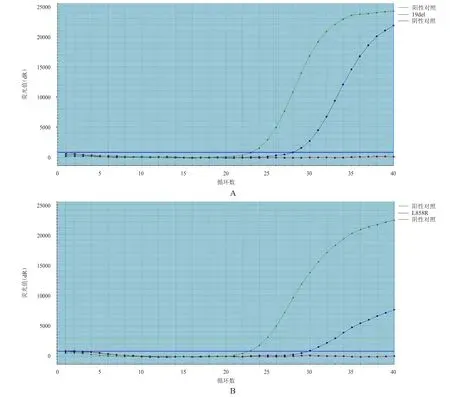
图2 肺腺癌患者恶性心包积液细胞胞蜡中EGFR 基因的突变情况
3 讨论
当肿瘤患者出现恶性心包积液并伴有胸闷、呼吸困难、心悸等症状时,表明患者的肿瘤已经扩散并发展至晚期,其发生机制可能是肿瘤细胞播散于心包腔表面,导致心包的分泌和再吸收功能受损[4]。心包积液标本不仅易于收集,创伤小,安全可靠,患者容易接受,而且能够迅速地作出明确诊断,获得了临床医师和患者的广泛认可[5]。
本研究结合患者的临床资料、细胞学特征及免疫组化结果分析50例恶性心包积液的组织学来源及类型,结果显示,来源于腺癌40例、小细胞癌4例、鳞状细胞癌5例、恶性间皮瘤1例。腺癌来源:肺30例,乳腺3例,消化道5例,卵巢2例。细胞蜡块联合免疫组化诊断心包积液的良恶性及判断其来源的准确率明显高于常规细胞学涂片。与细胞学涂片相比,细胞蜡块组织切片中腺癌细胞的形态结构和常规组织HE切片相似,细胞聚集呈腺样、乳头状或单发散在,肿瘤细胞具有明显的异型性,背景中的间皮细胞密集分布或平铺分布,腺腔很少形成[6-7]。常规组织HE切片上的鳞状细胞癌,细胞嵌套,可见细胞间桥。小细胞癌涂片和组织切片上的细胞形态相似,细胞小,呈圆形或燕麦样,细胞质极少,细胞界限不清[8]。一些晚期肿瘤患者的第一症状是体腔积液[9]。传统的细胞学涂片只能对恶性肿瘤细胞进行诊断,而不能诊断其来源[10]。细胞蜡块可连续反复切片,通过免疫组化染色可判断肿瘤分型及部分肿瘤来源,常规细胞学涂片联合细胞蜡块HE染色明显提高了恶性心包积液的诊断率[11-12]。CR、MC、WT1、D2-40是间皮细胞的标志物,CDX2、villin、MUC5AC是消化道来源的标志物,TTF-1、napsinA是肺腺癌的标志物,CD56、CgA和Syn是小细胞癌的标志物,CK5/6、p63、p40是鳞状细胞癌的标志物,ER、PR、HER2、GATA3、FOXA1是 乳 腺 癌 的 标 志 物 ,PAX8、CA125、p16、WT1是卵巢癌的标志物[13]。
近年来,肺癌的发病率呈显著上升趋势,而非小细胞肺癌约占原发性肺癌的80%[14]。随着对肿瘤发病机制的深入研究,分子靶向治疗已成为肺癌治疗的研究热点,如EGFR-酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)是一种应用较为广泛的分子靶向治疗药物[15]。EGFR基因位于人类7号染色体短臂的12~14区,包含28个外显子,其中18~24外显子可以编码该受体的酪氨酸激酶部分,但超过90%的EGFR突变发生在19~21外显子,尤其是19外显子,约占所有突变的60%,而19外显子碱基缺失和21外显子的点突变往往对EGFR-TKI治疗敏感。突变后EGFR可不依赖表皮生长因子(epidermal growth factor,EGF)而进行自激活,EGFR作为一种酪氨酸蛋白激酶受体,与相应配体结合后激活酪氨酸激酶(tyrosine kinase,TK),使其磷酸化,从而激活下游的磷脂酰肌醇3激酶(phosphoinositide 3-kinase,PI3K)-蛋白激酶B(protein kinase,PKB,又称AKT)-雷帕霉素靶蛋白(mechanistic target of rapamycin kinase,MTOR)通路和鸟嘌呤核苷酸交换因子(son of sevenless,SOS)-大鼠肉瘤蛋白(rat sarcoma,RAS)-迅速加速性纤维肉瘤蛋白(rapidly accelerated fibrosarcoma,RAF)-丝裂原活化的细胞外信号调节激酶(mitogen-activated extracellular signal-regulated kinase,MEK)-丝裂原活化 蛋 白 激 酶(mitogen-activated protein kinase,MAPK)通路,使自噬减少,同时加速转化生长因子(transforming growth factor,TGF)、白细胞介素(interleukin,IL)-8、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)和血管内皮生长因子(vascular endothelial growth factor,VEGF)的分泌,促进肿瘤生长,使肿瘤细胞获得不死性,进入“疯长-分裂”的恶性循环模式。因此,EGFR的过表达或活性增强均会使细胞生长加快,自噬受到抑制,导致肿瘤的产生。靶向药物EGFR-TKI可靶向EGFR的酪氨酸激酶的胞内区,使其活性减弱,自噬增强,从而达到治疗目的。EML4-ALK融合基因是非小细胞肺癌一个重要的治疗靶点。ALK包含许多重要的生物学信号通路,影响肿瘤细胞的增殖、分化与凋亡[16]。本研究结果显示,肺腺癌患者的恶性心包积液细胞蜡块中,EGFR基因突变11例,其中19del突变5例、L858R突变6例,EML4-ALK融合基因1例,其余18例均未见EGFR基因突变及EML4-ALK融合基因。临床医师可以根据基因突变情况给予患者个性化的分子靶向治疗,从而改善患者的治疗效果和预后。
综上所述,恶性心包积液细胞蜡块联合基因检测可为肿瘤起源及分型提供线索,并有利于肺腺癌个体化治疗方案的制订。
