不同工艺海带提取物中植物激素和海藻酸寡糖的比较研究
2022-04-22苗钧魁张雅婷张圣国郑志红王致鹏王海英
苗钧魁,张雅婷, ,张圣国,郑志红,王致鹏,王海英
1. 中国水产科学研究院黄海水产研究所/青岛海洋科学与技术试点国家实验室海洋药物与生物制品功能实验室,山东 青岛266071
2. 青岛科技大学,山东 青岛 266061
3. 河北省农业项目规划中心,河北 石家庄 050000
4. 大连海洋大学 食品科学与工程学院,辽宁 大连 116023
5. 青岛农业大学 海洋科学与工程学院,山东 青岛 266109
海带 (Laminaria japonica) 提取物作为天然生物刺激素的一种,在农业领域已被广泛应用[1-3],其在提高作物产量[4-10]、促进种子发芽[11-13]、根系生长[14-16]和代谢产物积累[17]等方面均有显著作用,还可增强植物对各种胁迫的抗逆性,例如冷冻胁迫、盐分胁迫、水分胁迫、热胁迫和病原体胁迫[17-24]。海带提取物的功效性在于其富含生物活性物质,包括各种植物激素 (Plant hormones, PHS)、甜菜碱、甾醇、独特的多糖和相应的低聚物 (海藻酸盐、海带淀粉和岩藻多糖等) 以及矿物质等[2-3]。这些化合物参与植物光合作用或作为细胞分裂、增殖及分化和器官发生的诱导剂,并表现出协同活性[25]。其中植物激素被认为是最重要的因素,痕量的植物激素可改变植物的生长和发育模式,从而有效地促进生理过程[26-27]。此外,褐藻中含量最丰富的海藻酸盐降解生成的活性成分海藻酸寡糖 (Alginate oligosaccharides, AOS) 被证实在植物根系发育等方面具有显著的促进作用[15]。
海带是我国最大的养殖海藻品种,中国渔业统计年鉴显示2020年我国海带年产量已达165×104t[28]。海带主要用作饲料和食物,也是生产海藻酸钠和海带提取物主要原料之一[29-30]。破坏褐藻细胞壁从而使生物活性物质释放,是海带提取物生产工艺最重要的一环。用稀碱或酸碱溶液进行化学处理 (Chemical processing, CP) 一直是海带提取的主要方法[2-3,31],但需要高浓度的酸碱和较长的提取时间,存在污染环境、提取效率低、生物活性物质被破坏等缺点[32-33]。因此亟需高效环保的替代工艺,实现海带原料中有效成分的高效提取。
目前,已开发出特异性纤维素酶可有效破坏藻类细胞壁,同时褐藻胶裂解酶可将褐藻细胞间质中的海藻酸盐水解成可溶性海藻酸寡糖[34-35],从而使胞内成分得到有效释放和提取[36],酶解工艺 (Enzymolysis processing, EP) 已成为一种可行的绿色提取方法。此外,EM菌剂作为一种生态调理剂在农业上被广泛应用,在酶解工艺基础上,进一步添加EM菌剂,通过酶解与微生物发酵联用 (Combined enzymolysis and microbial fermentation processing, CEMP) 可建立一种提取新方法[23]。本研究对传统化学工艺、酶解工艺和酶解发酵联用工艺得到的海带提取物中11种植物激素、海藻酸寡糖含量和分子量进行系统分析,为不同褐藻生物提取工艺效果比较提供了理论依据,也为海藻绿色生物提取技术的开发提供了新思路。
1 材料与方法
1.1 材料
本研究所用原料为干海带,购自寻山集团有限公司,海带加工日期为2019年5—6月,整颗海带干燥除湿后研磨至约50目,室温保存直至使用。D-葡萄糖醛酸和葡萄糖标准品购自Sigma-Aldrich,Inc., St. Louis, USA。纤维素酶 (CellicCTec2) 由诺维信中国投资有限公司赠予。EM菌 (有效菌活≈6×109CFU) 购自郑州百亿宝生物科技有限公司,含乳酸菌、抗菌肽、芽孢杆菌、光合细菌、酵母菌等。
吲哚乙酸 (IAA)、吲哚丁酸 (IBA)、脱落酸(ABA)、玉米素 (cZ)、反式玉米素核苷酸(tZR)、赤霉素A3 (GA3)、水杨酸 (SA)、茉莉酸 (JA) 购自Sigma-Aldrich, Inc., St. Louis, USA。赤霉素A1(GA1)、赤霉素A4 (GA4) 和赤霉素A7 (GA7) 的标准品购自 Toronto Research Chemicals, Inc., North York, CA。
本研究中使用的所有其他试剂均为分析纯。
1.2 褐藻胶裂解酶的制备
褐藻胶裂解酶使用前期研究获得的Alyw203,从弧菌W2中克隆获得并在食品级解脂耶氏酵母(Yarrowia lipolytica)中成功表达[37]。将表达菌株在YPD 液体种子培养基 (20.0 g·L-1葡萄糖、20.0 g·L-1蛋白胨、10.0 g·L-1酵母提取物) 中培养20 h,然后换用 GPPB培养基 {20.0 g·L-1葡萄糖、1.0 g·L-1硫酸铵 [(NH4)2SO4]、2.0 g·L-1酵母提取物、2.0 g·L-1磷酸二氢钾 (KH2PO4)、3.0 g·L-1磷酸钾 (K2HPO4)和 0.1 g·L-1硫酸镁 (MgSO4·7H2O)},接种量为 5%。培养60 h后,收集酵母培养物并以5 000×g离心,回收上清液作为褐藻胶裂解酶使用。
1.3 不同工艺制备海带提取物
1.3.1 化学法制备海带提取物
将10 g海带干粉加入100 mL含有1.5 g氢氧化钾 (KOH) 的蒸馏水中,在红外线加热炉中加热沸腾并保持约10 h,不断添加蒸馏水以保持总体积恒定,直至体系黏度低于10 mPa·s。将混合物以5 000 r·min-1离心5 min,上清液即为化学工艺海带提取物,冻干后收集作为样品。制备3个重复样品。
1.3.2 酶解法制备海带提取物
将10 g海带干粉加入100 mL蒸馏水 (含20 mmol·L-1,pH 7.0磷酸盐缓冲液) 中,40 ℃ 预热后将0.3 g纤维素酶和0.5 mL褐藻胶裂解酶溶液加入混合物中,40 ℃下持续搅拌6~8 h,体系黏度低于10 mPa·s时停止反应。将混合物以5 000 r·min-1离心5 min,上清液即为酶解工艺海带提取物,冻干后收集作为样品。制备3个重复样品。
1.3.3 酶解发酵联用法制备海带提取物
将10 g海带干粉加入100 mL蒸馏水 (含20 mmol·L-1,pH 7.0磷酸盐缓冲液) 中,40 ℃ 预热后将0.3 g纤维素酶和 0.5 mL褐藻胶裂解酶溶液加入混合物中,保持40 ℃并持续搅拌反应4 h后,将5.0 mL活化的EM菌剂和 0.1 g豆浆加入混合物中,置于37 ℃下培养约30 h,直至混合物的黏度低于 10 mPa·s。将混合物在 5 000 r·min-1的条件下离心5 min,上清液即为酶解发酵联用工艺海带提取物,冻干后收集作为样品。制备3个重复样品。
1.4 植物激素含量分析
采用Gupta等[38]和刘雪梅等[39]的改进方法,对样品中的11种植物激素进行分析。50 mg海带干粉或粉状海带提取物在-80 ℃下冷冻1 h,然后在液氮浴中研磨成更细的粉末。在粉末中加入2 mL萃取溶剂 [V(甲醇)∶V(甲酸)∶V(水)=15∶1∶4],超声辅助 (功率30 W,频率40 kHz) 萃取20 min。将混合物在 -20 ℃下保持16 h,然后以10 000 r·min-1离心10 min,收集上清液,残留物再用1 mL萃取溶剂萃取2次。合并提取的上清液在35 ℃下减压蒸发,溶解在1 mL甲醇 (0.1%甲酸) 中。再次以10 000 r·min-1离心 10 min,上清液过 0.22 μm 滤膜后用于分析。
LC-MS/MS分析使用 Agilent 1290系列HPLC与配备电喷雾电离接口的API 6500 Qtrap (AB Sciex)质谱仪联用进行。使用美国安捷伦科技有限公司的 Poroshell 120 SB-C18 反相柱 (150×2.1 mm, 2.7 μm)进行HPLC分离。流动相由含0.1%甲酸的甲醇(A)和含0.1%甲酸的水 (B)组成;使用梯度0~1 min 20% A、1~9 min 20%~80% A、9~10 min 80%A、10~10.1 min 80%~20% A和10.1~15 min 20%A。流动相流量流速为 0.3 mL·min-1,柱温保持在30 ℃。源参数包括雾化器气体65 psi;加热器气体70 psi;离子源温度400 ℃;离子喷雾电压为4 500 V。使用自动进样器10 μL等分进样。
1.5 海藻酸盐含量分析
应用改良的间羟基联苯方法分析样品中海藻酸盐含量[40]。将 10 μL 氨基磺酸 (4 mol·L-1)加入到1 mL稀释样品中 (×103稀释倍数),然后在冰水浴中缓慢加入3 mL四硼酸钠-硫酸溶液 (75 mmol·L-1)。混匀后沸水浴15 min,冷却至室温,将100 μL 0.5%氢氧化钠 (NaOH)溶液 (含0.15%间羟基联苯) 添加到样品中并涡旋混合。所有样品均在525 nm处读取吸光值。使用去离子水代替样品作为对照。用葡萄糖醛酸标准溶液 (0、10、20、40、60、80、100 μg·mL-1) 制作标准曲线。海藻酸盐的提取率为提取物中总海藻酸盐与海藻原料中海藻酸盐的质量比。
1.6 海藻酸寡糖聚合度分布分析
将不同工艺海带提取物冻干粉 (0.05 g) 完全溶解在 10 mL 0.1 mol·L-1碳酸氢铵 (NH4HCO3)中,并以 10 000 r·min-1离心 10 min。上清液通过 0.22 μm滤膜进一步净化。采用色谱柱Superdex TM Peptide 10/300GL (GE,美国),液相色谱UltiMate 3000(Dionex,美国) 配备示差折光检测器 (RID) 用于分子量分析。流动相为0.1 mol·L-1碳酸氢铵,流速为 0.1 mL·min-1,柱温为 35 ℃,进样量为 20 μL。不同聚合度的海藻酸寡糖 (AO) 标准品购自青岛海洋医药研究院。
1.7 葡萄糖含量分析
发酵液中葡萄糖检测方法参照GB 5009.8—2016《食品安全国家标准 食品中果糖、葡萄糖、蔗糖、麦芽糖、乳糖的测定》中第一法高效液相色谱法。
2 结果与分析
2.1 干海带原料和各海带提取物中植物激素质量分数分析
采用HPLC-MS/MS分析了11种植物激素(ng·g-1,,表1)。结果显示,无论是干海带原料还是海带提取物中,吲哚乙酸 (IAA) 均为含量最高的植物激素,这与已有的研究报道一致。Stirk等[41]从巨藻 (Macrocystis pyrifera) 提取的新鲜海藻浓缩物中含约11.67 pmol·mL-1IAA、0.01 pmol·mL-1cZ 和0.29 pmol·mL-1tZR,IAA 也是最丰富的植物激素,而tZR和cZ检测到的水平较低;南非Kelpak海藻肥产品中的脱落酸 (ABA) 质量浓度约为 0.31~20.70 pg·mL-1,GA1—GA7约为0.01~4.47 pg·mL-1[42]。干海带原料及海带提取物还具有相当数量的茉莉酸 (JA) 和水杨酸 (SA),其主要生理作用是缓解植物中细菌或真菌引起的生物胁迫[43-44]。
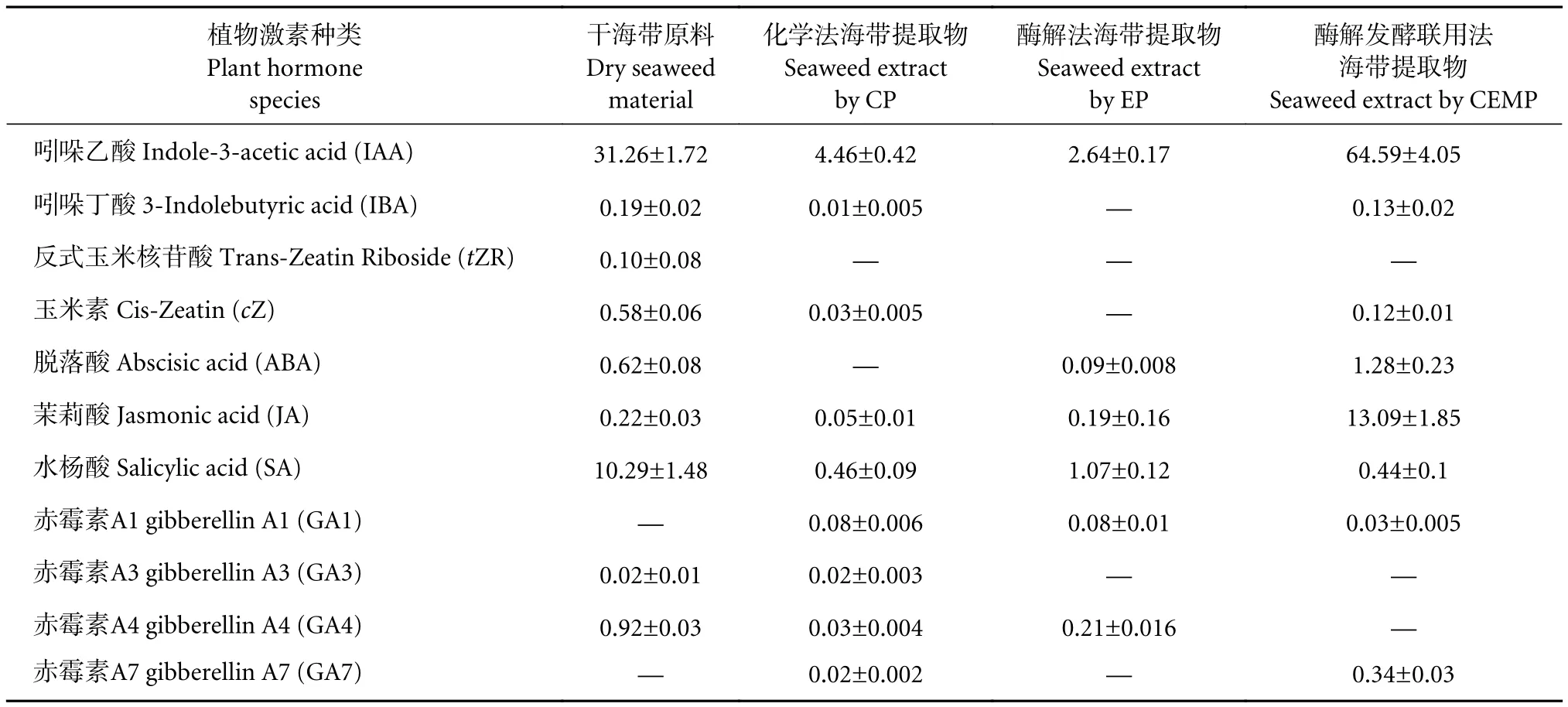
表1 干海带原料与不同提取工艺制备样品中植物激素质量分数Table 1 Contents of 11 PHS species in seaweed material and seaweed extracts by different methodsng·g-1
表1显示原料中各种植物激素的含量显著高于化学工艺和酶解工艺的海带提取物中的含量,其他类别的植物激素含量也与IAA有相同趋势,说明化学工艺和酶解工艺均对植物激素提取有较大的破坏。酶解发酵联合工艺海带提取物中某些植物激素的含量显著高于其他样品,如IAA和ABA含量是干海藻原料中相应含量的2倍以上,而JA的含量更是相较于原料增高了近60倍。这些性状可能是由EM发酵菌剂中的微生物区系引起,因为许多微生物菌株可以产生植物激素作为代谢产物[45-46]。
2.2 不同海带提取物中海藻酸盐含量和海藻酸盐提取率分析
图1为不同海带提取物中海藻酸盐的提取率。化学工艺海带提取物的海藻酸盐质量分数最低,仅22.3%;酶解工艺海带提取物和酶解发酵联用工艺海带提取物中的质量分数均约35%。化学工艺只能从干海藻原料中提取约38.1%的海藻酸盐,而酶解工艺的提取率接近100%,酶解发酵联用工艺的提取率则为82.3%。说明酶解工艺是将海藻中的高分子海藻酸盐分解为可溶性海藻酸寡糖的最有效方法。因为微生物生长会利用部分海藻酸寡糖[47],故酶解发酵联用工艺的海藻酸盐提取率较低。
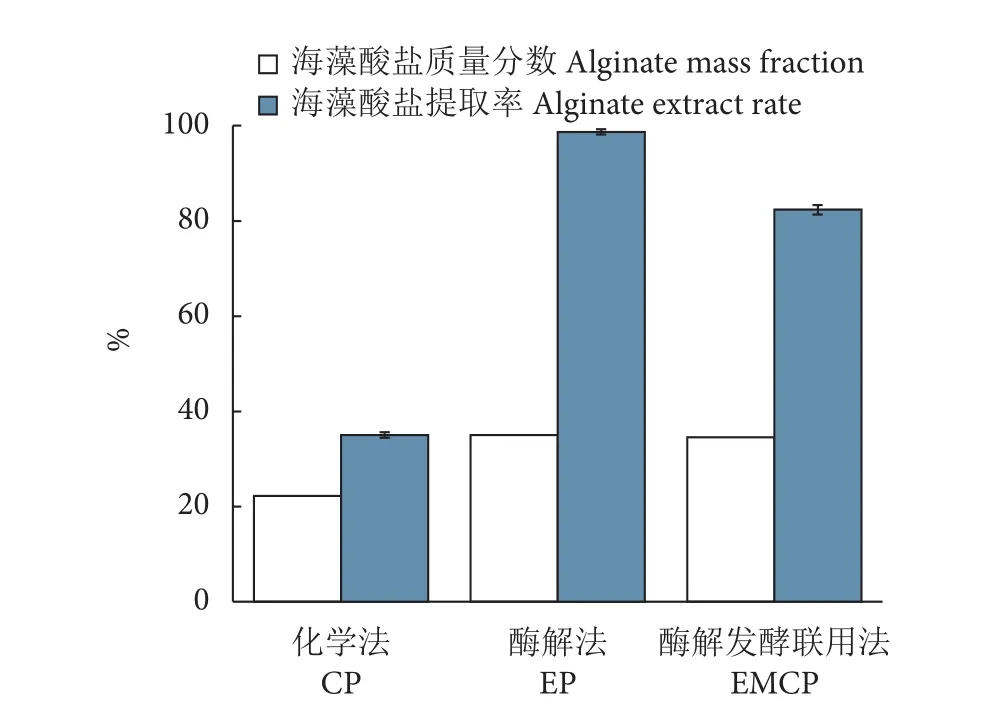
图1 不同加工处理的海藻酸盐含量及其提取率Fig. 1 Alginate content and its extract rate in seaweed extracts by different processing methods
2.3 不同海带提取物中海藻酸寡糖的分子量分布
在前期研究中,笔者测试了该褐藻胶裂解酶将海藻酸盐降解成海藻酸寡糖的能力,产物聚合度(Degree of polymerization, DP) 为 2~7[48]。在本研究的化学处理过程中,由于强碱和高温的影响,化学工艺提取物只能得到较低分子量的寡糖,海藻酸寡糖DP为1~2,而酶解和酶解发酵联用工艺提取物中的海藻酸寡糖DP分别为1~7和2~7,分子量约为200~1 600 D (图2)。不同的褐藻胶裂解酶将海藻酸盐降解为不同DP的海藻酸寡糖。黄杆菌属(Flavobacterium sp.) UMI-01的褐藻胶裂解酶FlAlyA将海藻酸盐降解为DP 2~4的寡糖[49],黄杆菌属S20的褐藻胶裂解酶Alg2A产生高DP海藻酸寡糖,如五糖、六糖和七糖[50]。目前研究使用的裂解酶可以降解海藻酸盐产生DP 1~7的寡糖,而酶解发酵联用工艺提取物得到DP 2~7的寡糖,这可能是由于微生物的同化利用主要使用单糖所致。
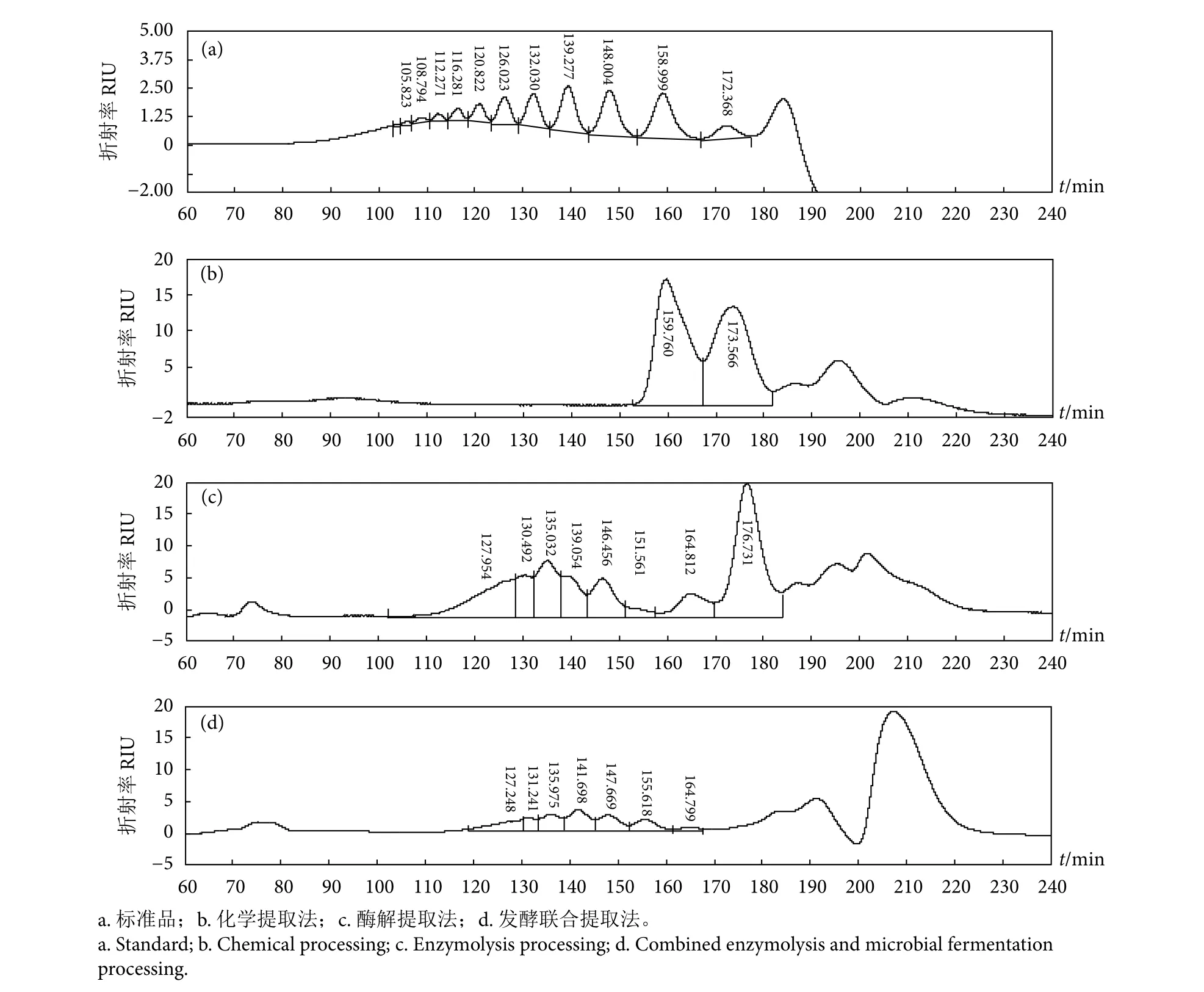
图2 不同工艺海带提取物中不同聚合度海藻酸寡糖的含量Fig. 2 Content of alginate oligosaccharides with different degree of polymerization in seaweed extracts from different processing methods
海藻酸寡糖的生物活性已被广泛报道。大分子量或更高古洛糖醛酸/甘露糖醛酸比的海藻酸寡糖可能与大豆中较高的甘油三酯诱导活性相关[51]。也有报道称富含甘露糖醛酸的海藻酸寡糖会增加植物中苯丙氨酸解氨酶 (PAL) 和过氧化物酶 (POD)的活性[52]。海藻酸寡糖还具有促进胡萝卜和大米植物根系增长的活性,并且与寡糖的聚合度相关[16]。
2.4 酶解发酵联用工艺中葡萄糖、海藻酸盐及植物激素含量变化
EM菌因具有土壤改良、生根壮苗等多种有益效果,已被广泛应用于农业领域。本研究中,为验证该菌种是否有利于生物活性物质的提取,将EM菌接种在酶解工艺提取物中30 h。发酵24 h,葡萄糖几乎完全被细胞生长消耗,海藻酸盐从2.6 g·L-1小幅下降至2.3 g·L-1,这可能由于EM菌在发酵培养过程中利用原料中的碳源实现了增殖,并且发酵过程中发酵液中植物激素含量显著增加 (图3)。在酶解发酵联用工艺提取物中,IAA质量分数最高(64.59 ng·g-1),JA 次之 (13.09 ng·g-1),ABA 也达1.28 ng·g-1。相较于海带干粉原料中的植物激素含量,IAA和ABA含量是海带干粉原料的2倍多,JA含量接近6倍 (表1);IBA和反式玉米核苷酸(tZR) 含量也明显提升。结果表明EM菌在以提取物发酵培养过程中可以产生植物激素代谢产物,大幅增加提取物中的植物激素含量,进而增强了提取物作为海藻肥产品的功效[53]。因此,EM菌的生物转化作用是增加海带提取物中植物激素含量的有效手段。
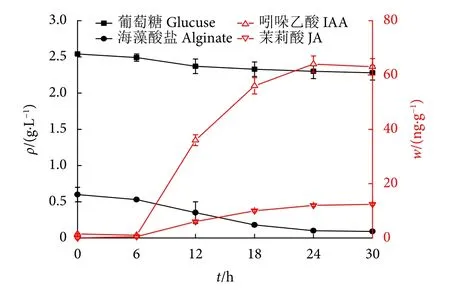
图3 发酵过程中葡萄糖、海藻酸盐、吲哚乙酸和茉莉酸含量变化Fig. 3 Contents of glucose, alginate, IAA and JA during fermentation
3 结论
本研究采用酶解工艺从海带中提取植物激素和海藻酸寡糖,酶解处理采用3%纤维素酶和5%褐藻胶裂解酶,酶解工艺AOS提取率达90.8%,寡糖DP为1~7,PHS和AOS的提取率均远高于化学工艺。进一步通过EM菌对酶解工艺提取物进行生物转化,可实现IAA、JA、ABA等植物激素的显著增加。基于AOS和PHS含量的比较,酶解发酵联用工艺比传统化学工艺和酶解工艺有更好的提取效果。本研究为海藻肥生产工艺提取效果的比较提供了数据支撑,也为海藻生物活性物质绿色生物提取技术开发提供了新的思路。本研究发现EM菌对海带酶解工艺提取物的生物转化作用,但其作用机制尚不明确,且酶解发酵联用工艺作用的最佳工艺尚需优化。下一步将开展菌种筛选和发酵培养条件的优化等研究,实现酶解发酵联用工艺的产业化应用,为我国高值农用海藻产品的加工开辟一条新路径。
