适用鱼油加工的Patatin酯酶固定化及其特性研究
2022-04-22涂兰兰许璟珅陈润莎吴金鸿李向红
涂兰兰,许璟珅,陈润莎,吴金鸿,李向红,张 勇
1. 上海交通大学a. 农业与生物学院,b. 生命科学技术学院,上海 200241
2. 长沙理工大学 食品与生物工程学院,湖南 长沙 410114
脂肪酶 (Lipase, EC 3.1.1.3) 作为一种丝氨酸水解酶,其可作用于长链甘油三酯的水解过程中,最后得到产物脂肪酸和甘油[1]。脂肪酶可以参与甘油酯类化合物的合成和水解反应,还能催化酯合成反应,包括酯化、酯交换、醇解和酸解[2]。脂肪酶在水产中应用广泛,既可以添加到饲料中提高饲料利用率、鱼的生长性能和肠道免疫力[3],还可以添加到鱼糜中,增强凝胶强度,改善鱼糜凝胶特性[4]。此外,还有研究者利用脂肪酶的催化特性,对鱼油进行水解处理,在最佳工艺条件下,鱼油中EPA由3.0%提高至9.0%,DHA由4.3%提高至16.5%[5]。
1980年,Racusen和Foote[6]利用阴离子交换层析和亲和层析技术首次分离纯化得到Patatin酯酶。Patatin是一种脂肪酶,酶解活性好[7],具有良好的乳化性[8]、起泡性[9]和凝胶性[10]。目前,关于Patatin酯酶已经开展了其替代动物蛋白作为葡萄酒澄清剂[11]、作为添加剂制作干酪[12]和蛋白酶水解试验[13]等研究,但关于其脂肪水解应用研究还未深入。本实验室前期研究发现Patatin可以水解鱼油从而达到富集多不饱和脂肪酸的目的,在Patatin最佳反应条件下,鱼油中的不饱和脂肪酸含量可以达到97.72%,其中EPA含量比原鱼油多了4.20%,由此可见Patatin在鱼油等水产脂质的制备及加工方面具有潜在应用价值。
游离的Patatin酯酶稳定性差,且在工业生产中也很难被重复利用。酶的固定化技术可以改善以上缺点。脂肪酶的固定方法包括吸附法[14]、包埋法[15]、共价结合法[16]等。纳米载体具有无毒无污染、比表面积大等优势,本实验研究了纳米磁珠与Patatin酯酶结合的最优条件和固定化酶的酶解特性,以期为开发高稳定性Patatin酯酶及其工业化应用推广提供新的技术思路和理论参考。
1 材料与方法
1.1 实验材料
马铃薯全粉:冷冻干燥制备,原料品种为克新1号;Q-Sepharose fast,美国GE Healthcare 公司;对硝基苯乙酸酯,美国Sigma公司;PB缓冲液 (0.2 mol·L-1, pH 7.2~7.4),上海少辛生物科技有限公司;盐酸,国药集团化学试剂有限公司;氢氧化钠,国药集团化学试剂有限公司;ConA,阿拉丁 (上海) 有限公司;BSA,阿拉丁 (上海) 有限公司;NHS固体,上海少辛生物科技有限公司;EDC固体,上海少辛生物科技有限公司;MES,上海少辛生物科技有限公司;磁珠 (SR600-20210114-1),上海迈景生物科技有限公司。
1.2 Patatin酯酶溶液的制备
根据吴乔羽等[17]实验方法以马铃薯全粉为原料,利用酸沉淀法提取得到粗蛋白质液,再根据孙莹等[18]实验方法做适当改进后,用Q-Sepharose Fast Flow (2.6 cm×20 cm) 柱子洗脱粗蛋白液,获得Patatin酯酶溶液。
1.3 磁珠与ConA的偶联及偶联ConA磁珠上清的BCA实验
1.3.1 磁珠与 ConA 的偶联
取5 mg (200 μL) 磁珠分别置于4个离心管中,其中1组为对照管,另外3组为实验管。移液器吸取 MEST 溶液 (50 mmol·L-1, pH 6.0) 500 μL置于每管,洗涤3次,每30 s换1次MEST溶液。之后使用移液器吸取500 μL配制好的NHS溶液(50 mg·mL-1) 置于每管中,然后吸取 500 μL 配置好的EDC溶液 (50 mg·mL-1) 置于每管中,混匀后放在旋转混合仪上旋转15 min。活化结束后利用磁力架吸附磁珠,移液枪吸取上清液,加入500 μL MEST溶液洗涤,重复3次。向对照管加入1 000 μL MEST溶液,实验管加1 000 μL配置好的不同浓度梯度的ConA溶液,置于37 ℃恒温箱中的旋转混合仪上旋转2 h后,保留上清,做BCA蛋白质定量测试,磁珠加入1 000 μL封闭液洗涤,重复3次,再加1 000 μL的封闭液,在4 ℃冰箱旋转混合仪上转动12~15 h。将封闭过夜的磁珠实验管放入磁分离架中,吸取上清液,然后取1 000 μL保存液,洗涤3次,加入500 μL保存液待用 (4 ℃冰箱) 。
1.3.2 偶联 ConA 磁珠上清的 BCA 实验
将1.3.1中的上清液用BCA法定量测定蛋白质浓度。取稀释至浓度为0、0.05、0.1、0.25、0.5、1 mg·mL-1BSA 溶液待用,配置 0.7 mg·mL-1ConA待用。实验共用1个标准曲线及ConA实验结果。取酶标板,先在每孔中加入标准液或样品20 μL,每组做3个平行。吸取200 μL显色液加入每孔中。全部加完后置于37 ℃恒温箱中反应30 min。取出后置于酶标仪上于波长为562 nm条件下测定蛋白浓度及标准曲线。
1.4 Patatin酯酰基水解酶固定化条件优化
1.4.1 Patatin 酯酶活性的测定方法
参照Racusen和Foote[6]的方法,稍作修改。称取63 mg对硝基苯乙酸 (PNP-acetate),溶解于10 mL乙醇中,4 ℃保存备用。测定时,取1 mL对硝基苯乙酸的乙醇溶液加入9 mL去离子水定容至10 mL。取纯化的目的蛋白质Patatin溶液,若溶液有浑浊,则在3 000 r·min-1条件下离心5 min,取上清液作为实验用蛋白质液。反应体系见表1。

表1 Patatin酯酶活性测定反应体系Table 1 Reaction system for patatin lipase activity
水浴保温20 min后,加入600 μL无水乙醇终止反应,待冷却至室温后用酶标仪在波长430 nm下测定吸光值。每组实验平行重复3次,A430nm每分钟变化0.01定义为1个酶活力单位,按照以下公式来计算酶的比活:
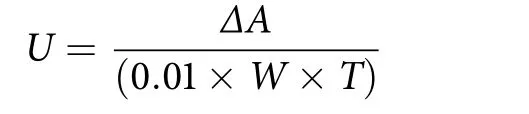
式中:U表示酶比活力 [U·(min·g)-1];ΔA表示反应时间内吸光值的变化值;W表示样品中蛋白质的质量 (g);T表示反应总时间 (min)。
1.4.2 Patatin 酯酶固定化条件的优化
由于在固定化过程中,酶的活力会受到固定化材料、时间、温度等外部条件的影响。其他固定化条件相同,探究固定化材料 (聚丙烯酸PAA、琥珀酸SA、聚苯乙烯PS)、固定化时间 (20、30、40、50、60 min)、固定化温度 (20、25、30、35、40、45 ℃) 以及载体量 (1.0、1.5、2.0、2.5、3.0 mg) 对固定化Patatin酯酶活力的影响。
1.4.3 Box-Benhnken 响应面实验优化 Patatin 酯酶固定化条件
采用Box-Benhnken响应面分析法,以Patatin酯酶比酶活力为响应值,以固定化时间 (A)、固定化温度 (B)、磁珠添加量 (C) 为自变量,设计三因素三水平共17个试验点来优化Patatin酯酶的固定化条件,其中选取5个试验点作为中心点用于估计试验误差,其余12个试验点均为析因点。响应面试验因素和水平见表2。

表2 固定条件Box-Benhnken响应面分析试验因素与水平Table 2 Box-Benhnken response surface factors and levels of immobilization conditions
1.5 Patatin酯酶固定化纳米磁珠特性分析
采用原子力显微镜观察与测定Patatin酯酶固定化前后的表面特征与ζ-电势。
1.6 固定化Patatin酯酶最佳酶解条件测定
其他酶解条件相同,探究pH (4、5、6、7、8、9、10、11)和温度 (20、25、30、35、40、45、50、55 ℃) 对固定化Patatin酯酶的影响,根据所测酶活力绘制固定化相对酶活力。
1.7 固定化Patatin酯酶稳定性及重复利用率测定
1.7.1 固定化前后 Patatin 酯酶耐热性测定
保持其他处理条件相同,分别将固定化酶和游离酶放置在30、40、50、60、70 ℃的环境中1 h。处理1 h后将固定化酶和游离酶取出,测定酶活力。根据酶活力绘制固定化酶和游离酶相对酶活力曲线,比较两者对热的耐受性。
1.7.2 固定化前后 Patatin 酯酶 pH 耐受性测定
保持其他处理条件相同,分别将固定化酶和游离酶放置在pH为4、5、6、7、8、9、10、11的环境中1 h。处理1 h后将固定化酶和游离酶取出,测定酶活力。根据酶活力绘制固定化酶和游离酶相对酶活力曲线,比较两者pH耐受性。
1.7.3 固定化 Patatin 酯酶重复利用率测定
称取制备好的固定化酶,在40 ℃、pH 7条件下连续反应5次,以第一次反应的酶活力为100%,探究该固定化酶的重复利用率。
2 结果与分析
2.1 SDS-PAGE鉴定结果
收集洗脱液,进行电泳分析 (图1)。在相对分子量为43 kD左右的位置有1条主要的蛋白质条带,与文献[17]中所得到的Patatin酯酶分子量基本一致。说明用Q-Sepharose Fast Flow 阴离子交换柱分离并用缓冲液Ⅱ洗脱下来的组分中含有目的蛋白质。
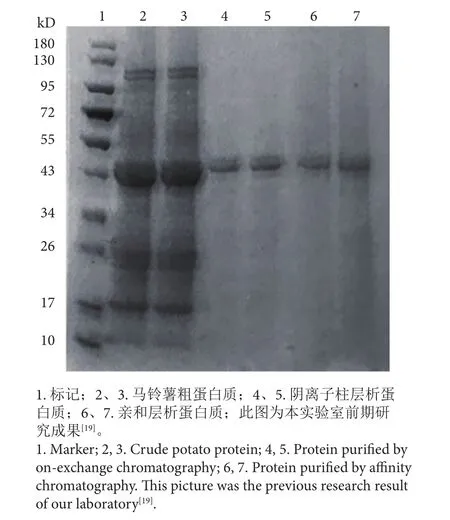
图1 亲和色谱分离组分SDS-PAGE分析结果Fig. 1 SDS-PAGE of fractiones separated by affinity chromatography
2.2 磁珠与ConA的偶联及其吸附率测定
根据1.3的方法绘制的标准曲线见图2,标准曲线方程为y=0.672 22x+0.140 16,R2=0.994 2,表明该模型可以解释响应值总变异的99.42%。
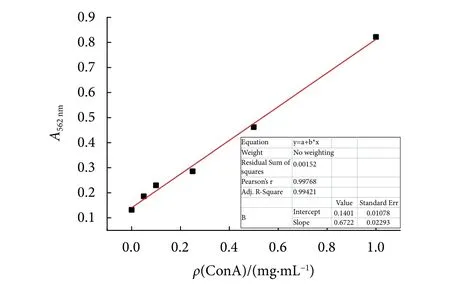
图2 BCA法测定蛋白质浓度标准曲线Fig. 2 Standard curve of protein concentration determined by BCA method
纳米磁珠ConA吸附量及其吸附率3个批次测定结果见表3,实验结果显示,每毫克磁珠平均吸附33.77 μg ConA,平均吸附率为24.50%。

表3 磁珠与ConA的偶联实验结果Table 3 Results of coupling experiment between magnetic beads and ConA
2.3 Patatin酯酶固定化条件优化
2.3.1 Patatin 酯酶最适固定化材料
PAA、SA、PS 3种材料中,PAA效果最好,SA效果最差 (图3)。PAA有一定的亲水性,同时又具有多孔的结构,能够增加载酶量的同时保证酶的高活性[20]。
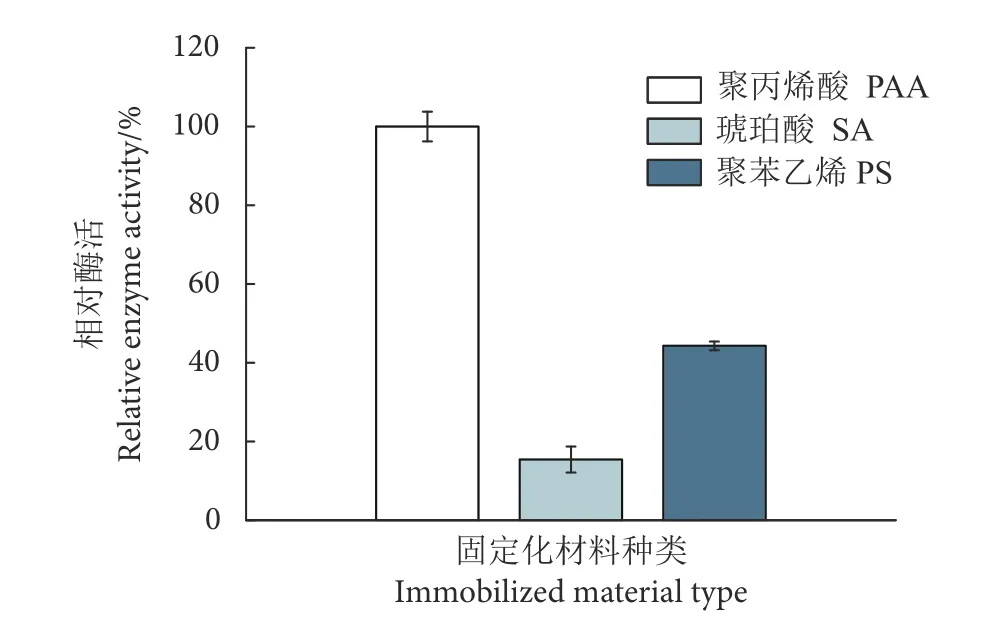
图3 固定化材料对Patatin酯酶固定化效果的影响Fig. 3 Effect of immobilized materials on immobilized patatin lipase
2.3.2 Patatin 最适固定化时间
随着固定化时间的增加,固定化效果呈现增加的趋势 (P<0.05,图4) ,说明固定化Patatin酯酶量增加,当时间超过50 min以后,随着时间的增加,磁珠固定化效果下降,因此最佳固定化时间为50 min。时间超过50 min后磁珠固定化效果下降,可能是因为固定化温度较高,固定化时间过长导致Patatin酯酶活性下降[21]。
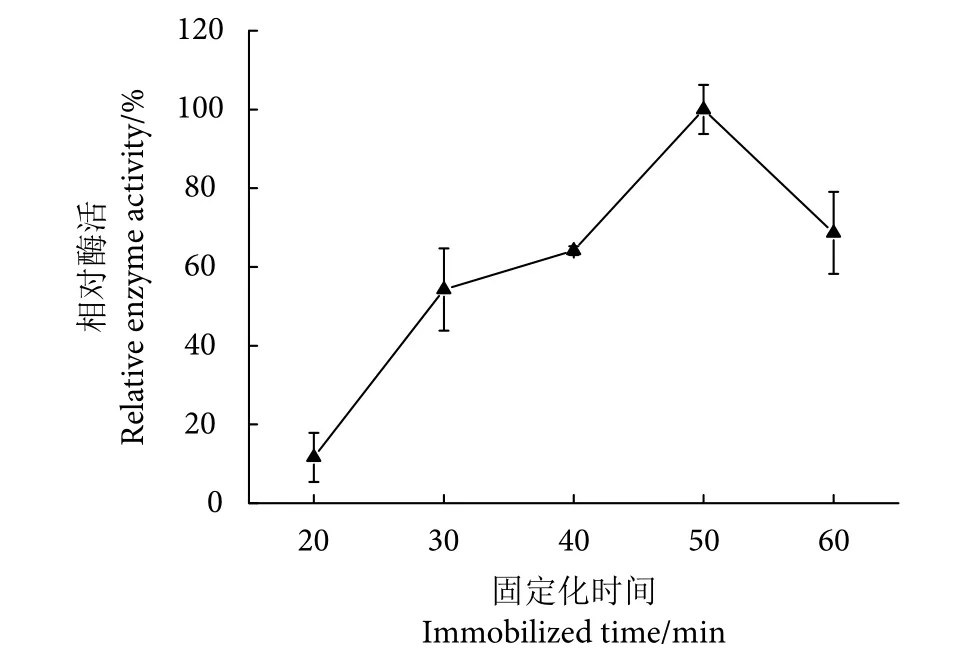
图4 固定化时间对Patatin酯酶固定化效果的影响Fig. 4 Effect of immobilized time on immobilized patatin lipase
2.3.3 Patatin 最适固定化温度
温度介于20~25 ℃,纳米磁珠固定化效果随温度升高而逐渐上升 (P<0.05) ,并且在25 ℃时固定化效果达到最大 (图5)。温度超过25 ℃以后,纳米磁珠固定化效果随温度的升高呈现下降趋势(P<0.05) 。纳米磁珠固定化效果率随温度升高而达到最大值时的温度被称为最适固定化温度,在本研究中最适固定化温度为25 ℃。固定化温度过低会导致磁珠固定化Patatin酯酶质量较低,但是固定化温度过高会导致蛋白质变性,从而降低纳米磁珠固定化效果。Patatin酯酶本质是一类具有催化作用的活性蛋白质,温度过高导致蛋白质变性,从而部分或全部失去其水解活性[22]。
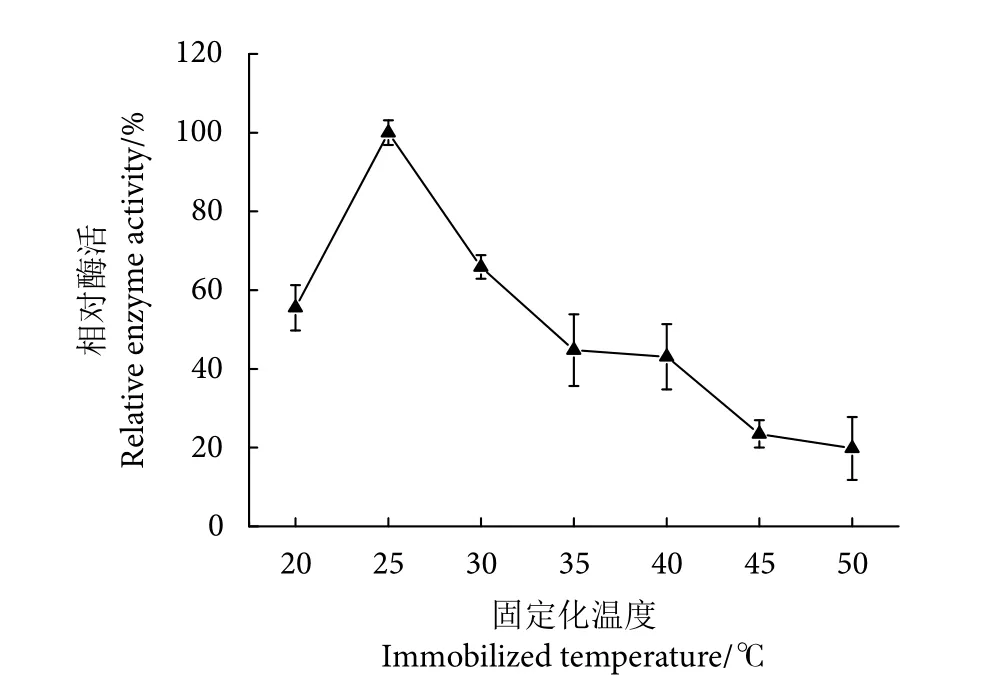
图5 固定化温度对Patatin酯酶固定化效果的影响Fig. 5 Effect of immobilized temperature on immobilized patatin lipase
2.3.4 Patatin 最适磁珠添加量
磁珠添加量介于1.0~3.0 mg·mL-1,固定化效果随磁珠添加量升高而逐渐上升(P<0.05) ,并且在3.0 mg·mL-1时固定化效果达到最大(图6)。磁珠添加量超过3.0 mg·mL-1以后,固定化效果随磁珠添加量的升高呈现下降趋势 (P<0.05) 。固定化效果随磁珠添加量升高而达到最大值时的添加量被称为最佳磁珠添加量[23],在本研究中最佳磁珠添加量为3.0 mg·mL-1。磁珠添加量过低会导致磁珠固定化Patatin质量较低,但是磁珠添加量过高会导致磁珠相对表面积增大,从而降低纳米磁珠固定化效果。
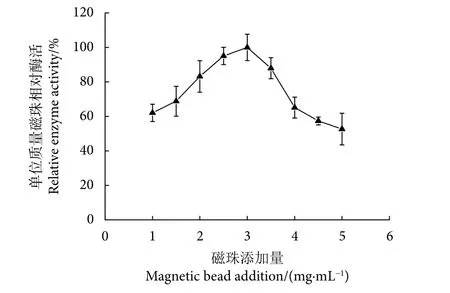
图6 磁珠添加量对Patatin酯酶固定化效果的影响Fig. 6 Effect of magnetic bead addition on immobilized patatin lipase
2.3.5 Patatin 最适固定化条件 Box-Benhnken 响应面实验
Box-Benhnken响应面试验设计及结果见表4。
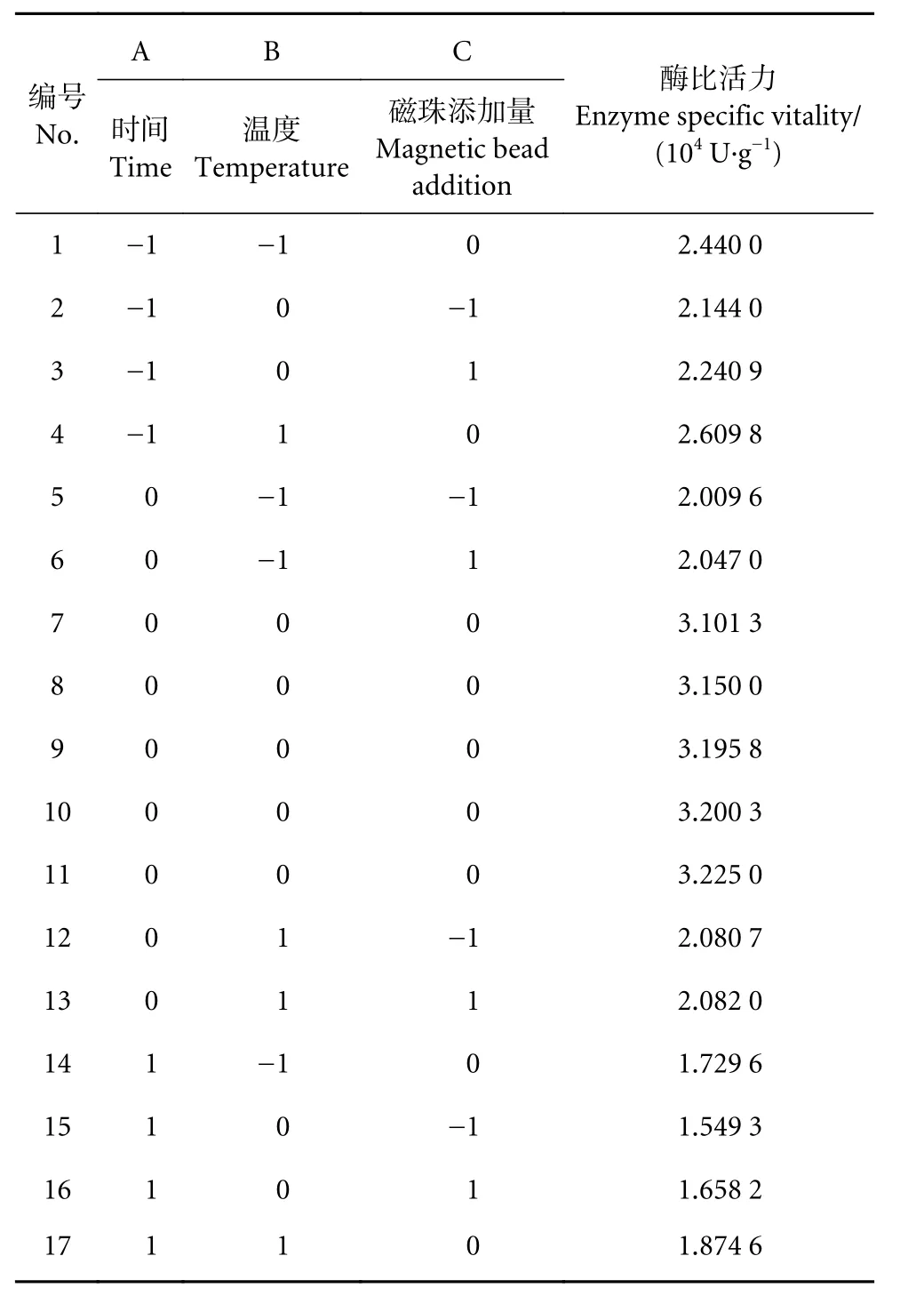
表4 Box-Benhnken响应面分析试验设计及结果Table 4 Box-Benhnken response surface design and experimental results
利用Design-Expert对数据进行计算分析,得到固定化时间 (A)、固定化温度 (B)、磁珠添加量(C) 3个因素的二次多项回归模型 (变量为归一化后的值) 为:
酶比活力=3.174 5-0.327 9A+0.052 6B+0.003 06C-0.006 2AB+0.003 0AC-0.009 0BC- 0.583 9A2-0.427 1B2-0.692 5C2
回归模型的显著性结果见表5,模型决定系数R2=0.995 1,说明该模型可以解释响应值总变异的99.51%,该回归模型显著 (P<0.000 1),失拟项不显著 (P=0.200 2>0.05),说明该模型可以用来拟合各自变量 (固定化时间A、固定化温度B、磁珠添加量C) 和因变量 (响应值) 之间的关系,并且可以用该模型对实验结果进行分析,可以利用该模型对酶解实验结果进行分析和预测,确定Patatin酯酶最佳固定化条件。由回归模型表达式可知,该模型最高次项为二次,不需要引入更高次数的项。
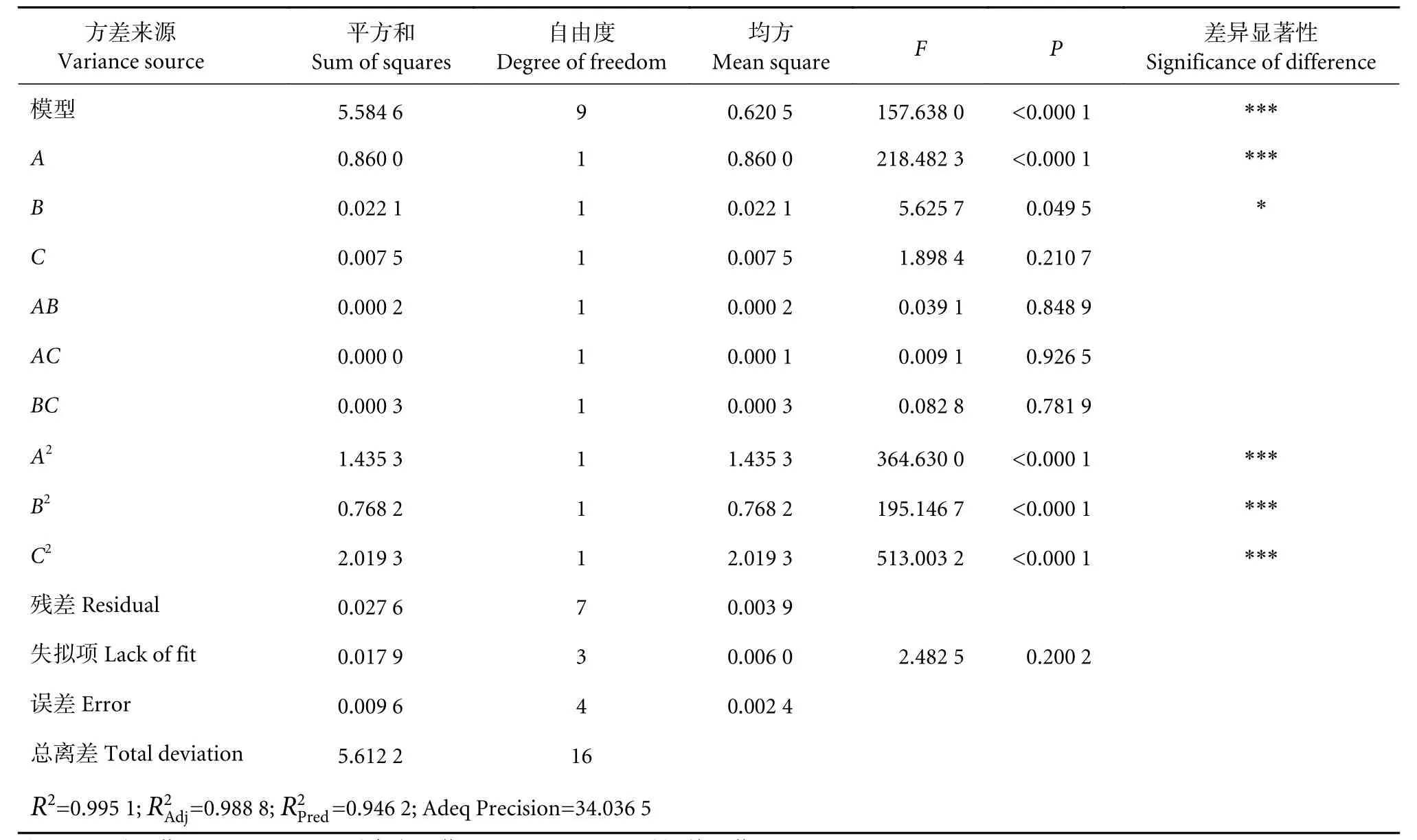
表5 Box-Benhnken响应面分析试验回归模型方差分析表Table 5 Analysis of variance (ANOVA) and results of Box-Benhnken response surface
基于回归模型建立响应面分析曲线见图7。由曲面图中的曲面形状和等高线分布情况可以看出,取得极值时的酶解反应条件出现在所选取的实验因素的范围之内。对回归模型函数求偏导,得到极值点A=-0.3、B=0.1、C=0.0,将极值点换算成试验条件并选择整数值作为实际操作条件,即为固定化时间47 min,固定化温度25 ℃,磁珠添加量为3 mg·mL-1。此条件下测得的酶比活力为3.223×104U·g-1。对求解所得的最佳酶解反应条件进行实验验证,经3次平行重复实验测得Patatin酶比活力为3.149×104U·g-1,相对误差为2.31%。实验结果说明回归模型有较好的拟合性,证明了回归模型的可行性较高。
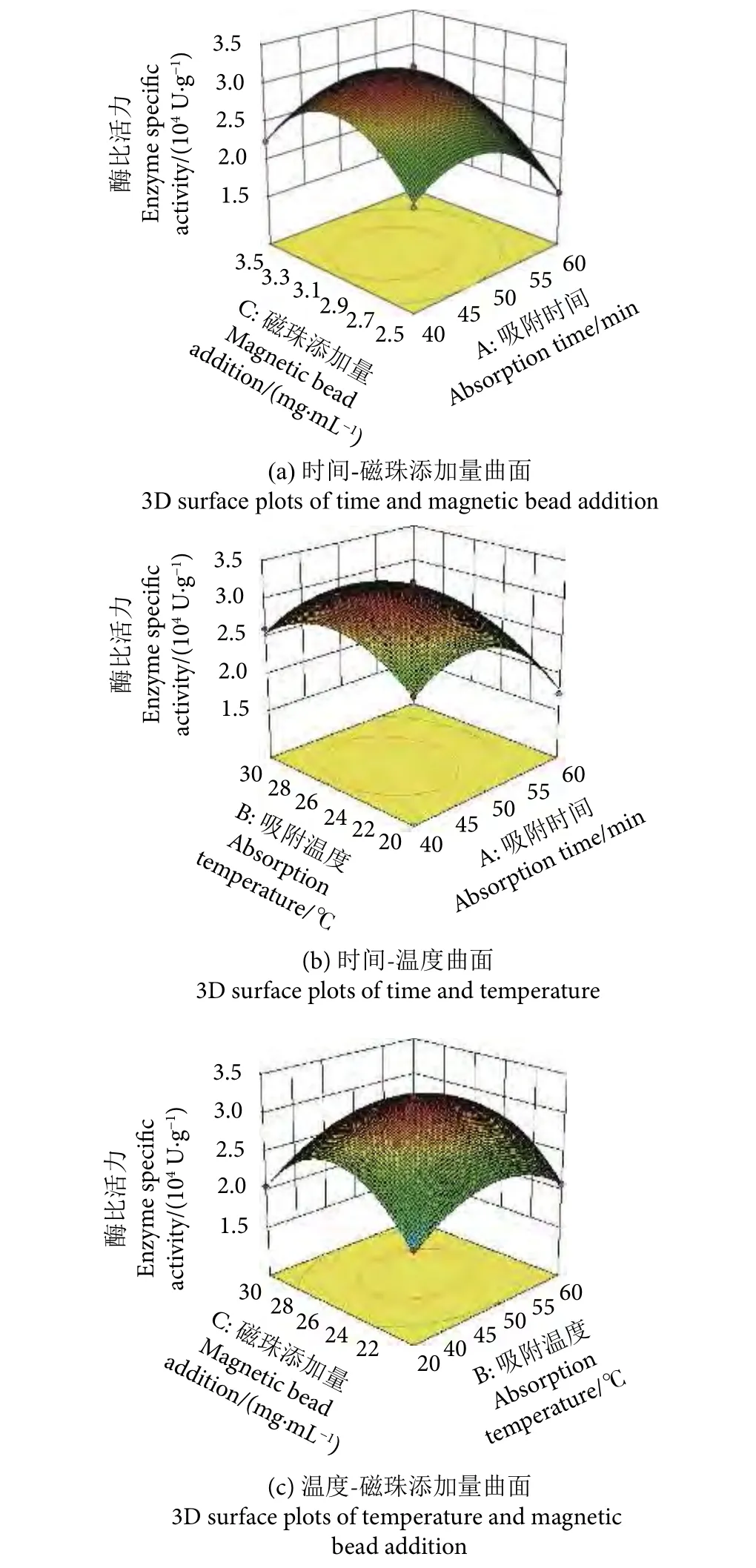
图7 各因素交互作用对Patatin酯酶固定化效果的响应曲面Fig. 7 Effects of various factors and their interactions on immobilized patatin lipase
2.4 Patatin酯酶固定化纳米磁珠特性分析
2.4.1 固定化纳米磁珠表面特征分析
Patatin酯酶固定化纳米磁珠从表面上可以明显看出其颗粒状且颗粒大小及分布较为均匀,而与Patatin酯酶结合后颗粒状消失并且形成较大且大小不均匀的块状物,可能是因为纳米磁珠与Patatin酯酶结合,蛋白固定化覆盖在磁珠表面形成较大颗粒,不易聚合 (图8-a、8-b)。

图8 Patatin酯酶固定化前 (a, b) 与固定化后 (c, d) 表面特征Fig. 8 Surface characteristics of magnetic beads before (a, b) and after (c, d) patatin lipase immobilization
2.4.2 固定化纳米磁珠 ζ-电势分析
Patatin酯酶在固定化前后ζ-电势见表6,可以看出纳米磁珠与Patatin酯酶结合之后,ζ-电势绝对值降低,说明结合后颗粒直径增大,分子间静电斥力减少,颗粒间稳定性降低。

表6 磁珠固定Patatin酯酶前后ζ-电势Table 6 ζ- potential of patatin lipase before and after magnetic beads immobilization
2.5 固定化Patatin酯酶最佳酶解条件
2.5.1 固定化 Patatin 酯酶最佳酶解 pH
在不同的pH条件下,固定化Patatin酯酶的酶解活性呈现出一定的差异,其酶解活性随pH先增大后降低,pH<7时,固定化Patatin酯酶的酶解活性随着pH的增加而显著上升 (P<0.05),当pH=7时,酶解活性达到最大值,pH>7以后,酶解活性随pH的增大而显著下降 (P<0.05,图9)。固定化Patatin酯酶的最适pH与游离的Patatin酯酶相同,说明Patatin酯酶与纳米磁珠载体结合后的构象变化并没有显著影响到Patatin酯酶对于氢离子 (H+) 的敏感度。
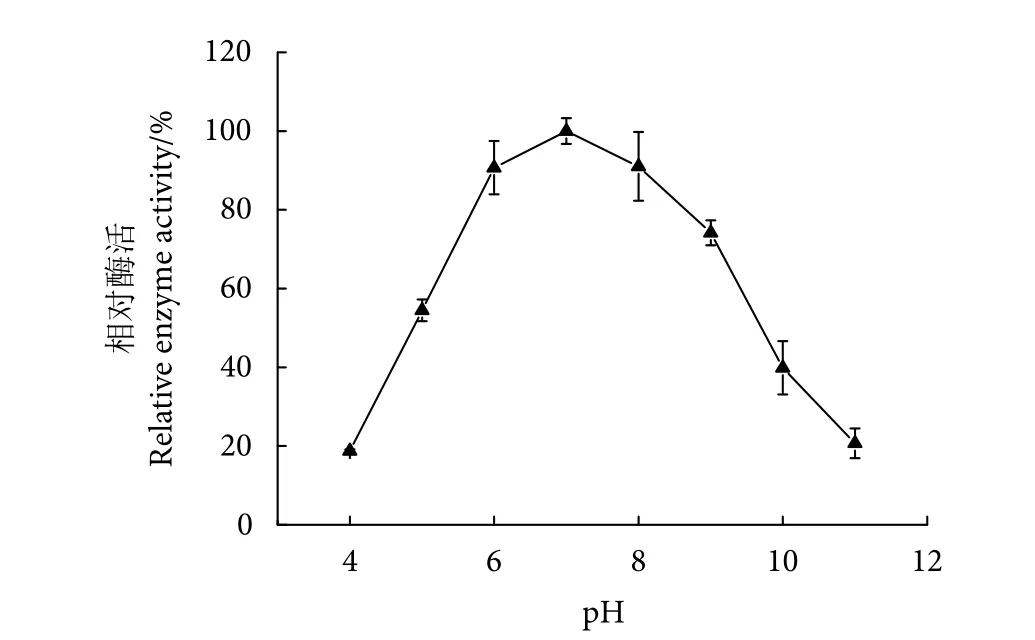
图9 pH对固定化Patatin酯酶酶解活性的影响Fig. 9 Effect of pH on enzymatic hydrolysis activity of immobilized patatin lipase
2.5.2 固定化 Patatin 酯酶最佳酶解温度
温度介于20~40 ℃,Patatin酯酶的酶解活性随温度的升高而逐渐上升 (P<0.05),并且在40 ℃时固定化效果达到最大 (图10)。温度超过40 ℃以后,纳米磁珠固定化效果随温度的升高呈现下降趋势 (P<0.05)。固定化Patatin酯酶最适酶解温度为40 ℃。Patatin酯酶本质是一类具有催化作用的活性蛋白质,温度过高导致蛋白质变性,从而部分或全部失去其水解活性。相较于游离的Patatin酯酶,固定化Patatin酯酶的最适温度略微升高,可能是因为Patatin酯酶和纳米磁珠结合后热稳定性提高而导致的。
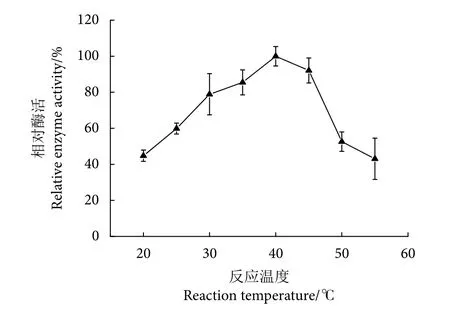
图10 温度对固定化Patatin酯酶酶解活性的影响Fig. 10 Effect of temperature on enzymatic hydrolysis activity of immobilized patatin lipase
2.6 固定化Patatin酯酶耐性及回收率
2.6.1 固定化前后 Patatin 酯酶耐热性
随着处理温度的升高,固定化Patatin酯酶和游离Patatin酯酶的活性降低 (图11)。当温度超过30 ℃时,随着温度的升高,游离Patatin酯酶的相对活性大大降低,而固定化Patatin酯酶的相对活性则缓慢降低。这可能是由于固定化Patatin酯酶与游离Patatin酯酶相比,限制了酶的构象变化,稳定了固定化酶的相对酶活性,降低了酶的失活程度,提高了固定化Patatin酯酶的耐高温性。
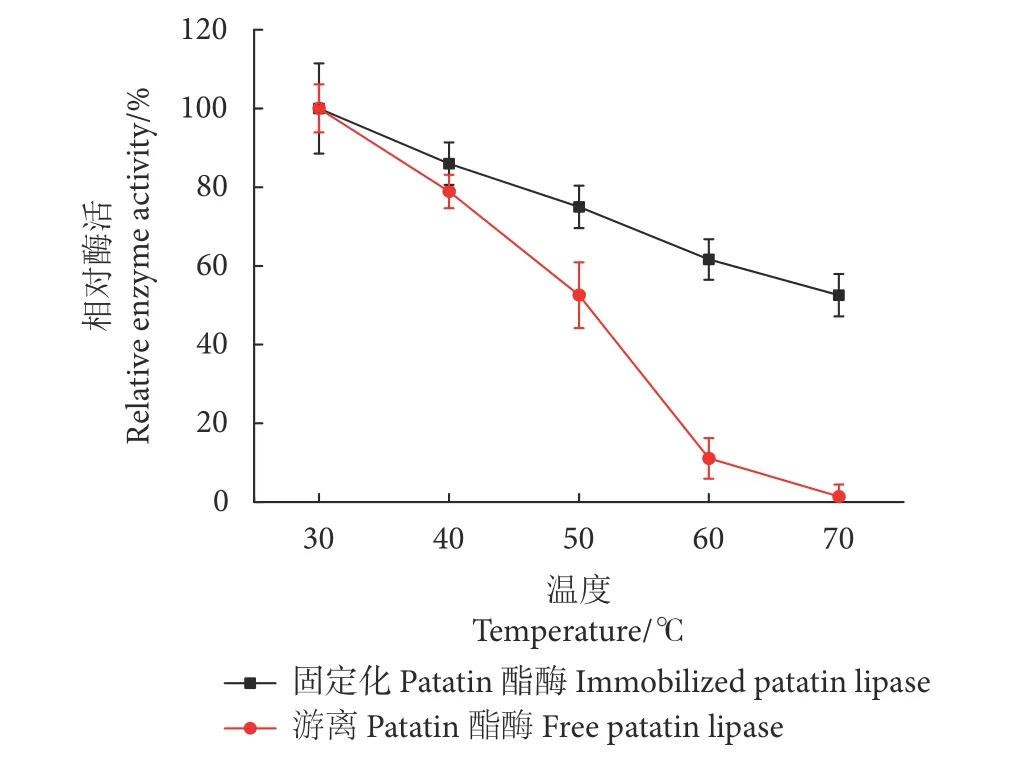
图11 温度对固定化前后Patatin酯酶稳定性的影响Fig. 11 Effect of temperature on enzymatic hydrolysis activity before and after patatin lipase immobilization
类比半抑制浓度 (Inhibitory concentration 50,IC50),本文定义半抑制条件 (Inhibitory condition 50, IC50)。对固定化前后Patatin酯酶温度耐受性结果利用SPSS进行线性回归分析 (表7)。游离Patatin酯酶的IC50为18.87 ℃,固定化Patatin酯酶的IC50为42.01 ℃。固定化后温度耐受性提高了123%左右。
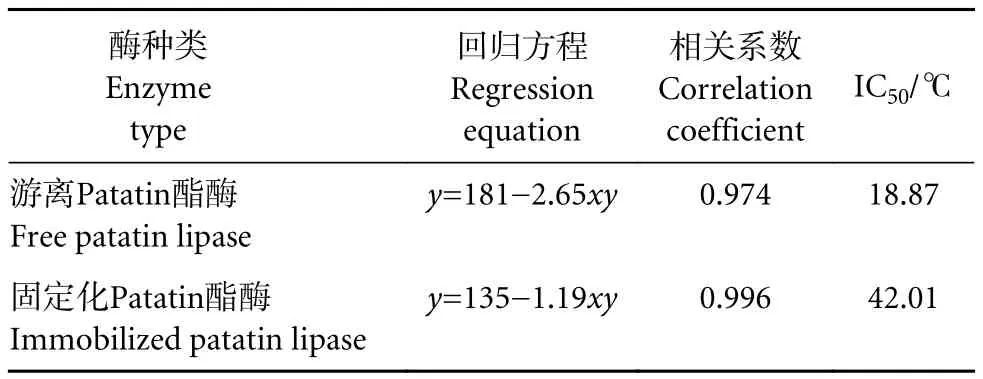
表7 固定化前后Patatin酯酶温度耐受性的回归分析Table 7 Regression analysis of temperature tolerance before and after patatin lipase immobilization
2.6.2 固定化前后 Patatin 酯酶 pH 耐受性
固定化Patatin酯酶对pH的抗性并不高 (图12)。只有在pH介于5~9,固定化Patatin酯酶保持稍微较高的酶相对活性。当pH值为5和9时,酶的相对活性分别为52.56%和46.85%。
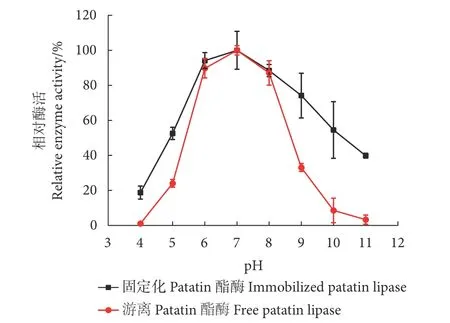
图12 pH对固定化前后Patatin酯酶稳定性的影响Fig. 12 Effect of pH on enzymatic hydrolysis activity before and after patatin lipase immobilization
对固定化前后Patatin酯酶pH耐受性结果利用SPSS进行多项式回归分析,结果见表8。游离Patatin酯酶的IC50为2.815,固定化Patatin酯酶的IC50为1.915。固定化后Patatin酯酶的pH耐受性提高了47%左右。

表8 固定化前后Patatin酯酶pH耐受性的回归分析Table 8 Regression analysis pH tolerance before and after patatin lipase immobilization
2.6.3 固定化 Patatin 酯酶操作重复利用率
固定化Patatin酯酶的重复利用率见图13。固定化Patatin酯酶连续反应5次后仍有56.60%的酶活力,相较于游离Patatin酯酶只能进行1次操作,固定化Patatin酯酶的重复利用率显著提高。
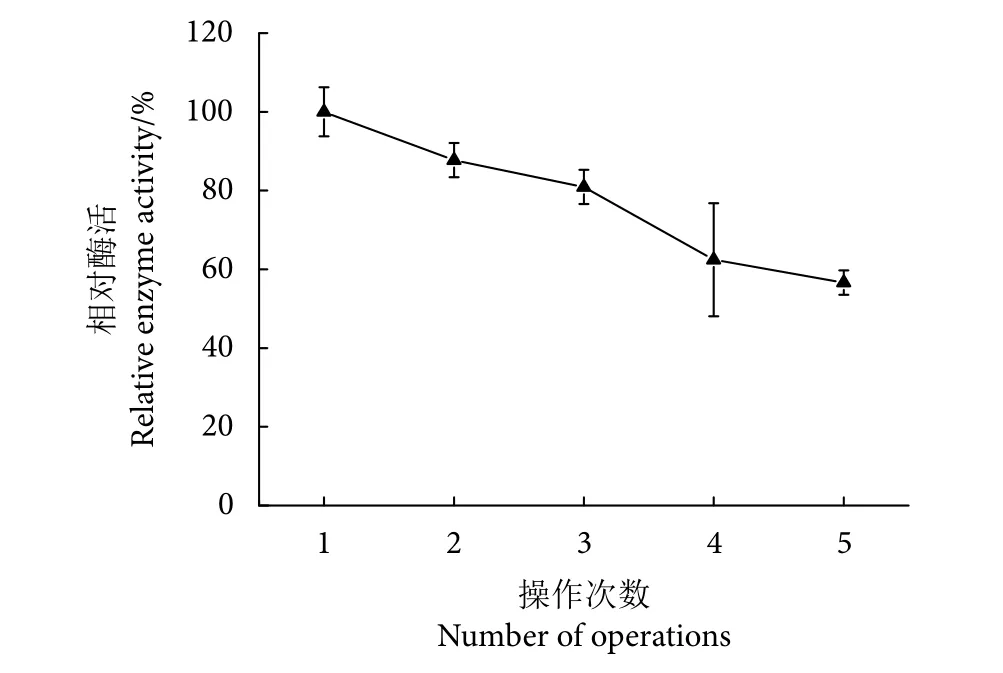
图13 固定化Patatin酯酶重复利用率Fig. 13 Reuse ratio of immobilized patatin lipase
3 结论
本文经筛选确定了使用PAA-Fe3O4进行Patatin酯酶固定化,其最优固定化条件为固定化时间47 min,固定化温度25 ℃,磁珠添加量为3 mg·mL-1。固定化Patatin酯酶在40.0 ℃、pH 7时水解底物活性最高。从结构分析发现纳米磁珠与Patatin酯酶结合后,Patatin酯酶覆盖在颗粒表面,颗粒直径变大,颗粒稳定性降低,有聚集颗粒形成。固定化Patatin酯酶的耐热性相比于游离Patatin酯酶提高了123%左右,pH耐受性提高了47%左右,连续反应5次后仍保留56.60%酶活力,说明纳米磁珠固定化后提高了Patatin酯酶的酶催化特性,研究为Patatin在水产品尤其是鱼油等脂类物质中的加工应用提供了有价值的参考。
