维生素A-DHA酯的酶法合成及纯化制备
2022-04-22高坤鹏孙建安毛相朝
高坤鹏,孙建安,毛相朝,
1. 中国海洋大学 食品科学与工程学院,山东 青岛 266003
2. 青岛海洋科学与技术试点国家实验室 海洋药物与生物制品功能实验室,山东 青岛 266237
维生素A参与机体的多种代谢活动,具有改善皮肤[1]、抗氧化[2]、增强免疫力[3]、维持正常视力[4]等多种生理功能。维生素A也被应用于水产养殖领域,有研究表明在养殖前期添加维生素A可以促进凡纳滨对虾 (Litopenaeus vannamei) 的生长,还能够提高其血清中溶菌酶和酚氧化酶的活力,增强其非特异性免疫反应[5]。建鲤 (Cyprinus carpio var. Jian) 饲养实验表明维生素A缺乏可能会导致幼建鲤饲料利用率下降,从而降低其生长速度,还会使其血液中的白细胞数量和溶菌酶活力下降,导致免疫功能受损[6]。可见,保证维生素A的摄入对机体的生长发育以及维持正常免疫力非常必要。然而,维生素A对光、热、氧不稳定,容易被氧化分解,而且过量的维生素A还会对皮肤产生一定的刺激作用。针对上述问题,目前已有大量研究通过化学法或酶法将维生素A转化为维生素酯来改善其不稳定性和刺激性[7-8]。与化学法相比,酶催化合成法更环保,副产物的积累也更少[9];但却存在酶法催化处理量较小,成本较高的问题。针对这些问题,可以通过无溶剂体系反应、固定化酶等策略进行改善。已有研究通过脂肪酶催化合成了维生素A月桂酸酯[10]、维生素A棕榈酸酯[11-12]、维生素A乳酸酯[13]等不同种类的维生素A酯。由于这些维生素A酯的酰基供体不同,它们的理化性质和功能活性也表现出一定的差异。维生素A琥珀酸单酯由于暴露出一个羧基而表现出更好的亲水性[14],而维生素A乳酸酯则由于乳酸的作用[15]而对改善皮肤表现出更好的活性。
二十二碳六烯酸 (Docosahexaenoic acid, DHA,22:6n-3) 是一种被广泛报道的ω-3多不饱和脂肪酸,能够促进大脑[16]和视网膜[17]的发育,同时还具有抗衰老[18]、抗菌[19]、抗氧化和抗炎[20]等多种生理活性。天然的DHA主要存在于海洋鱼类和藻类中,是最具代表性的海洋脂质,也是目前最风靡的海洋来源保健品之一。然而天然鱼油及藻油中DHA的浓度均较低[21],需要进一步提高浓度才能更好地发挥其作用。DHA乙酯 (Ethyl docosahexaenoate, EDHE) 是最常见的富含DHA的产品 (其相对含量甚至可达90%),但是其生物利用度明显低于甘油酯和游离脂肪酸[22]。已有研究利用脂肪酶或磷脂酶A1催化酯交换反应将EDHE转化为甘油酯[23]或磷脂[24]的形式,从而提高DHA的营养价值和生物利用度。李金章等[25]利用脂肪酶催化富含多不饱和脂肪酸的乙酯型鱼油与甘油酯发生酯交换反应,合成了多不饱和脂肪酸含量大于45%的甘油酯。孙兆敏等[26]则使用磷脂酶A1催化合成了含8.0% EPA和17.8% DHA的磷脂。
实际上,维生素A也可以作为DHA的酰基受体,它与DHA形成的酯化产物还可能兼具两者的生理活性。为了改善维生素A的稳定性,同时提高EDHE的生物利用度,本研究利用脂肪酶催化维生素A醋酸酯 (Vitamin A acetate, VAAE) 与EDHE发生转酯反应合成维生素A二十二碳六烯酸酯(Vitamin A docosahexaenoate, VADHE)。在液相和质谱鉴定基础上,利用硅胶柱层析法对合成产物进行了纯化,并对其全波长吸收和核磁共振碳谱进行了表征。最后分别对有机溶剂反应体系和无溶剂反应体系中的转酯反应进行了优化,使其在较短时间便可达到较高的转化率,为VADHE的大批量制备和后期功能活性研究奠定了基础。同时,本研究还可为一些具有特定性质的新型脂质的设计和合成提供参考。
1 材料与方法
1.1 材料与试剂
VAAE购自麦克林,纯度高于95.5%;乙酯型藻油购自西安仁邦生物科技有限公司,DHA相对含量88.9%;脂肪酶Novozyme435购自诺维信公司;C18填料 (Copure® C18 SPE Cartridges) 购自深圳逗点生物技术有限公司;色谱级甲醇用于液相检测;其余试剂如石油醚、正己烷等均为分析纯。
1.2 实验方法
1.2.1 有机溶剂体系中 VADHE 的合成
称取0.100 mmol VAAE于棕色反应瓶中,加入20 μL藻油和20 mg固定化酶Novozyme435,再加入2 mL有机溶剂溶解底物。反应体系充氮后立即密封,将反应瓶置于37 ℃水浴摇床上开始反应。反应6 h后离心除去固定化脂肪酶,用甲醇将上层反应液稀释50倍,稀释液过膜后用于液相检测。本环节依次对有机溶剂 (石油醚、正己烷、异辛烷、环己烷、乙腈、异丙醇、二甲亚砜)、VAAE添加量 (0.050、0.075、0.100、0.125、0.150 mmol)、反应温度 (25、30、35、40、45、50、55、60 ℃)、加酶量 (10、15、20、25、30、35 mg)、反应时间(1、3、6、9、12、24 h) 及含水量 (0、4、8、12、16、20 μL) 进行了优化。
1.2.2 无溶剂体系中 VADHE 的合成
称取1.000 mmol VAAE于棕色反应瓶中,再加入一定体积的藻油和50 mg固定化酶Novozyme-435。反应体系充氮后立即密封,将反应瓶置于37 ℃水浴摇床开始反应。反应6 h后离心除去固定化脂肪酶,用甲醇将上层反应液梯度稀释1 000倍,稀释液过膜后用于液相检测。本环节依次对藻油添加量 (500、600、700、800、900、1 000 μL)、反应温度 (25、30、35、40、45、50、 55、 60 ℃)、加酶量 (25、50、75、100、125、150 mg) 及反应时间 (30 min、1 h、2 h、4 h、8 h、12 h) 进行了优化。
1.2.3 反应体系中 VADHE 的纯化
用甲醇充分浸泡C18填料2 h,搅拌均匀后吸取硅胶粉末悬液装柱 (60 mm×10 mm),再使用甲醇充分冲洗,保证填料均匀且致密。将无溶剂体系反应后的反应液与4倍体积的甲醇混合,吹打均匀后吸取500 μL混合液上样,以甲醇为流动相 (流速2 mL·min-1) 进行洗脱。舍弃前30 mL洗脱液,之后用10 mL离心管接取洗脱液,每管收集8 mL。每管吸取洗脱液200 μL至96孔板,用全波长酶标仪(Thermo Scientific Multiskan FC) 测定其在327 nm处的吸光度。初步确定样品的保留时间。将可能含有目标化合物的样品用于液相检测,间隔5管测定。将纯度较高的几管样品合并后用液相检测其纯度,剩余样品旋转蒸发除去甲醇,用氘代氯仿复溶后用于核磁表征。
1.2.4 VADHE的分析检测
1) 参考高泽鑫[27]方法对反应体系中的各组分进行液相检测。使用日本岛津高效液相色谱仪,甲醇作为流动相,流速1 mL·min-1,C18液相色谱柱(150 mm×4.6 mm,粒径 5 μm),柱温箱 35 ℃,紫外检测波长为327 nm。反应转化率 (%) 计算公式如下:

式中:RC为反应转化率;S1为液相检测中VADHE的峰面积;S2为底物VAAE的峰面积;S3为水解产物游离维生素A的峰面积。
2) 液相-质谱联用鉴定。液相条件和上文一致,质谱分析采用正离子模式,扫描范围为50~700 eV。
3) 核磁共振碳谱表征。使用安捷伦Pro pulse 500 MHz核磁共振波谱仪,在室温条件下扫描6 h。
2 结果与分析
2.1 维生素A-DHA酯的鉴定、纯化及初步表征
反应体系中各组分的液相检测结果见图1-a,按照出峰顺序,3.154 min为VAAE的水解产物维生素A,3.967 min为底物VAAE,4~8 min可能是维生素A降解产物,14~21 min为藻油中脂肪酸乙酯与VAAE发生酯交换反应获得的产物,其中,16.333 min出峰为目的产物VADHE。采用高分辨液相-质谱联用 (安捷伦) 技术进一步对产物进行鉴定,图1-b展示了产物的质谱鉴定结果,其中,614.481 9是目的产物[M+NH4]+的分子量,635.424 3则是目的产物[M+K]+的分子量。
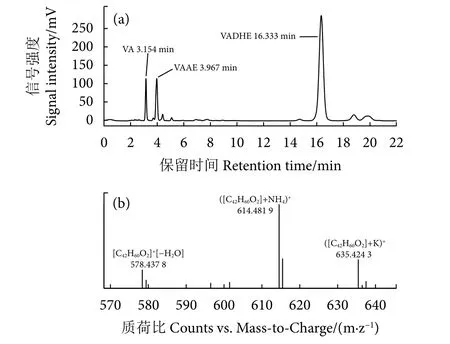
图1 维生素A-DHA酯 (VADHE) 的液相 (a) 和质谱 (b) 鉴定Fig. 1 Identification of vitamin A docosahexaenoate(VADHE) by HPLC (a) and MS (b)
利用柱层析法进行目标化合物的分离,参照液相检测时的洗脱条件,获得的洗脱曲线见图2-a,从图中可以清楚地看到两组峰。液相检测结果表明第一组化合物 (第0—第15管) 主要是VAAE以及水解副产物维生素A,两者不能被很好地分离,目的化合物VADHE主要在第二组 (20管之后)中。对第二组化合物进行间隔取样检测,测定了第21、第26、第31、第36和第41管样品的组分,发现第26—第36管样品纯度较高,第36管样品往后出现了较多其他脂肪酸与维生素A形成的酯。利用第31管样品 (纯度>93%) 测定了目标化合物在不同波长下的吸光度,结果表明其最大吸收波长为325 nm (图2-b) 。将第26—第36管样品混合均匀后液相检测其组分。结果表明,其纯度可以达到90%以上,可以用于核磁表征及后期的生理活性实验。

图2 VADHE的纯化洗脱曲线 (a) 、全波长扫描 (b) 和核磁共振碳谱 (c) 结果Fig. 2 Elution curve (a), full wavelength scanning (b) and 13C NMR (c) of VADHE
核磁共振碳谱结果见图2-c,参照维生素A棕榈酸酯[28-29]和EDHE[30]的13C NMR结果,可以推断出不同化学位移出峰所对应的碳原子。化学位移从高到低分别是173.18 (C20), 139.22 (C12), 137.96(C5), 137.72 (C16), 136.74 (C4), 135.94 (C15),132.2~125.9 (C10、C11、C13、C14、C17、C26、C27、C29、C30、C32、C33、C35、C37、C39、C41、C42),77.16 (CDCl3), 61.42 (C18), 39.77 (C1), 34.40 (C3),33.22 (C21), 29.85 (C6), 29.11 (C2), 25.75 (C28、C31、C34、C37、C40), 22.98 (C7、C8), 21.88 (C43),20.71 (C9), 19.42 (C23), 14.43 (C24), 12.90 (C44)。
2.2 有机溶剂体系合成VADHE反应条件优化
针对有机溶剂体系中的合成反应,本研究首先对有机溶剂的种类进行了优化。结果表明,反应转化率随有机溶剂的logP增大而增加,石油醚体系最有利于产物的生成 (图3-a)。Novozyme435在正己烷、环己烷和异辛烷这类非极性较强的溶剂中也能较好地发挥作用,而在异丙醇和二甲基亚砜中转化率极低。VAAE添加量的优化结果表明,随着VAAE添加量的提高,VADHE产量逐渐升高,但VAAE的转化率呈下降趋势 (图3-b)。从VADHE的产量变化曲线也可以看出,在VAAE添加量从0.050 mmol升至0.100 mmol的过程中,VADHE产量增长幅度较大,而当VAAE添加量继续升高时,VADHE产量的增长幅度变小。为节约成本,选择添加0.100 mmol VAAE进行后续研究。反应温度优化的结果表明 (图3-c),从25 ℃到40 ℃,随着温度升高,目的产物的转化率也有所提高,可能因为温度升高加快了分子运动,从而更有利于酶分子与底物分子的接触。当温度继续升高时,较高的温度加速了酶的失活,因此转化率出现明显下降,最终以40 ℃作为最佳反应温度。另外,从图3-c中也能观察到,当温度从25 ℃升至40 ℃时,反应转化率只是缓慢增加,因此,即使不控制温度,在室温条件下也可获得较高的产量,有利于节约能源。

图3 VADHE在有机溶剂体系中合成反应条件的优化Fig. 3 Optimization of synthetic reaction conditions in organic solvent systems of VADHE
本研究测定了不同酶添加量条件下反应体系中目的产物的含量,结果表明,从10 mg到25 mg反应转化率有比较明显的提高;当加酶量继续增加时,转化率提升幅度较小,因此选择添加25 mg固定化酶来进行后续研究 (图3-d)。反应时间对转化率的影响见图3-e,前6 h由于底物VAAE含量较高,脂肪酶能够较快地催化转酯反应,产物转化率随着时间延长明显提高。当反应时间继续延长时 (6~24 h),由于反应体系中VAAE浓度大大降低,转化率的提高幅度明显变小,趋于稳定,因此选用6 h作为最适反应时间。最后,含水量对反应转化率影响的实验表明,含水量对Novozyme435催化产物生成的效率影响不是很大,并没有呈现出较强的规律性(图3-f)。Jahangiri等[31]同样利用脂肪酶Novozyme-435催化转酯反应,水分活度与转酯反应效率呈现出负相关关系。当水分活度为0时,脂肪酶可以比较好地催化胭脂素和山梨醇发生转酯反应,合成降胭脂树素山梨醇酯。而当水分活度逐渐升高时,脂肪酶转酯反应效率大大降低,转而催化水解反应生成降胭脂树素。从这个角度来看,当用Novozyme435催化VADHE的合成时,反应体系中的微量水 (1%以下) 不会很明显地抑制转酯反应的进行,反应转化率更加稳定。
2.3 无溶剂体系合成VADHE反应条件优化
相较于有机溶剂体系,无溶剂体系可以减少有机溶剂的使用,有利于保护环境,消除有机溶剂残留的风险,减弱有机溶剂对酶的毒害作用,还可以大量制备目的产物。反应优化的结果表明不同藻油添加量对于转化率的影响不是很大,最高值和最低值的差值还不到2%,700 μL的藻油更有利于反应的进行 (图4-a)。藻油添加量较小时会导致体系流动性不佳,不利于反应的进行,而当藻油添加量较大时,一方面降低了体系中VAAE的浓度,另一方面,藻油本身含有微量的水,大量添加藻油时,体系中的含水量也会增加,部分脂肪酶可能会被用于EDHE的水解,也不利于合成反应的进行。无溶剂体系中的温度梯度实验表明,在55 ℃下进行反应更有利于底物转化为目的产物 (图4-b),这与有机溶剂体系中的优化结果相差较大。推测可能是在较低的温度下,体系比较黏稠,不利于传质,而在更高的温度时,反应体系具备更好的流动性,从而增加了传质效率,有利于两种底物和酶的接触。

图4 VADHE在无溶剂体系中合成反应条件的优化Fig. 4 Optimization of synthetic reaction conditions in solvent-free systems of VADHE
无溶剂体系中加酶量的优化结果见图4-c,转化率随着加酶量的增加呈现出一个先升高再平缓的变化趋势。当加酶量由25 mg增加至50 mg时,反应转化率明显提高,当加酶量继续提升到100 mg时,转化率也出现一定程度的提升,随着加酶量的继续增加,变化趋势趋于平缓。考虑到酶的成本,选择100 mg固定化酶添加量继续进行反应时间的优化。反应转化率随着时间呈现先升后降的变化趋势 (图4-d),反应2 h已经能够达到40%,4 和8 h的转化率几乎一样,均为56%左右,12 h的转化率降低至51.25%。因此选择4 h作为最佳反应时间,此时的转化率为56.39%。可以看出,无溶剂体系的转化率明显高于有机溶剂反应体系,且相较于有机溶剂体系,用4倍的酶量就可以处理10倍的底物 (以VAAE的添加量计),这对于节约成本也具有重要意义。Nurshakila等[32]同样分别在有机溶剂体系和无溶剂体系中尝试了己酸乙酯的酶促合成,在两种体系中的转化率分别达到68%和48%;结果与本文相反,可能是脂肪酶本身的性质以及反应底物的种类不同,导致Novozyme435更适合于在无溶剂体系中催化VAAE与EDHE的转酯。然而值得注意的是,无溶剂体系需要添加较多的藻油来维持体系的流动性,因此在一定程度上造成了EDHE的浪费,后期有必要尝试将反应体系中未反应的EDHE 分离回收,日后用来继续反应以减少浪费。
3 结论
本研究立足于维生素A的不稳定性以及EDHE的低生物利用度,设计了VADHE这种新型化合物,继而利用脂肪酶Novozyme435催化乙酯型藻油中的EDHE与VAAE发生转酯反应,实现了VADHE的合成。此外,还利用柱层析法对反应体系中的VADHE进行了纯化,并对其全波长吸收和核磁共振碳谱进行了表征。同时,经液相检测,纯化后目的产物的纯度可以达到90%以上。为了提高目的化合物得率,本研究进一步对有机溶剂体系和无溶剂体系中的转酯反应进行了优化。在有机溶剂体系中,以石油醚作为反应溶剂,藻油用量20 μL,VAAE用量0.100 mmol,反应温度40 ℃时,25 mg脂肪酶可在6 h内催化40.61%的VAAE转化为VADHE;在无溶剂体系中,100 mg脂肪酶在4 h内即可催化56%以上的VAAE 转化为VADHE (VAAE用量为1.000 mmol)。本文首次报道了VADHE的合成,且能够通过比较简单的纯化方式获得纯度较高的样品,这也为对该化合物进行更进一步的功能活性研究打下了基础。由于维生素A和DHA均有利于维持视力,且均具有抗衰老、抗氧化的生理活性,两者的酯化产物可能会表现出更强的生理活性。另一方面,VADHE可能是一种同时具有维生素A和DHA生物活性的双功能分子,使其有可能应用于更广泛的领域。后期还需要更多的实验对合成产物的稳定性、功能活性等进行研究,从而评估该化合物的应用潜力。
