地衣芽孢杆菌几丁质酶在枯草芽孢杆菌中的重组表达及其制备氨基寡糖的研究
2022-04-22宿玲恰朱昫飏
袁 源 ,宿玲恰 ,张 康 ,朱昫飏 ,夏 伟 ,吴 敬
1. 江南大学/食品科学与技术国家重点实验室,江苏 无锡 214122
2. 江南大学 生物工程学院,江苏 无锡 214122
几丁质又称甲壳素,是自然界中含量仅次于纤维素的天然高分子多糖[1],广泛存在于虾蟹、昆虫等甲壳类动物外壳及节肢动物外骨骼中,是真菌细胞壁的基本组分。由于天然存在的几丁质性质稳定,难溶于水、稀酸、碱,只溶于强无机酸,故很难被高效利用[2]。壳聚糖是甲壳素部分脱乙酰基的衍生物,是天然多糖中唯一的碱性多糖[3],壳聚糖具有优异的生物学功能[4],如抗菌、抗肿瘤、提高免疫力,且安全无毒,是拥有巨大应用潜力的功能性生物材料。但壳聚糖分子量较大,人体难以吸收,未处理的壳聚糖只能溶于某些酸性溶液,黏度较高,使其在开发应用上受到极大限制。
几丁质断裂β-1,4-糖苷键生成的产物几丁寡糖和壳聚糖解聚生成的壳寡糖统称为氨基寡糖,聚合度低于10。氨基寡糖具有优越的溶解性和多种生理功能,如益生元特性[5];这些寡糖可作为碳源支持有益肠道细菌的选择性生长;壳寡糖中的氨基和羟基可以结合养殖用水中的金属离子,净化养殖用水,防止金属离子对水产动物的毒害[6]。氨基寡糖具有高聚合度多糖不可比拟的优越性能,在食品、医药、水产养殖等领域具有极好的应用价值,其规模化生产越来越受到关注。
几丁质酶 (EC 3.2.1.14) 能催化水解N-乙酰氨基葡萄糖 (GlcNAc) 多聚物中的β-1,4-糖苷键,根据与底物作用的位置不同,几丁质降解酶可分为β-N-乙酰葡萄糖苷酶、内切几丁质酶和外切几丁质酶[7]。其中β-N-乙酰葡萄糖苷酶能够从非还原末端切割糖苷键释放GlcNAc单体;内切几丁质酶能够在多聚物中随机切割糖苷键生成不同聚合度的寡糖;外切几丁质酶能够在多聚物末端以二聚体为单位切割糖苷键生成几丁二糖。
据统计,每年海洋生物的几丁质合成量超10亿吨[8],水产及食品工业都会排放大量的甲壳素垃圾,造成严峻的环境问题。另一方面,通过几丁质酶高效降解几丁质及其衍生物的废弃物以提高其利用率、获得优良的氨基寡糖具有广阔前景[9]。本文将从海洋藻类中分离得到的地衣芽孢杆菌 (Bacillus licheniformis) 中的几丁质酶基因blchiA在枯草芽孢杆菌 (B. subtilis) 中进行重组表达,表征其酶学性质,重组酶有较广泛的pH耐受性和良好的热稳定性,研究发现重组酶对壳聚糖和胶体几丁质的水解模式有明显区别,可获得不同类型和不同聚合度的氨基寡糖,为制备氨基寡糖的工业应用奠定了基础。
1 材料与方法
1.1 材料与试剂
blchiA (WP_016886405) 经密码子优化由上海捷瑞生物工程有限公司合成,并与载体pET-20b(+) 连接获得pET-20b(+)-blchiA。表达载体pHY300PLK[10]和表达宿主菌B. subtilis WS9[10-11]由笔者实验室前期构建并保存,JM109感受态购于大连宝生物有限公司;无缝克隆试剂盒购于诺唯赞生物科技股份有限公司;蛋白浓度测定试剂盒购于碧云天生物公司;壳聚糖、壳寡糖标准品购于青岛博智汇力生物科技有限公司;盐酸氨基葡萄糖购于上海甄准生物有限公司;胶体几丁质、N-乙酰氨基葡萄糖购于Sigma公司;其他分析纯试剂均购于国药集团化学试剂有限公司。
LB培养基 (g·L-1):酵母粉5.00,胰蛋白胨10.00,氯化钠10.00;TB培养基 (g·L-1):酵母粉24.00,甘油5.00,胰蛋白胨12.00,磷酸氢二钾12.54,磷酸二氢钾2.31。
1.2 方法
1.2.1 blchiA基因克隆与表达载体构建
设计正向引物 (5'-CTGCGAGTGCTGAAGCCA TGGATAGCGGCAAAAATTATAAAATCATCGG-3')和反向引物 (5'-TTTTTATTACCAAGCTTTTATTCG CAGCCGCCGATAAG-3'),以 pET-20b(+)-blchiA为模板扩增blchiA基因。PCR产物用琼脂糖凝胶电泳验证,回收目的基因片段。设计正向引物(5'-TAAAAGCTTGGTAATAAAAAAACACCTCCAA G-3') 和反向引物 (5'-CATGGCTTCAGCACTCGCA G-3') 通过PCR扩增pHY300PLK载体,采用无缝克隆的方法将几丁质酶基因blchiA重组到质粒p H Y 3 0 0 P L K载体上,获得重组表达质粒pHY300PLK-blchiA。将重组质粒转化到感受态细胞E.coli JM109中,挑选阳性转化子进行酶切验证并送测序。将测序正确的质粒转化到感受态细胞B. subtilis WS9中,获得枯草芽孢杆菌工程菌WS9/pHY300PLK-blchiA。
1.2.2 blchiA基因表达
将构建的枯草芽孢杆菌工程菌接种至含有100 mg·L-1四环素(Tet)的LB液体培养基中,37 ℃、200 r·min-1振荡培养,当菌液OD600达0.6~0.8时,调整温度至33 ℃、200 r·min-1振荡培养48 h,每隔6 h取样。将菌液4 ℃、12 000 r·min-1离心10 min,收集上清液,适当稀释测定酶活。取OD600为5.0的菌体沉淀用一定体积的缓冲液重悬菌体,超声破碎10 min (功率135 W,破碎3 s,间歇2 s),将获得的悬液12 000 r·min-1离心10 min,收集细胞破碎上清液。
1.2.3 重组酶BLCHIA的纯化
利用亲和层析镍柱纯化上述制备的重组蛋白。平衡液 (pH 7.4) 为 25 mmol·L-1Tris-HCl、500 mmol·L-1NaCl,0.45 μm滤膜过滤除菌;洗脱液 (pH 7.4)为 25 mmol·L-1Tris-HCl、500 mmol·L-1NaCl和300 mmol·L-1咪唑,0.45 μm 滤膜过滤除菌。梯度洗脱得到BLCHIA纯化蛋白,将洗脱液超滤浓缩,用缓冲液复性并检测几丁质酶活性,用Bradford方法测定其蛋白浓度,利用SDS-PAGE分析纯化BLCHIA蛋白。
1.2.4 重组酶BLCHIA的胶体几丁质水解酶活
采用3,5-二硝基水杨酸 (DNS) 法[12-13]测定总还原糖量。以10 mg·mL-1的胶体几丁质为底物,250 μL胶体几丁质和150 μL磷酸柠檬酸盐缓冲液(50 mmol·L-1) 在反应温度下预热 10 min,加入100 μL适当稀释的发酵上清液/纯酶液混合均匀,60 ℃水浴反应1 h,加入2 mL的DNS混合均匀以终止反应,在沸水中煮沸10 min,立即冷却至室温;以加入等量灭活的酶液作为空白对照。12 000 r·min-1离心5 min,取上清液于540 nm检测吸光度。由标准曲线计算酶活。将60 ℃每分钟释放1 μmol GlcNAc所需的酶量定义为1个酶活单位 (U)。
1.2.5 重组酶BLCHIA的壳聚糖水解酶活
以脱乙酰度>95%的壳聚糖为反应底物,在10 mg·mL-1的底物浓度和最适反应条件下测定重组酶的酶活。350 μL的壳聚糖中加入50 μL稀释的纯酶液,混合均匀在60 ℃水浴反应15 min,加入600 μL DNS混合均匀以终止反应,在沸水中煮沸10 min,立即冷却至室温;以加入等量灭活的酶液为空白对照。12 000 r·min-1离心5 min,取上清液于540 nm检测吸光度。由标准曲线计算酶活。将60 ℃ 每分钟释放 1 μmol 氨基葡萄糖 (GlcN) 所需的酶量定义为1 U。
1.2.6 重组酶BLCHIA的酶学性质研究
1) pH对重组酶BLCHIA酶活和稳定性的影响。将重组酶BLCHIA用不同pH的50 mmol·L-1缓冲液稀释 (pH为3.0的甘氨酸-盐酸缓冲液、pH为4.0~8.0的磷酸氢二钠-柠檬酸缓冲液、pH为9.0~10.0的甘氨酸-氢氧化钠缓冲液),以1.2.4中的方法测定酶活,定义最高酶活为100%,计算不同pH下的相对酶活,确定重组酶的最适反应pH。
将重组酶BLCHIA与不同pH的上述缓冲液混合,4 ℃保温24 h,在最适pH下测定残余酶活,以未处理的酶活为100%,计算各pH下重组酶的相对残余酶活。
2) 温度对重组酶BLCHIA酶活和稳定性的影响。在不同温度 (30~70 ℃) 和最适pH下以1.2.4中的方法测定BLCHIA的酶活。定义最高酶活为100%,计算不同温度下的相对酶活,确定重组酶的最适反应温度。将重组酶在60 ℃保温不同时间,在最适pH和温度下测定酶活,以未处理的酶活为100%,计算保温不同时间后重组酶的相对残余酶活。
3) 金属离子对重组酶BLCHIA活性的影响。选择硫酸亚铁 (FeSO4)、氯化钙 (CaCl2)、氯化锰(MnCl2)、氯化铜 (CuCl2)、氯化镍 (NiCl2)、氯化镁 (MgCl2)、氯化铁 (FeCl3)、氯化锌 (ZnCl2)、氯化钴 (CoCl2) 测定金属离子对BLCHIA酶活性的影响。在最适pH下,将酶液与50 mmol·L-1的盐溶液混合,确保最终反应体系的金属离子浓度为10 mmol·L-1,4 ℃ 保温 24 h,以 1.2.4中的方法测定加入不同金属离子的酶活,定义最高酶活为100%,计算加入金属离子后重组酶的相对酶活。
1.2.7 重组酶BLCHIA水解特性测定
以脱乙酰度>95%的壳聚糖、胶体几丁质为底物测定重组酶BLCHIA的水解特性。将纯酶液按照3%的加量添加到30 mg·mL-1的壳聚糖溶液和胶体几丁质中,60 ℃、200 r·min-1反应5 h,分别在反应第15、第30、第60、第180、第300 分钟时取样,沸水浴10 min灭酶以终止反应,采用薄层色谱法 (TLC) 鉴定产物组成。取5 μL标准品和样品在TLC Silica gel 60 F254高效硅胶板上每间隔10 mm进行点样,将硅胶板置于预饱和好的层析缸中,采用上行法展开。按V(正丁醇)∶V(甲醇)∶V(28% 氨水)∶V(水)=5∶4∶2∶1作为展开剂[14],5%硫酸乙醇溶液作为显色剂,将充分展开后显色的硅胶板置于95 ℃烘箱中观察显色情况。采用Shodex NH2P-50 4E色谱柱 (5 μm, 250 mm×4.6 mm) 进行检测,柱温为30 ℃,乙腈-水为流动相,以75%~50%的乙腈进行梯度洗脱,流速设置为 1.0 mL·min-1,以10 μL 进样体积进样,检测器为蒸发光散射检测器。
1.2.8 数据处理
采用OriginPro 2021软件对数据进行统计分析,每组试验做3次平行,结果用“平均值±标准差 ()”表示。采用SPSS 20.0软件对数据进行显著性差异分析 (P<0.05)。
2 结果
2.1 表达载体构建与重组酶的表达
使用Hind Ⅲ限制性内切酶对构建的表达载体pHY300PLK-blchiA进行酶切验证 (图1)。在5 126和2 415 bp处有明亮的条带,与预期结果相符。由金唯智生物技术有限公司测序确定表达载体pHY300PLK-blchiA构建成功后,转入枯草芽孢杆菌宿主菌WS9。将该重组菌进行摇瓶发酵并每隔6 h取样测定产酶情况 (图2)。几丁质酶的酶活随发酵时间延长不断上升,48 h发酵上清液酶活可达0.72 U·mL-1。同时,检测发现发酵48 h的破碎上清液无几丁质酶酶活,表明几丁质酶BLCHIA已完全分泌到胞外。此外,本研究对将不含blchiA基因的空载体pHY300PLK转化至WS9,摇瓶发酵后进行了几丁质酶酶活的测定,未检测到酶活。表明地衣芽孢杆菌来源的几丁质酶基因blchiA在枯草芽孢杆菌中成功表达。

图1 pHY300PLK-blchiA表达载体的鉴定Fig. 1 Identification of pHY300PLK-blchiA expression vector

图2 重组几丁质酶BLCHIA摇瓶发酵过程的酶活Fig. 2 Enzyme activity of recombinant chitinase BLCHIA in shake flask fermentation
2.2 重组酶BLCHIA的纯化
发酵上清经过膜预处理后加载到亲和层析柱上,经梯度咪唑浓度对目的蛋白初步分离,SDSPAGE检测结果见图3。当咪唑浓度为100 mmol·L-1时,洗脱液经超滤浓缩,在66.4 kD左右处可见单一的目的蛋白条带。经测定,该条带对10 mg·mL-1的胶体几丁质及脱乙酰度>95%的壳聚糖均有水解活性。以胶体几丁质为底物测定BLCHIA纯酶液的比活为 3.68 U·mg-1。

图3 重组几丁质酶BLCHIA的分离纯化Fig. 3 Separation and purification of recombinant BLCHIA
2.3 重组酶性质表征
2.3.1 pH对重组酶BLCHIA酶活和稳定性的影响
重组酶在pH 4.0~9.0内都有较高活性,在pH 6.0时,酶活达到最高 (图4-a),由此确定BLCHIA适合在中性偏弱酸的环境中进行水解反应;重组几丁质酶在pH 介于3.0~10.0内能保持70%以上的活性,在pH介于4.0~8.0内能保持90%以上的活性,在pH 7.0时酶活保持效果最佳 (图4-b),说明该酶具有较广泛的pH耐受性。

图4 重组几丁质酶BLCHIA的最适pH (a) 和pH稳定性 (b)Fig. 4 Optimal pH (a) and pH stability (b) of recombinant chitinase BLCHIA
2.3.2 温度对重组酶BLCHIA酶活和稳定性的影响
提高反应温度可以增加酶促反应速率,但温度过高会破坏酶的三维结构导致酶变性失活,而具有良好的热稳定性是酶制剂工业化生产和应用的基础。重组几丁质酶BLCHIA在温度介于40~70 ℃内均有一定活性,在50~60 ℃的活性较高,在60 ℃时酶活达到最高 (图5-a),由此确定BLCHIA的最适反应温度为60 ℃,而温度高于60 ℃酶活下降明显。重组几丁质酶在60 ℃放置60 min时,残留酶活为85%以上;60 min后BLCHIA开始变得不稳定,酶活迅速降低;放置120 min后,酶活约为初始的50%;放置180 min残留酶活约为初始的30% (图5-b)。

图5 重组几丁质酶BLCHIA的最适温度 (a) 和热稳定性 (b)Fig. 5 Optimal temperature (a) and thermal stability (b) of recombinant chitinase BLCHIA
2.3.3 金属离子对重组酶BLCHIA活性的影响
金属离子可能会影响蛋白分子的结构稳定性或催化活性,适当浓度的盐可以减轻蛋白表面的静电力,使蛋白不容易形成紊乱结构,降低产生不可逆失活的概率[15]。加入 10 mmol·L-1铜离子 (Cu2+)可以使BLCHIA的酶活提至129.2%,亚铁离子(Fe2+) 可以轻微提高BLCHIA的活性,而镍离子(Ni2+)、镁离子 (Mg2+)、钙离子 (Ca2+)和锌离子(Zn2+) 会在一定程度上抑制BLCHIA的活性,其中Ni2+和Mg2+将酶活降至40.2%和45.8%,抑制程度较明显 (图6)。有研究报道,Mg2+、Ca2+、Mn2+等多种金属离子对几丁质酶活性均有明显的抑制作用[16],与其他报道的几丁质酶不同,重金属离子Cu2+明显提高了BLCHIA的活性。
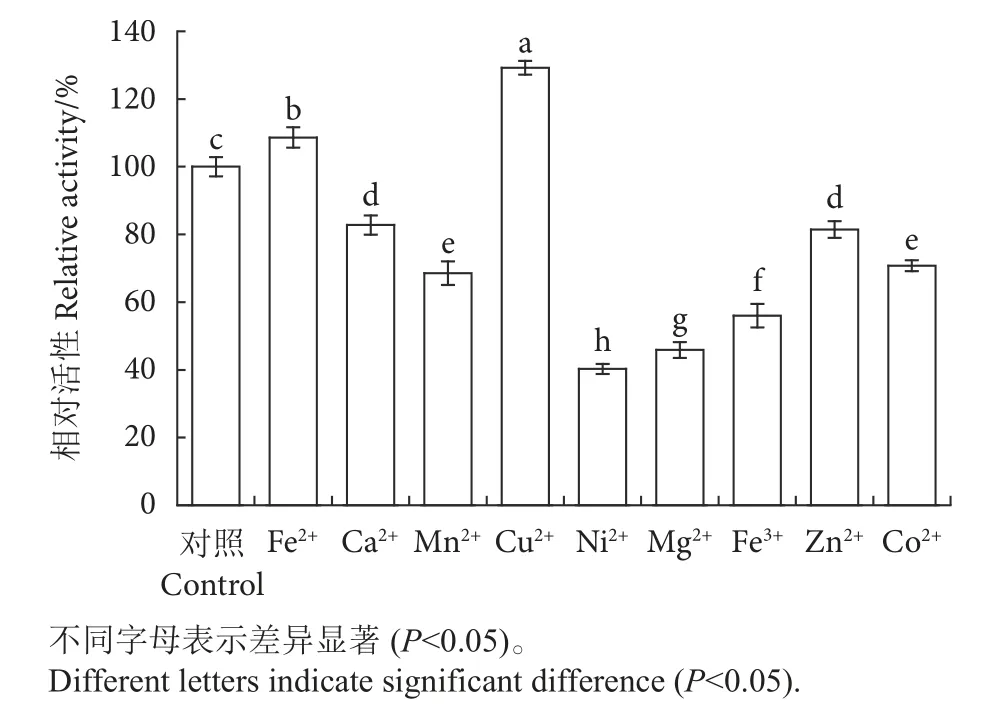
图6 金属离子对重组几丁质酶BLCHIA酶活的影响Fig. 6 Effect of metal ions on activity of recombinant chitinase BLCHIA
2.4 重组酶BLCHIA水解几丁质特性测定
通过薄层色谱分析了BLCHIA水解胶体几丁质的产物 (图7)。反应初期只有少量几丁二糖生成,随着反应时间的延长,几丁二糖逐渐累积并且没有更大聚合度的几丁寡糖生成。在以胶体几丁质为底物时,重组几丁质酶BLCHIA仅表现出外切活性,能够在几丁质末端以二聚体为单位切割β-1,4-糖苷键。
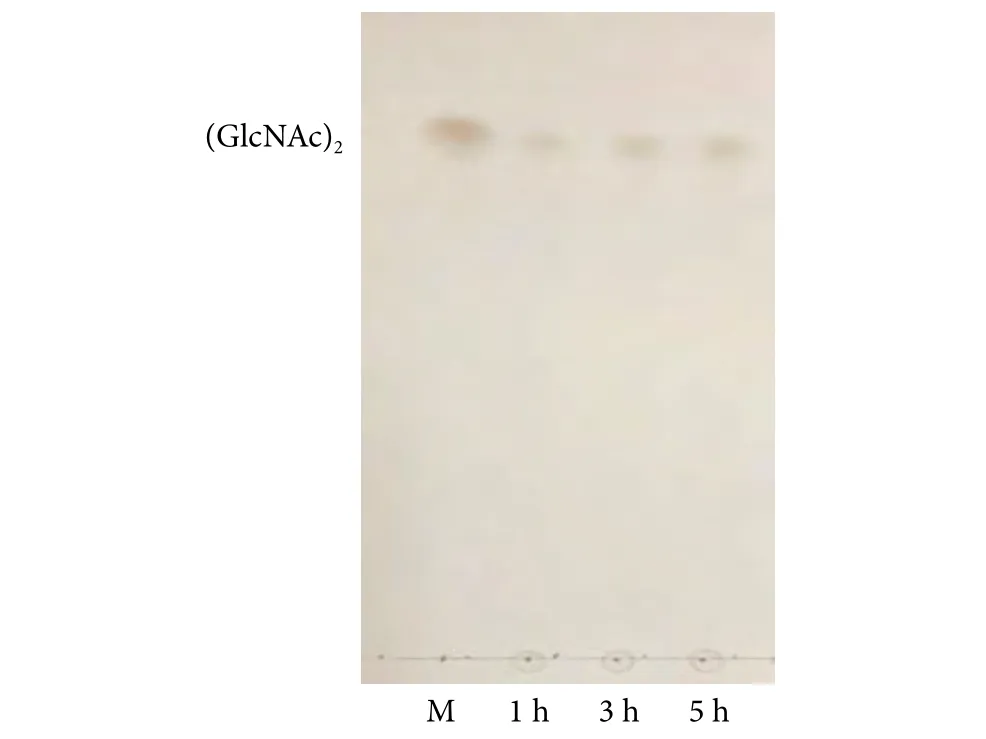
图7 BLCHIA水解胶体几丁质的薄层色谱分析Fig. 7 TLC analysis of BLCHIA hydrolyzed colloidal chitin
2.5 重组酶BLCHIA水解壳聚糖特性测定
本研究首先测定了重组几丁质酶BLCHIA纯酶液对脱乙酰度>95%的壳聚糖的水解活性,发现对壳聚糖的活性明显高于胶体几丁质,在10 mg·mL-1的底物浓度和最适反应条件下,以相同的酶活定义计算BLCHIA对壳聚糖的水解活性为4.52 U·mL-1,约为以胶体几丁质为底物酶活的4倍,说明BLCHIA更易和脱N-乙酰基的壳聚糖相互作用,更快速地切割壳聚糖链的糖苷键。
进一步通过薄层色谱检测了壳聚糖的水解产物(图8),以3% BLCHIA加酶量在最适反应条件下反应不同时间。反应过程中有一系列不同聚合度的壳寡糖生成,在反应初期只生成少量的壳二糖和壳三糖,以及较多的壳四糖、壳五糖。随着反应时间的延长,壳二糖占比增加,壳五糖和壳六糖占比明显减少,反应3 h后,壳五糖和壳六糖基本消失,说明BLCHIA持续将高聚合度的壳寡糖水解成低聚合度的壳寡糖。

图8 BLCHIA水解壳聚糖的薄层色谱分析Fig. 8 TLC analysis of BLCHIA hydrolyzed chitosan
本研究还将BLCHIA水解壳聚糖的产物进行HPLC检测,并采用面积归一化法定量分析水解壳聚糖不同时间生成的各产物比例 (表1)。结果显示,反应30 min即有二糖到七糖生成,其中三糖到五糖的占比超过70%;反应1 h以上,水解产物主要为二糖到五糖,其中壳三糖占比最高。反应1~3 h,壳二糖的相对占比从17.35 %增至26.54%。根据壳四糖、壳五塘和壳二糖的相对占比可知BLCHIA持续将高聚合度的寡糖分解成低聚合的寡糖;水解后期生成的壳三糖的占比超过35%,但是氨基葡萄糖始终没有明显增加,占比不超过产物总量的1%。结果表明,根据实际需求通过控制反应时间可获得不同含量的聚合度为2~7的壳寡糖。

表1 BLCHIA水解壳聚糖的产物峰面积占比Table 1 Proportion of peak area of BLCHIA hydrolyzed chitosan %
3 讨论
近年来,随着对海洋生物资源的开发,利用海洋微生物来源的多糖降解酶对多糖进行高效降解进而获得多种功能的低聚糖受到较高关注。几丁质及其衍生物是非常丰富且功能性很强的多糖资源,高表达量的几丁质降解酶对降解几丁质并生成有价值的氨基寡糖意义重大。如何获得几丁质酶在食品安全菌中的高效表达并催化降解几丁质及其衍生物成为研究热点。
目前已报道的海洋微生物来源的几丁质酶酶活普遍较低,嗜水气单胞菌 (Aeromonas hydrophilia)几丁质酶QDC01在基础发酵条件下所产粗酶液酶活为 0.21 U·mL-1[17],优化后最高酶活为 0.56 U·mL-1;海洋发光杆菌Photobacterium sp. LG-1几丁质酶经发酵条件优化最大酶活为0.34 U·mL-1(根据文中数据,按照本文的酶活定义折算)[18];近海海域的海泥中分离得到的扩展短杆菌 (Brevibacterium linens)最适条件产几丁质酶活为0.508 U·mL-1[19]。将分离到的几丁质酶在野生菌中表达,培养基成分复杂且发酵时间长达72~96 h。异源表达可以一定程度提高产量,根据实际需求选择合适的表达宿主也很必要。大肠杆菌 (Escherichia coli)[20]虽然是使用最广泛的表达宿主,但其周质空间内存在各种内毒素,产品的安全性需要考量;毕赤酵母 (Pichia pastoris)[20]作为表达宿主虽然分泌效率高,但发酵周期长,其产品的安全性也需考量;枯草芽孢杆菌[21]具有非致病性的特点,安全性高,同时培养周期短,对于工业生产缩短发酵周期也具有重要意义,是一种目前食品、药品、畜牧等行业生产各种工业用酶的理想表达宿主。本研究将几丁质酶基因blchiA在枯草芽孢杆菌中重组表达,重组几丁质酶的酶活为0.72 U·mL-1,具有较高的最适反应温度和良好的pH耐受性,具有工业化生产和应用的潜力。
海洋生物外壳 (虾、蟹壳) 是甲壳素类海洋多糖的主要来源,高度结晶致密,难以降解。对结晶甲壳素具有高活性的几丁质酶主要存在于GH18家族,且具有由2个几丁质插入结构域 (CID) 形成深的催化裂隙增强底物结合的结构特征,部分酶还含有几丁质结合域 (CBD)。此外,一些GH20家族的酶也具有该活性。本研究中的几丁质酶BLCHIA属于GH18家族糖苷水解酶,同时具有几丁质和壳聚糖水解活性,且对壳聚糖的水解活性更高。与米曲霉 (Aspergillus oryzae) 来源的β-乙酰己糖苷酶AoN-agase[22]相似,AoNagase是能同时水解壳聚糖和几丁质的GH20家族β-乙酰己糖苷酶,该酶对胶体几丁质的水解活性也低于壳聚糖。据报道,几丁质酶对不同底物的偏好性可能是CBD和结合位点附近的芳香族残基使其能够更有效地降解结晶几丁质,而缺乏CBD的几丁质酶可能偏好较少的结晶形式[23-25]。此外,催化区域中催化裂隙和底物结合位点的长度和深度似乎对底物特异性也有影响。在底物相互作用方面,氨基的氮原子比亚氨基的氮原子更能发生氢键作用,而乙酰氨基的氧原子更能与邻近的残基形成接触[26]。本研究推断BLCHIA对壳聚糖的水解能力优于几丁质可能由酶与两种底物可及性的差异所造成,有必要进一步研究BLCHIA的三维结构以及催化结构域与其功能的关系。
本研究进一步检测了重组酶BLCHIA降解几丁质的产物。BLCHIA降解胶体几丁质主要生成几丁二糖,体现出外切活性,产物类型单一易于分离纯化。在医疗方面,几丁二糖能防止术后组织粘连,是一种安全性高、易吸收和降解的生物材料。此外,几丁二糖被证明能强烈诱导几丁质酶在某些微生物中的表达,如链霉菌和蘑菇[27-28]。
壳寡糖是甲壳素类海洋多糖资源化利用的主要产品类型,目前其酶解制备主要存在降解效率低、酶解产物特异性差的问题。未经降黏处理的高浓度的壳聚糖酶解效果普遍较差[29-30],原因在于壳聚糖黏度过高影响酶的扩散,会限制酶与底物的有效接触。琚洋洋[31]报道的壳聚糖酶以30 mg·mL-1未降黏处理的壳聚糖为底物,58 U·g-1底物的加酶量在最适反应条件下反应3 h才能达到水解终点;朱玉霞等[32]报道了一种商品壳聚糖酶以30 mg·mL-1未降黏处理的壳聚糖为底物,10 U·g-1底物的加酶量在最适反应条件下反应6 h生成的还原糖量基本趋于平缓。重组酶BLCHIA对壳聚糖有较强水解能力,在最适反应条件下,以16.1 U·g-1底物加酶量与30 mg·mL-1未降黏处理的壳聚糖反应15 min,壳聚糖的黏度显著降低,同时生成多种聚合度的壳寡糖,在反应1 h生成的寡糖总量便基本达到平衡,在工业化大规模生产氨基寡糖中有明显优势。
上述结果表明重组几丁质酶对壳聚糖降解体现出内切活性,可得到多种聚合度的壳寡糖。不同聚合度的壳寡糖在生理功能和活性上体现出差别。随着聚合度的增大,壳二糖到壳五糖降低细胞内胆固醇和甘油三酯的作用逐渐减弱[31];壳寡糖的抗肿瘤活性与其分子量有关,与低分子量的壳寡糖相比,高分子量的壳寡糖对小鼠 (Mus musculus) S180细胞具有更高的抑制活性[33];因为羟基、氨基等活性基团的作用,壳寡糖具有很强的抗氧化活性,通过比较几种低分子量壳寡糖的抗氧化活性,发现壳二糖和壳三糖比氨基胍、维生素B和一种维生素E类似物有更强的羟自由基清除活性[34];此外,壳聚糖及其衍生物具有广谱抗菌活性,研究表明随分子量的升高,壳寡糖对金黄色葡萄球菌的抑制效果增强[35]。后期通过控制反应时间及优化加酶量有望获得主产物为特定聚合度的壳寡糖。
4 结论
本研究构建了枯草芽孢杆菌工程菌株,并实现了几丁质酶基因blchiA在枯草芽孢杆菌中的重组表达。该重组几丁质酶BLCHIA具有广泛的pH耐受性 (pH 3.0~9.0) 和较高的最适反应温度 (60 ℃),适用于工业应用。重组酶对壳聚糖和胶体几丁质的水解模式有明显区别,有望通过条件优化得到不同类型的氨基寡糖制品,对高效利用甲壳素类多糖具有较高的实际价值。
