脂肪酶Sv-lip5的异源表达及其在虾青素酯水解中的应用
2022-04-22高坤鹏余可欣孙建安毛相朝
闫 娇,高坤鹏,余可欣,孙建安,毛相朝,
1. 中国海洋大学 食品科学与工程学院,山东 青岛 266003
2. 青岛海洋科学与技术试点国家实验室海洋药物与生物制品功能实验室,山东 青岛 266237
虾青素是一种脂溶性酮式类胡萝卜素[1],其分子结构中含有11个共轭双键、2个β-紫罗兰酮环和羟基。虾青素因具有抗氧化[2-3]、抗炎[4-5]和免疫调节[6-7]等作用而受到广泛关注,它在保护人类和动物免受包括心血管疾病、糖尿病、癌症和一些免疫系统疾病方面具有巨大的应用潜力[8],已被广泛应用于食品、膳食补充剂、药品和化妆品等各个领域。
虾青素在自然界的主要存在形式是与不同种类脂肪酸结合的虾青素酯[9],红球藻 (Haematococcus)中虾青素组成约为70%的单酯形式、25%的双酯形式和5%的游离形式[10]。天然的虾青素酯存在成分复杂、功能差异大等问题[11],且大多数动物体内不能合成虾青素,只能从食物等其他途径获得[12]。此外,有研究表明游离形式虾青素的生物利用度更高、更容易被机体吸收利用[13],因此将虾青素酯水解制备游离虾青素,是提升虾青素产品品质和功能活性的一个重要研究方向。虾青素酯的水解反应一般通过强碱皂化或酶解的方式进行[14]。皂化法是水解虾青素酯的传统方法[15-16],过程中需要使用强碱溶液,反应条件剧烈,反应过程的废液会造成环境污染隐患,并且虾青素对热敏感,高温反应条件可能会导致虾青素降解,并容易产生虾红素等副产物[17-18]。酶解法具有反应条件温和、水解效率高、副产物少、产物生物安全性好等优势,是皂化法的理想替代方法[19]。孔凡华等[20]通过比较不同脱脂方法所测得的虾青素含量,总结出酶解法对虾青素的含量影响较小,先酶解再进行液相色谱分析可以准确定量样品中虾青素的含量。
脂肪酶 (EC 3.1.1.3) 是一种能够水解三酰基甘油酯的酶,也可催化酯化、酯交换等反应。关于使用脂肪酶水解虾青素酯已有相关研究。Zhao等[21]使用在毕赤酵母 (Pichia sp.)中表达的碱性脂肪酶用于水解虾青素酯,以吐温80作为乳化剂,在pH 7.0、温度 28 ℃、4.6 U·μg-1脂肪酶剂量和 0.1 mol·L-1磷酸钠缓冲液的条件下,7 h内可回收63.2%的游离虾青素。Gao等[22]在枯草芽孢杆菌(Bacillus subtilis)中表达了一种新型的链霉菌脂肪酶OUC-Sblip12用于水解虾青素酯,100 μg虾青素酯中虾青素得率为61.43 μg。现有研究表明利用脂类水解酶酶解制备虾青素的得率较高,但存在反应时间较长、菌株来源安全性较低的问题。因此,目前需要找到一种水解效率高、反应过程温和、反应副产物少、来源安全的酶,快速制备游离虾青素,为后续虾青素的综合利用提供参考。
本文从浅紫色链霉菌 (Streptomyces violascens)ATCC 27968中发掘Sv-lip5脂肪酶,并使用食品级表达系统枯草芽孢杆菌WB800对其进行克隆表达。探究了其酶学性质及其在虾青素酯水解中的应用,进一步丰富了虾青素酯水解酶库,实现了在短时间内大量制备游离虾青素,为提升虾青素的功能活性和生物利用度提供有益参考。
1 材料与方法
1.1 菌株与质粒
实验所用pP43NMK质粒及枯草芽孢杆菌WB800感受态细胞均为本实验室保藏;用于基因克隆的大肠杆菌 (Escherichia coli) TreliefTM5α购自北京天根生化科技。
1.2 主要材料与仪器
虾青素酯 (虾青素酯质量分数为10%) 购自云南爱尔发生物技术股份有限公司,纯度高于96%;虾青素购于上海阿拉丁生化科技股份有限公司;对硝基苯酚棕榈酸酯购自美国SIGMA公司;胶回收试剂盒购自美国OMEGA公司;质粒提取试剂盒购自北京天根生化科技有限公司;色谱级甲醇和甲基叔丁基醚用于液相检测;其余试剂如二氯甲烷、异丙醇等均为分析纯。
BCM-1000型生物净化工作台 (苏州净化公司);DYY-6C型核酸电泳仪 (北京市六一仪器厂);5804R高速冷冻离心机 (Eppendorf公司);Thermo Scientific Multiskan FC酶标仪 (Thermo Scientific公司);LC-20A高效液相色谱仪 (日本岛津公司)。
1.3 Sv-lip5的克隆表达及纯化
1.3.1 Sv-lip5序列分析
基于本实验室的浅紫色链霉菌 ATCC 27968的测序结果,找到具有脂肪酶活性的片段,对其进行克隆表达,将蛋白命名为Sv-lip5。根据已有的分析方法对脂肪酶DNA序列进行分类,使用Clustal W进行多序列比对,利用ESPript 3.0网站对序列的比对结果进行在线展示和输出,使用ExPaSy (https://web.expasy.org/protparam/) 计算理论分子量和等电点。
1.3.2 重组质粒的构建
根据脂肪酶基因序列及载体序列,使用Snap-Gene软件进行引物设计 (表1)。

表1 引物设计Table 1 Sequences of primers
以Sv-lip5片段为模板,利用表1设计的引物进行扩增,扩增完成后以无缝连接的形式构建重组质粒,测序正确后提取质粒pP43NMK-Sv-lip5,导入感受态细胞WB800中表达蛋白。
1.3.3 Sv-lip5的纯化
利用质粒上His-tag标签蛋白与镍柱结合的性质对Sv-lip5纯化,依次使用体质量分数为20%的乙醇、水冲洗柱子,后用6倍柱体积的Tris-HCl(0.1 mol·L-1) 缓冲液平衡镍柱,将冻干后复溶的酶液过膜后分批加入平衡后的镍柱中,确保酶与镍柱充分结合。使用不同浓度的咪唑Tris-HCl缓冲液洗脱,收集不同浓度的洗脱液,浓缩后通过SDSPAGE蛋白电泳验证纯化结果。
1.3.4 脂肪酶活性测定
使用对硝基苯酚棕榈酸酯进行酶活性测定。吸取甘氨酸氢氧化钠 (Gly-NaOH) 缓冲液 (0.1 mol·L-1,pH 9.0) 500 μL于 2 mL EP管中,加入 50 μL 酶液和20 μLpNPP底物 (0.02 mol·L-1),混合后于 40 ℃ 水浴锅中反应5 min,加入330 μL 1%的SDS缓冲液终止反应。取200 μL反应液于405 nm测定吸光度。
脂肪酶酶活性 (U) 单位的定义:在一定的反应条件下,每分钟水解底物释放1 μmol对硝基苯酚(p-nitrophenol,pNP) 所需的酶量定义为一个酶活单位,即1 U。
1.4 酶学性质分析方法
1.4.1 最适温度和温度稳定性测定
取等量酶液在不同温度 (25、30、35、40、45、50、55、60 ℃) 下水解对硝基苯酚棕榈酸酯,测定酶活性。将最适温度下的活性定义为100%,计算其他温度下的相对酶活。取等量酶液分别在不同温度 (35、40、45、50 ℃) 下孵育 42 h,在一定时间间隔取样,最适条件下测定酶活,同一温度下以0 h酶活定义为100%,分别计算不同温度下酶的活性。
1.4.2 最适 pH 和 pH 稳定性的测定
选取 100 mmol·L-1的 pH 4.0~6.0的柠檬酸-柠檬酸钠缓冲液、pH 6.0~8.0的磷酸盐缓冲液、pH 8.0~9.0的Tris-HCl缓冲液、pH 9.0~10.0的Gly-NaOH缓冲液作为酶反应的缓冲液进行反应,测定不同pH下的酶活性。将最适pH下的活性定义为100%,计算其他pH条件下的相对酶活。取等量酶液于上述缓冲液中孵育96 h,在不同时间间隔取样,在最适条件下测定酶活,同一pH下酶活最高的时间点的活性定义为100%,分别计算在不同pH缓冲液中脂肪酶的活性。
1.4.3 金属离子及表面活性剂对酶活性的影响
在酶液中分别加入钴离子 (Co2+)、钾离子(K+)、锌离子 (Zn2+)、镁离子 (Mg2+)、镍离子(Ni2+)、锰离子 (Mn2+)、钡离子 (Ba2+)、钠离子(Na+)、钙离子 (Ca2+)、铜离子 (Cu2+)、铁离子(Fe3+) 及化学试剂乙二胺四乙酸二钠 (Na2-EDTA),使其终浓度为1和10 mmol·L-1,将其置于37 ℃下保存1 h,进行酶活测定,探究金属离子及化学试剂对脂肪酶Sv-lip5的影响。在酶液中添加表面活性剂 (吐温60、吐温80、司盘20、司盘80、曲拉通X-100),探究表面活性剂对脂肪酶活性的影响。对照组中不添加金属离子或化学试剂,定义其活性为100%,反应体系和反应条件与实验组相同,分别计算添加金属离子及表面活性剂的实验组中脂肪酶活性。
1.5 Sv-lip5在虾青素酯水解中的应用
1.5.1 虾青素酯水解条件研究
利用Sv-lip5进行虾青素酯的水解,水解反应体系为2 mg的雨生红球藻 (Haematococcus pluvialis) 油,溶于500 μL的无水乙醇中,超声加速溶解。25 mL的棕色具塞三角瓶作为反应容器,加入500 μL的底物,5 mL的Gly-NaOH缓冲液,加入不同量的酶粉后,充入氮气后密封,将其置于40 ℃水浴摇床中进行反应。
实验设定pH为4.0~10.0,加酶量设置为80~900 mg,反应时间设置为0~25 h,分析不同pH、乙醇与缓冲液比例、加酶量和反应时间对水解率的影响。
1.5.2 虾青素萃取方法
反应结束后取500 μL反应液,使用体积比为1∶2的异丙醇和二氯甲烷进行萃取,离心去上清,收集有机相并氮吹至近干,后用1∶1的色谱纯甲醇和甲基叔丁基醚1 mL复溶,过0.22 μm有机滤膜收集样品至棕色液相上样瓶中,避光保存待测。通过高效液相色谱 (HPLC) 检测虾青素的生成量。
1.5.3 虾青素检测方法
HPLC检测所用色谱柱为YMC-Carotenoid-C30 (4.6 mm×250 mm, 5 μm),紫外检测波长为475 nm,流动相为甲基叔丁基醚 (A) 和甲醇 (B),采用线性梯度洗脱的方式[23-24],0~15 min,B为90%;15~25 min,B从90%降至40%;25~35 min,B由40%重新升至90%。流速设置为1 mL·min-1,柱温箱 35 ℃,进样量 20 μL。
1.6 实验数据处理与分析
采用Origin Pro软件进行数据统计和图片处理,数据均为3次平行。
2 结果与分析
2.1 Sv-lip5序列分析
在杆菌状链霉菌ATCC 27968[25]测序结果中找到脂肪酶Sv-lip5的基因序列,其序列长度为1 014 bp,该蛋白编码了338个氨基酸,预测分子量为34.8 kD、等电点为5.36,对其进行脂肪酶多序列比对 (图1),结果表明Sv-lip5属于脂肪酶第四家族,具有第四家族的特征。

图1 Sv-lip5进化树分析Fig. 1 Phylogenetic analysis of Sv-lip5
2.2 Sv-lip5的表达和纯化
阳性克隆验证结果见图2-a。验证正确后的菌株在LB培养基中发酵12 h后,收集发酵液进行离心,上清液即为粗酶液。使用镍柱对粗酶进行纯化,用不同浓度的咪唑Tris-HCl缓冲液 (pH 8.0)进行洗脱,收集各浓度洗脱液,浓缩后利用SDSPAGE蛋白电泳进行验证,验证结果见图2-b,在0.1 mol·L-1的咪唑浓度下洗脱出了目标蛋白条带,蛋白大小与预测分子量相近,表明蛋白成功纯化。
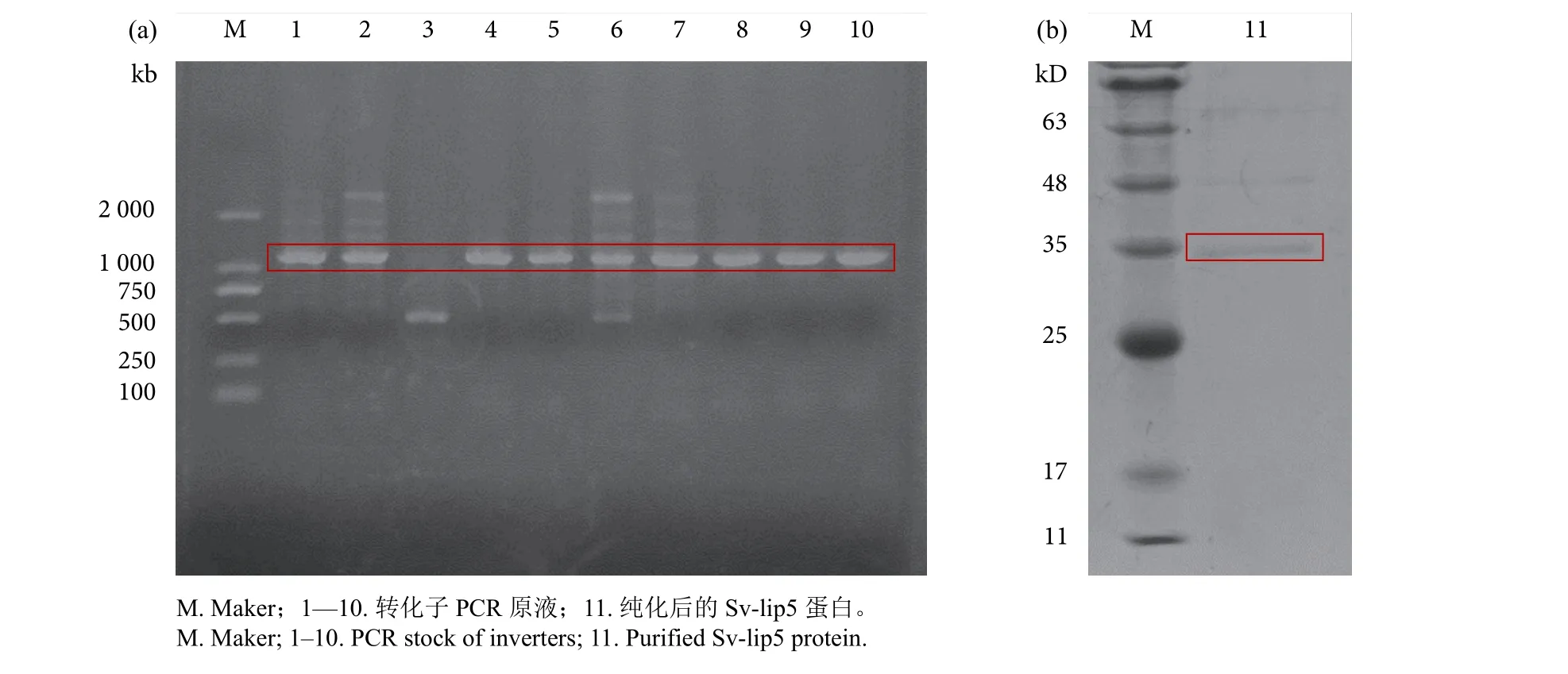
图2 Sv-lip5的核酸电泳结果 (a) 和SDS-PAGE蛋白纯化结果 (b)Fig. 2 Nucleic acid electrophoresis results (a) and SDS-PAGE protein purification results (b) of Sv-lip5
2.3 Sv-lip5酶学性质分析
在25~65 ℃测定了Sv-lip5的最适温度和温度稳定性 (图3-a),可以看出Sv-lip5的最适温度为45 ℃,EST4也显示出相同的最适温度,并且可在较宽的温度范围内高效使用,适用于较高温度下的生物技术应用[26]。在25~45 ℃内,酶活逐渐增强至最大值,相对酶活保持在80%以上,之后随着温度的升高酶活逐渐下降,在65 ℃时相对酶活呈现较低状态 (22.3%)。酶的温度稳定性见图3-b,在缓冲液中孵育9 h后,40 ℃时的酶活迅速下降。经孵育42 h后,所有实验组残余酶活均在36.8%以上。
本实验在pH 4.0~10.6内考察了Sv-lip5的最适pH及pH稳定性 (图3-c),表明Sv-lip5在pH为10.0的条件下表现出最佳活性,而在柠檬酸-柠檬酸钠缓冲液中活性普遍较低,最高活性仅23.7%,因此Sv-lip5对底物对硝基苯酚棕榈酸酯的水解活性表现出碱性偏好性。pH会影响酶活性中心基团的解离状态,当酶处于最适pH条件下,其活性基团处于适合与底物结合的解离状态;当其处于高于或低于最适pH的环境时,其活性基团解离状态改变,酶活性相应降低。pH也会影响酶的稳定性,过高或过低的pH会改变酶活性中心的构象,使酶活性降低。Sv-lip5在pH 9.0~10.0内均有较高的酶活,体现出碱性偏好性;但在pH稳定性的测定中,长时间处于pH 10.0的强碱环境中,酶活性有较明显下降,可能pH 10.0的环境对酶活性中心的构象有一定改变 (图3-c、3-d)。Est16也被发现是碱性酯酶,其最适pH为8.0~9.0,可在7.0~11.0的宽pH范围内保持活性稳定[27]。当pH高于10.0时,Sv-lip5的相对酶活急速下降,当pH为10.6时残余酶活为50.4%。同时,在pH同为8.0的不同缓冲液条件下,Sv-lip5的酶活也表现出差异性,这种差异性是酶活性测定中的普遍现象[28]。叶凤凌等[29]阐述了pH环境对于植物多酚抑制氧合酶的影响,其中相同pH条件下的硼酸盐缓冲液、磷酸盐缓冲液以及Tris-HCl缓冲液中酶活性存在较大差别,可能是因为各缓冲液中不同的阴离子种类对酶活性的影响程度不同。
图3-e的金属离子实验表明,1 mmol·L-1的Ca2+和 10 mmol·L-1的 Co2+和 Ba2+增强了酶活性,在解脂耶氏酵母 (Yarrowia lipolytica) 中克隆表达的脂肪酶YLIP15也表明Ca2+具有增强酶活性的作用,而Mg2+则对YLIP4、YLIP5、YLIP7脂肪酶活性表现出抑制作用[30],与本实验结果一致。10 mmol·L-1浓度下除K+和Ni2+显著降低了酶活性外,其余金属离子都显示出轻微抑制。添加表面活性剂会显著影响Sv-lip5的活性,司盘20、司盘80、吐温60、吐温 80以及曲拉通X-100均对其活性有一定程度的抑制作用 (图3-f),司盘20和吐温60使其活性分别降低了25.7%和55.3%,可能是因为表面活性剂抑制了分子间和分子内的蛋白质相互作用[31]。

图3 Sv-lip5的酶学性质分析Fig. 3 Analysis of enzymatic properties of Sv-lip5
2.4 Sv-lip5水解虾青素酯
本实验结果表明Sv-lip5对虾青素酯具有显著的水解作用,反应前后物质对比见图4-a。反应前22.5~30 min内全部为虾青素酯,经过Sv-lip5作用后,可将其大部分转化为第5.5分钟出峰的游离虾青素。虾青素酯水解反应pH优化反应结果见图4-b。由于Sv-lip5是碱性脂肪酶,在碱性条件下显示出最佳活性且稳定性较好。在pH为9.0的缓冲液中水解反应效果最佳,反应12 h后可产生17.18 μg虾青素,但在其最适pH 10.0的条件下该酶的水解效果反而显著降低,仅产生5.03 μg虾青素,可能是由于该酶在pH 10.0下的稳定性较差,12 h的反应时间导致酶活性降低,虾青素产量也随之减少。碱性脂肪酶Lipase-YH也存在相同现象,其在pH 6.0~7.0内虾青素产量逐渐增加,但在偏碱性 (pH 8.0~9.0) 条件下却逐渐减少[32],可能是碱性环境下虾青素存在一定程度的降解。
乙醇和缓冲液比例对于虾青素酯水解具有一定的影响 (图4-c),当乙醇和缓冲液比为1∶12时,水解效果最佳,可产生27.63 μg虾青素,其余比例下的水解效果均比较微弱,虾青素产量均小于10.98 μg。
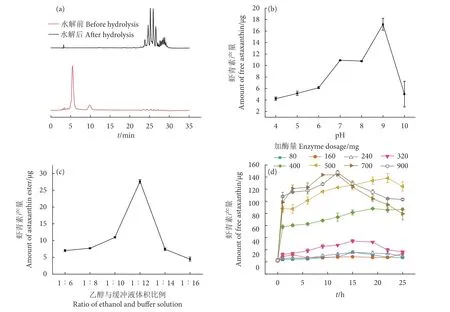
图4 Sv-lip5在虾青素酯水解反应中的条件优化Fig. 4 Optimization of reaction conditions of hydrolysis of astaxanthin ester by Sv-lip5
通过调整酶量进行虾青素酯的水解研究 (图4-d),当添加80、160、240 mg脂肪酶时,虾青素的含量波动较小,水解效率较差,最高虾青素产量仅15.68 μg。当加酶量为320 mg时,虾青素产量有微弱的提升,第12小时水解率最高,可获得34.31 μg虾青素。在反应体系中添加400和500 mg酶粉时,水解效果有明显的转变。向反应体系中添加500 mg酶粉,第1小时的虾青素产量就可达87.95 μg,水解前后对比结果 (图4-a) 显示,反应完全时可以得到138.27 μg的虾青素,水解率为95.13%。Gao等[22]克隆表达的OUC-Sb-lip12也可用于虾青素酯的水解,在第12小时水解率达96.29%,通过优化时间与加酶量,本研究中Sv-lip5在12 h内水解率可达98.27%,200 μg虾青素酯中游离虾青素产量为147.48 μg,高于 Gao等[22]报道的 OUC-Sblip12水解游离虾青素产量,可能是由于反应过程中虾红素等副产物产生较少。经测定,Sv-lip5的比酶活为12.46 U·g-1,当酶添加量增加至一定程度后,其可高效水解虾青素酯。后续可以通过优化培养基成分与酶表达体系效率,进一步降低酶制备成本,保障虾青素酯的低成本高效水解;同时,可通过固定化[33-34]等方式提高Sv-lip5的回收利用率,进一步降低游离虾青素的制备成本。此外,Huang等[32]通过优化发酵pH、培养基配方以及甲醇浓度提高酶活性,使其适合大规模生产虾青素,旨在开发新型高效的酶工艺以减少成本消耗。本实验也可通过进一步水解体系优化等手段逐步完善虾青素酯水解反应,弥补光、热以及氮气充入不均一性对虾青素的部分降解。
当酶量添加量较多时,酶粉与底物充分接触,1 h内就可达到较高的水解率,随着时间的延长,虾青素酯仍可继续降解,但后续降解速率逐渐变缓。当酶量添加较少时,虾青素的水解受到极大限制,在第12或第15小时可达到最大水解率,随着时间的延长,生成的虾青素也会受到环境因素的影响部分分解,19 h后部分曲线有下降趋势 (图4-d)。因此加酶量和时间对虾青素酯的水解相互影响。只有当加酶量到达一定限度时,水解反应才能以较高速率进行,且加酶量的增长可加速水解进程。
3 结论
本研究克隆表达了来自浅紫色链霉菌的脂肪酶Sv-lip5,该酶的蛋白分子量约34.8 kD,比活力为12.46 U·g-1,在45 ℃、pH为10.0的条件下显示出最佳酶活力,可用于虾青素酯的水解,水解产物为游离虾青素。该酶可耐碱性环境,从而避免了反应过程中杂菌的生长,通过优化反应条件得出,当乙醇与缓冲液体积比为1∶12、反应pH为9.0、加酶量为900 mg、在40 ℃下反应12 h,200 μg虾青素酯最终可收获147.48 μg游离虾青素。
