腺嘌呤诱导慢性肾病大鼠模型中HIF-1α、RhoA、SOX9 的表达及意义
2022-04-19毛海霞康婷吴蔚桦朱婷婷张丽玲欧三桃
毛海霞康 婷吴蔚桦朱婷婷张丽玲欧三桃*
(1.西南医科大学附属医院肾病内科,四川 泸州 646000;2.四川省肾脏疾病临床医学研究中心,四川 泸州 646000)
慢性肾病(chronic kidney disease,CKD)是一种以肾功能丢失逐渐加重为特征的进展性疾病[1],已成为全球的重大公共健康问题,是导致世界人口死亡的主要疾病[2]。 CKD 发病机制复杂多样,其中肾小管间质纤维化(tubulointerstitial fibrosis,TIF)是其最常见的病理特征和CKD 进展的共同途径[3]。 影响肾间质纤维化的因素众多,涉及多种信号因子和信号通路调控系统。 上皮间充质转化(epithelialmesenchymal transition,EMT)可通过改变分泌的细胞外基质促进TIF 的发展,其中,缺氧参与并促进了该 过 程 的 发 生、 发 展[4-5]。 缺 氧 诱 导 因 子-1α(hypoxia-inducible factor-1α,HIF-1α)作为缺氧敏感的关键转录因子,被证实与肾纤维化有关[6-7]。 近年来,RhoA/ROCK 信号通路被证实在促进肾纤维化方面起到积极作用[8],而SOX9 作为下游因子发挥作用,HIF-1α 同时也是RhoA 转录的重要调节因子[9]。 缺氧可通过HIF-1α 激活RhoA/ROCK 信号通路来诱导细胞骨架损伤和重塑,KEGG 信号通路显示SOX9 参与HIF-1α 信号通路[10],但HIF-1α 是否可通过RhoA、SOX9 发挥促进肾间质纤维化的作用,目前尚无相关报道。 因此,本研究主要观察HIF-1α、RhoA 和SOX9 在腺嘌呤诱发大鼠CKD 模型中的表达以及与CKD 肾间质纤维化的关系,以进一步探讨CKD 肾间质纤维化的发病机制。
1 材料和方法
1.1 实验动物
SPF 级5~6 周龄雄性SD 大鼠20 只,体重180~240 g,购自西南医科大学实验动物中心[SCXK(川)2018-0017]。 饲养于西南医科大学动物研究中心[SYXK(川)2018-0065]。 该实验经西南医科大学实验动物伦理委员会审批( IACUCSWMU20210350),并遵循实验动物的3R 原则。
1.2 主要试剂与仪器
腺嘌呤(V900471-100G,Sigma 公司,美国);HIF-1α 抗 体、 SOX9 抗 体( ab8366, ab185230,Abcam,英国);RhoA 抗体(10749-1-AP,武汉三鹰公司);Col-I 抗体(BS1530,bioworld 公司,美国);α-SMA 抗体(19245S,CST 公司,美国);SABC 试剂盒(bioworld 公司,美国);RNA 提取试剂盒、RNA 逆转录试剂盒、荧光定量PCR 试剂盒(R701、R323-01、Q711-02/03,南京维诺赞公司);HIF-1α、RhoA、SOX9、Col-I、α-SMA 和GAPDH 上下游引物(上海生工生物工程有限公司); SOX9 ELISA 试剂盒(30899,泉州睿信生物科技有限公司)。 全自动生化分析仪(西门子,德国);光学显微镜(Nikon 公司,日本);RNA 逆转录仪(Eppendorf 公司,德国);RTPCR 仪(Eppendorf 公 司, 德 国); 自 动 酶 标 仪(BioTek 公司,美国)。
1.3 实验方法
将20 只大鼠随机分为对照组(n=10)和CKD组(n=10)。 所有大鼠自由进食普通饲料、饮水,昼夜节律光照,室温喂养,适应性喂养1 周后,开始实验。 CKD 组给予250 mg/(kg·d)的2.5%腺嘌呤混悬液每天灌胃,1~3 周每天灌胃1 次,4~6 周每天减半灌胃1 次;对照组给予等量生理盐水灌胃。
1.3.2 留取血、尿、肾组织标本
造模后第3、6 周时,分别处死两组大鼠各5 只;处死前24 h 将大鼠置于清洁的代谢笼中,收集24 h尿液测定24 h 尿蛋白,行10%戊巴比妥麻醉后经腹主动脉采血,离心后取血清分装并保存于-80℃冰箱待用,部分血清用于行肾功能检测,部分用于ELISA 检测;处死后取右肾称重及行剖面观察,左肾部分肾组织于10%中性福尔马林中浸泡固定,制作石蜡切片(4 μm),用作形态学观察,部分肾组织冻存于-80℃冰箱中备用。
1.3.3 肾组织形态学观察
HE 染色:取大鼠肾组织石蜡切片,二甲苯脱蜡至水后行苏木素液、伊红复染,透明,中性树胶封片。 于光镜下观察肾组织病理改变。
天狼星红染色:切片脱蜡至水,苏木素液染3~5 min,水洗后天狼星红染液染15 ~30 min,无水乙醇直接分色与脱水,二甲苯透明,风干后中性树胶封片,镜检。
1.3.4 免疫组化染色检测肾组织中HIF-1α、RhoA、SOX9、Col-I 和α-SMA 蛋白的表达
肾组织切片60℃脱蜡水化,热抗原修复,免疫组化笔画圈围住组织,灭活内源酶活性,封闭非特性位点,依次添加一抗、二抗、ABC 复合物、DAB 显色液,苏木素复染,脱水晾干后中性树胶封片,显微镜下观察。
③实现智慧交通系统公共数据的共享服务,为政务内网、政务外网以及互联网上的各类交通类相关的智慧应用提供基于城市智慧交通公共数据库的交通数据服务、时空信息承载服务、基于数据挖掘的决策知识服务等。
1.3.5 RT-PCR 检测大鼠肾HIF-1α、RhoA 和SOX9和Col-I、α-SMA mRNA
取冻存肾组织,按说明书提取总RNA,再将RNA 逆转录为cDNA。 设计HIF-1α、RhoA、SOX9、Col-I 和α-SMA 引物序列,见表1 参照试剂盒行体外PCR 扩增,记录PCR 反应的循环阈值(CT 值),以2-△△CT表示目的基因的相对表达量。

表1 荧光定量PCR 引物序列表Table 1 Sequence table of primers for RT-PCR
1.3.6 ELISA 检测血清SOX9 水平
取大鼠血清,按照ELISA 试剂盒操作步骤,并用酶标仪在450 nm 波长下测定吸光度(OD 值),通过标准曲线计算样品中SOX9 含量。
1.4 统计学方法
采用SPSS 20.0 软件进行统计学分析,计量资料采用平均数±标准差(¯x±s)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,两变量间的相关性分析用Pearson检验,以P<0.05为有差异,具有统计学意义。
2 结果
2.1 肾整体和切面大体病理改变及肾重、肾重/体重比较
对照组大鼠肾大小形态正常,呈暗红色,触之有弹性,切面皮髓质界限分明;CKD 组大鼠肾呈“大白肾”,体积变大,色灰白,质韧,触之有颗粒感,且切面皮髓质稍模糊。 CKD 组肾重、肾重/体重均比对照组增加,且差异具有统计学意义(P<0.05)。 见表2、图1。
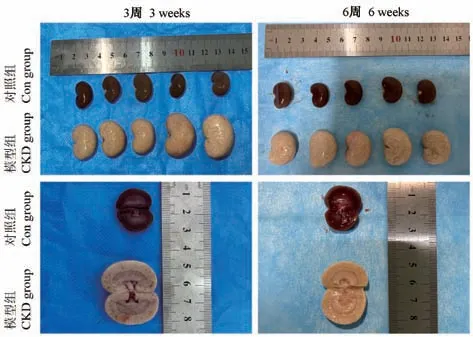
图1 两组大鼠肾大体病理改变Figure 1 Pathologic change between two groups of rats

表2 两组大鼠肾重、肾重/体重比较(n=5)Table 2 Comparison of kidney weight and kidney weight/body weight between two groups of rats
2.2 两组大鼠肾功能及24 h 尿蛋白定量比较
CKD 组大鼠肾功能指标(BUN、Scr)和24 h 尿蛋白定量在3、6 周较对照组均明显升高,且差异具有统计学意义(P<0.05)。 见表3。

表3 两组大鼠肾功及24 h 尿蛋白定量比较(n=5)Table 3 Comparison of renal function and 24 h urinary protein quantity between two groups of rats
2.3 肾组织病理改变
HE 染色可见对照组第3、6 周大鼠肾组织结构清晰,无明显异常。 CKD 组大鼠肾组织随时间进展结构变得紊乱,肾小球数量逐渐减少,囊腔扩张明显,肾小管扩张伴棕黄色颗粒沉积。 天狼星红染色见对照组大鼠肾间质无明显胶原沉积,而CKD 组大鼠肾间质明显红染,胶原纤维较为丰富,且随时间进展其程度加重。 见图2。

注:A:HE 染色结果,B:天狼星红染色结果。
2.4 肾组织HIF-1α、RhoA、SOX9、Col-I 和α-SMA 免疫组化
免疫组化结合Image Pro Plus 分析结果显示,对照组大鼠可见肾小管HIF-1α、RhoA、SOX9 表达较少,且主要集中在靠近肾小球的周围。 CKD 组大鼠肾小管及间质可见较多棕黄色颗粒沉积,提示HIF-1α、RhoA、SOX9 的表达较多,且随时间进展其表达逐渐增强,肾小球上也有不均匀表达。 Col-I 和α-SMA 蛋白在对照组肾间质表达较少,而在CKD组肾间质显著表达,且随时间进展其表达程度加重。 见图3。

注:与同期对照组相比,*P<0.05,**P<0.01;与前一时间CKD 组相比,##P<0.01。
2.5 肾组织HIF-1α、RhoA 和SOX9 和Col-I、α-SMA mRNA 表达情况
与对照组相比,CKD 组大鼠肾HIF-1α、和SOX9 mRNA 水平随时间进展均明显增加,且HIF-1α 和SOX9 mRNA 在各时间点的差异均具有统计学意义,RhoA 在第6 周时差异具有统计学意义;CKD 组大鼠各时间点肾Col-I、α-SMA mRNA 均较对照组升高,且差异具有统计学意义。 见图4。

注:与同期对照组相比,*P<0.05,**P<0.01;与前一时间CKD 组相比,##P<0.01。
2.6 相关性分析
采用Pearson对各指标进行相关性分析,结果提示HIF-1α、RhoA 和SOX9 mRNA 表达与Col-I mRNA表达呈显著正相关(r=0.993,P<0.000;r=0.864,P<0.000;r=0.957,P<0.000);HIF-1α、RhoA 和SOX9 mRNA 表达与α-SMA mRNA 也呈明显正相关(r=0.820,P=0.001;r=0.758,P=0.004;r=0.779,P=0.003)。 随后,进一步分析HIF-1α、RhoA 和SOX9 之间的相关性,发现其两两间均存在显著正相关(HIF-1α 与RhoA mRNAr= 0.871,P<0.000;HIF-1α 与SOX9 mRNAr= 0.944,P<0.000;RhoA 和SOX9 mRNAr=0.715,P=0.009)。 见图5。

图5 mRNA 相关性分析Figure 5 Correlation analysis of the mRNA
2.7 大鼠血清SOX9 的水平
3 周大鼠对照组血清中SOX9 水平为(13.63±1.595) ng/mL,CKD 组为(16.16±1.390) ng/mL;6 周大鼠对照组血清中SOX9 水平为(12.63±1.540) ng/mL,CKD 组为(18.27±1.334) ng/mL。 CKD 组大鼠血清中SOX9 水平较同期对照组均升高,且差异均具有统计学意义(P<0.01);血清SOX9 水平随造模时间延长而增加,差异具有统计学意义(P<0.05)。
2.8 血清SOX9 水平与肾功能、24 h 尿蛋白的相关性分析
用Pearson检验得出:血清中SOX9 水平与尿素氮、肌酐、24 h 尿蛋白定量均存在正相关关系(r1=0.759,P=0.000;r2=0.757,P=0.000;r3=0.822,P=0.000)。 见图6。
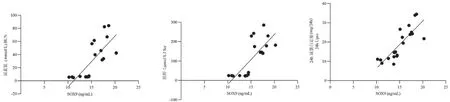
图6 血清SOX9 水平与肾功、24 h 尿蛋白定量的相关性分析Figure 6 Correlation analysis of SOX9 with renal function and 24 h urinary protein quantity
3 讨论
CKD 最常见的病理表现是肾纤维化,主要包括肾小球硬化、肾小管萎缩和肾间质纤维化。 而肾间质纤维化作为发展为终末期肾病的主要病变之一,涉及信号通路繁多,目前研究较多的有TGF-β/Smad3、JAK/STAT 和PI-3K 通路等[11],但并不能完全解释其进展过程。 近年来研究发现,在慢性肾病组织中普遍存在缺氧状态,而缺氧主要可通过缺氧诱导因子(HIF-1)途径来促进肾间质纤维化从而参与慢性肾病的进展。 既往研究表明RhoA 和SOX9均与HIF-1 相关,且都不同程度参与肾间质纤维化过程,因此本研究通过检测HIF-1、RhoA 和SOX9 表达及相关肾纤维化指标,探讨HIF-1、RhoA 和SOX9是否参与了CKD 的肾间质纤维化过程。
腺嘌呤灌胃诱导CKD 主要是通过促进肾小管间质纤维化、肾小管萎缩和晶体形成,能较好的模拟人类的正常CKD 的发展,故成为广泛采用的诱导CKD 的造模方式[12-13]。 本实验采用腺嘌呤灌胃,可见模型组大鼠肾呈“大白肾”改变,肾功能下降且24 h 尿蛋白定量升高,且HE 染色发现肾结构紊乱伴肾小管明显扩张,天狼星红染色发现CKD 组胶原纤维沉积且其纤维化程度随时间进展加重,证实腺嘌呤诱导CKD 大鼠模型成功。
HIF-1α 是缺氧诱导因子家族中的一员,普遍存在于人和哺乳动物的细胞内,可以激活下游100 多种与缺氧相关的因子转录表达,主要通过调控细胞增殖、自噬,炎症,氧化应激等介导细胞产生缺氧应答,近年来发现其与慢性病的发生发展密切相关[14]。 CKD 时,HIF-1α 可通过激活NF-β、EPO、GLUT-1、IGF-1 和INOS 发生等促进肾间质成纤维细胞向肌成纤维细胞转化,进而促进肾间质纤维化,同时还可促进血管生成[15]。 本研究发现在腺嘌呤诱发的CKD 大鼠肾小管上皮细胞胞核中存在HIF-1α 的高表达,其mRNA 水平同等高表达,且其表达与肾纤维化因子Col-I、α-SMA mRNA 呈显著正相关,提示HIF-1α 可能参与并促进了CKD 的肾间质纤维化过程,与既往类似研究结果一致。 其次,HIF-1α 与RhoA 和SOX9 mRNA 的表达也高度相关,且RhoA 和SOX9 在肾小管上皮细胞核中均明显高表达。 既往研究发现在乳腺癌中HIF-1α 可激活RhoA/RhoA 轴,导致细胞和基质收缩[16]。 在肿瘤、肺动脉高压等多种疾病中都证实了HIF-1α/RhoA轴的存在,但与CKD 的相关研究较少,本研究发现在CKD 间质纤维化中,HIF-1α 与RhoA 存在相关关系,但还需进一步研究证实。
RhoA 作为研究最透彻的RhoA-GTP 酶的家族成员,在调节细胞骨架蛋白,细胞形态和迁移、调控细胞增殖和转录等方面发挥了巨大的作用,因此,是目前研究的热点之一。 晚近发现其转录主要受c-Myc、HIF-1α/2α、Stat 6 和NF-κB 等调控,下游可激活MAL、AP-1、NF-κB、YAP/TAZ、β-catenin 和SOX9 等发挥生物活性作用[9]。 多项研究也表明,RhoA 通过不同通路参与并促进了肾间质纤维化的进程[8,17-18]。 本研究也发现RhoA 在CKD 组大鼠肾小管上皮细胞核中高表达,且其mRNA 水平与Col-I和α-SMA mRNA 表达呈正相关,进一步证明了RhoA 可能促进肾间质纤维化从而参与CKD 的进展。 RhoA 与SOX9 mRNA 表达呈明显正相关关系,表明RhoA 可能通过激活SOX9 在肾间质纤维化的进程中发挥作用。
SOX9(sex-determining region Y box9)参与早期胚胎的多种器官的发育成熟,也与肿瘤的发生有关。 近年来发现其可介导上皮细胞间质转分化和通过促进细胞外基质的产生参与器官纤维化。 然而,SOX9 在肾间质纤维化中的研究相对较少,目前有研究表明SOX9 可通过PI3K-AKT 途径促进肾小管间质转分化和细胞外基质沉积[19]。 同时,大量研究表明在急性肾损伤后SOX9 表达增强,可促进肾内源性的修复,从而延缓肾间质纤维化的发生[20-21]。 因此SOX9 可能在早期肾损伤中起保护作用,在晚期肾损伤中起促进作用,但在肾间质纤维化中的具体作用还需要更深入的研究来证明。本研究发现随CKD 进展,SOX9 在肾小管上皮细胞中高表达,在6 周达高峰,且其mRNA 水平与Col-I、α-SMA mRNA 呈显著正相关,表明在CKD 模型中存在SOX9 的表达增强,且其表达可能参与并促进了肾间质纤维化过程,进一步证实了关于SOX9 在肾间质纤维化的作用[22]。 此外,本研究同时还发现血清SOX9 水平在CKD 大鼠中明显升高,与对照组相比差异具有统计学意义,且CKD 组6 周较3 周表达进一步升高,表明其血清水平随CKD 进展而上升。Nakagawa 等[23]提出SOX9 可作为提示肾小管损伤和间质纤维化的新型标志物,但目前尚无在血清学方面的报道,而本研究结果提示血清SOX9 水平可能在一定程度上诊断CKD 以及提示CKD 病程的进展。
综上,本研究发现在腺嘌呤诱导的CKD 大鼠模型中,存在HIF-1α、RhoA 和SOX9 的激活,且其表达增加可能与肾间质纤维化有关,今后还应进一步研究验证该通路并证明抑制其激活有助于抑制肾间质纤维化的发展,进而减缓CKD 进程。 此外血清SOX9 水平有望成为早期诊断CKD 以及提示其病情进展的新型标志物。
