YAP 在特发性膜性肾病中的表达及其对C5b-9 诱导足细胞损伤的作用
2022-04-19史添立罗
史添立罗 贞*焦 石
(1.海口市人民医院肾内科,海口 570208; 2.中山市博爱医院肾病风湿科,广东 中山 510603)
膜性肾病(membranous nephropathy,MN)是导致原发性肾病综合征的重要病因,严重威胁患者的生命健康[1]。 其中约25%~30%的MN 患者与潜在的疾病相关,如系统性红斑狼疮、恶性肿瘤及各种病毒或细菌引起的感染性疾病等,而当继发性原因不明显时则归为特发性膜性肾病(idiopathic membranous nephropathy,IMN),后者约占70%[2-3]。尽管近年来针对IMN 的特异性分子标记物的研究取得了一定的进展,但其具体病因及发病机制仍未阐明,极大影响了IMN 的治疗及预后。
既往研究证实IMN 是一种原位免疫复合物或循环免疫复合物沉积于肾小球上皮细胞下,并引起补体的异常激活,形成补体膜攻击复合物C5b-9,进而损伤足细胞的正常结构及功能的相关疾病[4-5]。其中亚溶解剂量的C5b-9 介导的足细胞损伤在IMN中得到广泛认可,该假说认为亚溶解剂量的C5b-9对足细胞所产生的损伤并非完全溶解效应,但能够激活足细胞中多种信号通路,进而产生大量炎症因子、活性氧(reactive oxygen species,ROS)及蛋白分子,导致细胞发生间质细胞转变(即表型转化),细胞骨架紊乱乃至凋亡等,最终损伤肾小球的滤过屏障,产生大量蛋白尿等肾损伤现象[6]。 转录共激活因子Yes 相关蛋白(yes-associated protein,YAP)是经典的Hippo 信号通路的重要效应因子之一,其在调控细胞增殖、生长、分化和死亡等多个环节均具有重要地位[7-8]。 近年来,随着对YAP/Hippo 通路在肾发育过程中作用的认识,人们发现YAP 信号的异常表达也参与调控了多种肾疾病的发生进展[8]。然而在IMN 中,YAP 在肾组织中的表达及相关作用尚鲜有报道。 本研究欲通过探究YAP 的IMN 患者中的表达,并建立C5b-9 损伤肾小球足细胞的体外模型,进而阐明其相关作用,以期进一步揭示IMN的发病机制。
1 材料和方法
1.1 实验材料
1.1.1 细胞
人肾小球足细胞MPC5 细胞系购自中国科学院上海细胞库。
1.1.2 临床标本来源
选取2018 年2 月至2020 年2 月于海口市人民医院肾内科确诊的IMN 患者121 例(IMN 组),所有患者肾活检均证实为IMN,其中男性62 例,女性59例,平均年龄(47.1±3.9)岁。 另取年龄、性别相匹配的同时期于我院泌尿科行肾肿瘤切除术的癌旁正常对照肾组织91 例(Normal 组)。 纳入标准:(1)所有受试者年龄≥18 岁;(2)IMN 符合Ehrenreich-Churg 诊断标准[9],且排除经临床资料核查及实验室检查发现的继发性IMN 患者;(3)受试者入院前3 个月未使用任何免疫抑制剂、细胞毒性药物或糖皮质激素等;(4)临床资料完整,且患者或家属签署知情同意书。 本研究符合伦理学相关要求,且经海口市人民医院伦理委员会批准(2018AKB206-01)。
1.2 主要试剂与仪器
DMEM/HG 培养基,0.25%胰酶(美国Hyclone公司,批号:AD13203319、AD15802247);胎牛血清(美国Gibco 公司,批号:11416-791);TRIzol、反转录试剂盒、 转染试剂Lipofectamine 2000 (美国Invitrogen 公司,批号:4339218、426019、711035);SYBR Premix Ex Taq(日本TaKaRa 公司,批号:T108241R73661);CCK-8 试剂盒,Annexin V-FITC细胞凋亡试剂盒、BCA 蛋白定量试剂盒、RIPA 蛋白裂解液、蛋白酶抑制剂(江苏碧云天生物科技公司,批 号: C191029、 C200914、 C190518、 ST170514、ST190211);DCFH-DA 试剂盒(美国Sigma 公司,批号:EZ1911D0032);沉默YAP 的siRNA(si-YAP)及阴性对照序列si-NC(广州锐博生物技术有限公司,批号:201029BZ);补体来自8 名健康体检者新鲜血清(normal human serum,NHS);人补体C5b-6 复合物(美国Merck 公司,批号:M1129);大鼠抗YAP、p-YAP、β-actin 抗体(美国Cell Signaling 公司,批号:191128、200711、20120706);大鼠抗Nephrin、WT1、ZO-1 ( 美 国 Cayman 公 司, 批 号: C1908A04、C2004A16、C1811A26);兔抗Snail、Fibronectin(美国Abcam 公司,批号:ab924417、ab101732);兔抗大鼠或山羊抗兔二抗(上海爱必信生物科技有限公司,批号:A190211、A191122);qRT-PCR 引物由上海生工合成。 凝胶成像系统,凝胶电泳仪,PCR 及qRTPCR 仪(美国Bio-Rad 公司,型号:005、X10-7、T10-9、IQ5);流式细胞仪FACS-Calibur(美国BD 公司,型号:FACSC-Ⅱ);倒置荧光显微镜(日本Olympic公司,型号:荧光CKX-19)。
1.3 实验方法
1.3.1 免疫组织化学染色(immunohistochemeistry,IHC)
将固定于4%甲醛溶液的肾组织样本进行常规石蜡包埋,切片机进行连续切片后,二甲苯脱蜡,梯度乙醇脱水,3%的过氧化氢消除内源性过氧化物酶,高压柠檬酸钠进行抗原恢复,5%的牛血清白蛋白封闭抗体后,加入稀释后的YAP 抗体(1 ∶800),4℃孵育过夜,加入二抗(1 ∶1000)室温孵育1 h,DAB 显色,苏木素复染,中性树脂封片后,显微镜下观察拍照。
1.3.2 细胞的培养,转染和分组处理
MPC5 在含10%胎牛血清和1%青链霉素混合液的DMEM/HG 培养基中,并置于37℃,5% CO2的培养箱中进行培养。 取处于对数生长期的足细胞,0.25%的胰酶常规消化后,按5×104个/孔接种于6 孔板中,当细胞生长融合至70%时,参考Lipofectamin 2000 转染试剂说明书方法将Opti-MEN 稀释后的转染试剂及si-YAP 或si-NC 按1 ∶1 比例加入足细胞中进行转染,6 h 后更换为新鲜培养,继续培养48 h 后应用qRT-PCR 及Western blot 实验检测转染效率验。参考文献[10]方法,使用亚溶解剂量的C5b-9 与NHS进行处理MPC5 细胞,并将细胞分为4 组,正常培养的MPC5 细胞(control 组),0.4 μg/mL 的C5b-9 与NHS 处理的MPC5 细胞(C5b-9 组)和0.4 μg/mL 的C5b-9 与NHS 处理的si-NC 细胞(C5b-9+si-NC 组)和0.4 μg/mL 的C5b-9 与NHS 处理的si-YAP 细胞(C5b-9+si-YAP 组)。 各组细胞均置于上述条件的培养箱中培养48 h 后进行后续相关实验。
1.3.3 实时荧光定量PCR(qRT-PCR)
取各组待测足细胞,TRIzol 法提取细胞中总RNA,应用反转录试剂盒反转录为cDNA。 参考SYBR Premix Ex Taq 试剂盒说明书确定qRT-PCR反应体系及条件,qRT-PCR 的引物序列为:YAP-F:5’-CAAGCTGGCTAGCGTTTAAACGG-3’, YAP-R:5’-GTAGTCGGATCCTAACCACGTGAGAAAG-3’;βactin-F:5’-CCTGGCACCCAGCACAAAT-3’,β-actin-R:5’-GGGCCGGACTCGTCATAC-3’。 以β-actin 作为内参,按照2-ΔΔCt方法计算待测细胞中目的基因的表达。
1.3.4 CCK-8 检测足细胞增殖活力
取对数生长期各组细胞,按1×104个/孔接种至96 孔板中,于培养箱中培养0、12、24、48 h 后加入10 μL CCK-8 试剂,继续孵育1 h 后,在酶标仪450 nm 波长处检测各孔光密度值。 每组每个时间点设置3 个复孔。 统计软件计算并分析各组细胞的增殖活力。
1.3.5 Annexin V-FITC 双染法联合流式细胞术检测足细胞凋亡
取培养48 h 后上述各组细胞,常规消化细胞后,2000 r/min 离心细胞5 min 后,取细胞沉淀加入195 μL 的Annexin V-FITC 结合液进行重悬细胞,随后再依次加入5 μL 与10 μL 的V-FITC 与PI 染液,充分混匀后37℃避光孵育15 min,过滤细胞团块后,上机进行分析。
1.3.6 细胞内活性氧(ROS)检测
取对数生长期各组细胞,按5×104个/孔接种至6 孔板中,待细胞生长融合至80%时,弃去原培养液,每孔加入1 mL 终浓度为5 μmol/L 的DCFHDA,37℃下孵育30 min 后,PBS 洗涤细胞后,收集细胞,应用流式细胞仪进行检测。 实验单独重复3 次。
1.3.7 Western blot 实验
取各组待测细胞,将RIPA 细胞裂解液及蛋白酶抑制剂按100 ∶1 的比例进行混合后,提取细胞中总蛋白,4℃下24000 r/min 离心15 min,收集上清液,BCA 法进行蛋白定量,加入蛋白上样缓冲液后将蛋白样品经沸水中加热变性5 min。 10%SDSPAGE 电泳,转膜,5%脱脂奶粉室温下进行抗体封闭2 h 后,加入YAP(1 ∶500)、Nephrin(1 ∶1000)、WT1(1 ∶1000)、ZO-1(1 ∶1000)和Snail(1 ∶800)、Fibronectin(1 ∶800)及β-actin(1 ∶2000),4℃摇床孵育过夜,随后加入相应二抗(1 ∶10000),TBST 溶液洗膜后,加入ECL 发光液于Bio-Rad 图像分析仪进行蛋白条带灰度扫描,以β-actin 为内参,分析目的蛋白表达水平。 实验单独重复3 次。
1.4 统计学方法
GraphPad Prism 5.0 进行统计分析,数据结果用平均数±标准差(¯x±s)表示,两组间样本使用t检验,多组间比较采用单因素方差分析(one-way ANOVA),两两比较采用Turkey 检验。 以P<0.05表示差异具有统计学意义。
2 结果
2.1 YAP 在IMN 肾组织中的表达
IHC 染色结果显示,Normal 组肾小球中有少量YAP 蛋白表达,且主要表达于细胞胞质中,而在IMN 患者中,YAP 蛋白在肾小球中表达明显增加(P<0.05),且多数表达于细胞核中(图1)。
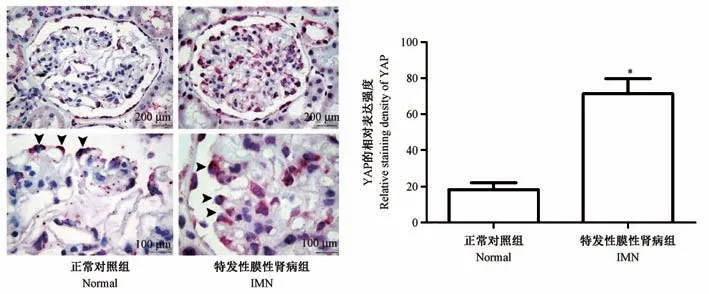
注:与Normal 组相比,*P<0.05。
2.2 C5b-9 激活足细胞中YAP 信号表达
Western blot 实验结果显示,随C5b-9 刺激时间的延长,p-YAP 蛋白表达无明显变化,而非磷酸化YAP 蛋白表达逐渐增加,且以24 h 增加趋势最为明显,故足细胞中p-YAP/YAP 比值随C5b-9 刺激时间而不断降低(P<0.05)。 而在细胞中p-YAP 蛋白不能进入细胞核以激活下游靶基因的转录,但YAP蛋白则能够完成上述作用,提示C5b-9 能够激活YAP 信号表达(图2)。
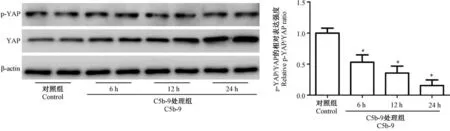
注:与Control 组相比,*P<0.05。
2.3 转染si-YAP 后足细胞中YAP mRNA 及蛋白的表达水平
qRT-PCR 及Western blot 实验结果显示,转染沉默YAP 表达的si-YAP 后足细胞中YAP mRNA及蛋白的表达水平均显著降低(P<0.05),而转染si-NC 后足细胞无明显变化(P>0.05,图3)。
2.4 沉默YAP 基因对C5b-9 刺激后的足细胞活性的影响
CCK-8 检测结果显示,与Control 组相比,C5b-9组、C5b-9+si-NC 组及C5b-9+si-YAP 组细胞活力均显著降低(P<0.05);但与C5b-9 组或C5b-9+si-NC组相比,C5b-9+si-YAP 组细胞活力显著增加(P<0.05),前两组无明显差异(P>0.05,图4)。
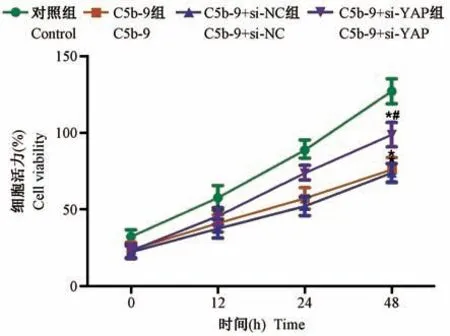
注:与Control 组相比,*P<0.05;与C5b-9 组相比,#P<0.05。
2.5 沉默YAP 基因对C5b-9 刺激后足细胞凋亡影响
Annexin V-FITC 结合流式细胞术检测各组足细胞凋亡结果表明,与Control 组相比,C5b-9 组、C5b-9+si-NC 组及C5b-9+si-YAP 组细胞凋亡比例均显著增加(P<0.05);但与C5b-9 组或C5b-9+si-NC 组相比,C5b-9+si-YAP 组细胞凋亡比例显著减少(P<0.05),前两组无明显差异(P>0.05,图5)。
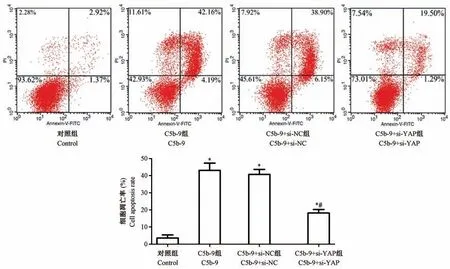
注:与Control 组相比,*P<0.05;与C5b-9 组相比,#P<0.05。
2.6 沉默YAP 基因对C5b-9 刺激后足细胞中ROS 产生的影响
流式细胞仪检测各组足细胞中ROS 表达的结果显示,与Control 组相比,C5b-9 组、C5b-9+si-NC组及C5b-9+si-YAP 组细胞中ROS 含量显著增加(P<0.05);但与C5b-9 组或C5b-9+si-NC 组相比,C5b-9+si-YAP 组细胞中ROS 显著减少(P<0.05),前两组无显著差异(P>0.05,图6)。

注:与Control 组相比,*P<0.05;与C5b-9 组相比,#P<0.05。
2.7 沉默YAP 基因对C5b-9 刺激后足细胞标志性蛋白、紧密连接蛋白和表型转换蛋白表达的影响
Western blot 检测各组细胞中足细胞标志性蛋白Nephrin、WT1 及紧密连接蛋白ZO-1 和表型转换蛋白Snail、纤连蛋白Fibronectin 的表达结果显示,与Control 组相比,C5b-9 组、C5b-9+si-NC 组及C5b-9+si-YAP 组细胞中Nephrin、WT1 及ZO-1 蛋白表达显著降低(P<0.05),Snail 与Fibronectin 蛋白表达显著增加(P<0.05);但与C5b-9 组或C5b-9+si-NC组相比,C5b-9+si-YAP 组细胞中Nephrin、WT1 及ZO-1 蛋白表达显著增加(P<0.05),而Snail 与Fibronectin 蛋白表达显著减少(P<0.05,图7)。
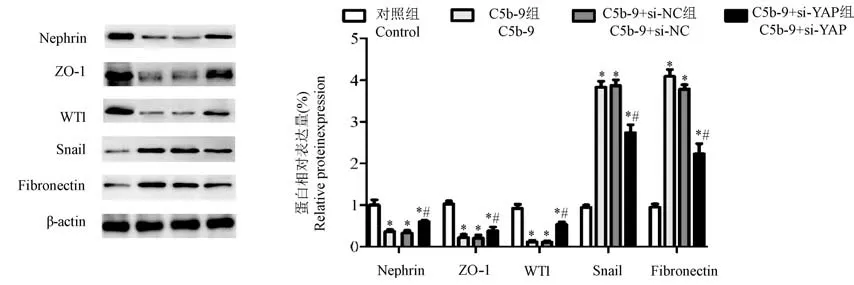
注:与Control 组相比,*P<0.05;与C5b-9 组相比,#P<0.05。
3 讨论
足细胞是位于肾组织毛细血管球外侧的终末分化细胞,其不仅是构成肾小球过滤屏障的重要组成细胞,同时也是免疫介导和非免疫损伤的重要作用靶点[11]。 而持续的足细胞损伤则会导致细胞数量的减少,进而引起肾功能不全,乃至终末期肾病的发生。 既往研究证实补体系统的异常活化在IMN足细胞损伤中具有重要地位,而C5b-9 作为补体活化的终产物,更能直接破坏足细胞的正常结构与功能[5]。 因此积极探究C5b-9 损伤足细胞的相关机制对阐明IMN 的发生发展具有重要意义。 本研究结果显示,通过siRNA 转染技术沉默在IMN 肾组织中过表达的YAP 基因能够显著改善C5b-9 诱导的足细胞损伤,这提示YAP 信号可能在IMN 的致病机制中具有重要作用。
YAP/Hippo 信号通路是近年来受到广大学者关注的一条调控细胞增殖、分化和凋亡相关基因转录和表达的重要信号通路[7]。 研究发现Hippo 途径在动物体内具有高度保守性,其主要由Mst1/2 激酶,Lats1/2 激酶和共转录激活因子YAP 或TAZ 构成[12]。 在细胞中,上游的相关调控元件如NF2、KIBRA 等,磷酸化Mst1/2 激酶,并使其转为激活状态,从而进一步同样磷酸化并活化Lats1/2 激酶,而活化Lats1/2 激酶可以直接使下游的YAP 蛋白发生磷酸化。 分子机制相关研究发现,骨架蛋白14-3-3等能够与磷酸化的YAP 相结合,使其滞留在胞浆中,并经泛素化途径被降解。 而未发生磷酸化的YAP 蛋白能够顺利进入细胞核,并与TEAD 结合,启动下游相关靶基因的转录及表达,参与调控细胞的增殖与凋亡过程[13-15]。 提示未发生磷酸化的核内YAP 才具有发挥相关生物学活性的作用。 在本研究中,我们通过免疫组织化学染色发现YAP 蛋白在IMN 患者肾小球足细胞中的表达异常增加,且其定位多位于细胞核内。 这提示在IMN 中YAP 可能通过调控下游相关靶基因的转录导致参与IMN 的发生进展。
随着对YAP/Hippo 信号通路认识的加深,人们发现主要定位于肾小球足细胞内的YAP 蛋白与细胞的损伤,凋亡,细胞骨架的异常及间质性表型转换等密切相关,然而其具体作用仍存在争议。 如Campbell 等[16]研究发现,YAP 蛋白能通过分子结构中的WWW 结构域与树突蛋白dendrin 的相关序列进行结合,从而抑制细胞核内促凋亡信号的转录,避免阿霉素或星形孢菌素所诱导的足细胞凋亡。同样在局灶节段性性肾小球硬化中,足细胞核内YAP 蛋白的含量减少,加速了基质中胶原纤维的产生及足细胞的丢失[17]。 这些研究提示YAP 在保护足细胞功能及维持肾小球过滤屏障中具有关键作用。 然而,其他研究也表明,细胞核内YAP 信号的过度表达则会造成足细胞的损伤及凋亡。 如在糖尿病肾病(DN)中,足细胞核中异常聚集的YAP 蛋白与患者收缩压、血尿素氮,肌酐的升高及DN 的病理分级呈正相关,提示抑制YAP 活性可能具有延缓DN 进展的作用[18]。 国内学者谢可炜[19]在阿霉素肾病的体内外研究中发现,过表达足细胞中YAP 蛋白可能通过促进周期相关蛋白CDK4 和CyclinD1 的表达,从而诱导静止期的足细胞重新进入细胞周期,并发生间充质细胞分化,严重影响足细胞的正常功能,并使其发生“有丝分裂灾难”,加速足细胞的丢失。 本研究通过体外建立C5b-9 损伤足细胞模型发现,随着C5b-9 刺激时间的延长,足细胞中非磷酸化YAP 蛋白的表达逐渐增加,而沉默YAP 基因表达能显著缓解C5b-9 诱导的足细胞增殖活性降低,凋亡增加、ROS 产生及足细胞损伤与间质细胞表型转化现象,同样提示YAP 在足细胞的异常表达及定位可能通过损伤足细胞的功能,促进IMN 的发生发展。
综上,本研究结果表明YAP 蛋白在IMN 患者肾小球中的表达显著增加,沉默足细胞中YAP 基因表达能够明显改善C5b-9 诱导的细胞功能损伤,抑制其凋亡的发生。 虽然YAP 在足细胞损伤中的具体作用机制仍需进一步研究,但本研究有望为YAP在IMN 治疗的潜在作用靶点提供实验室及理论基础。
