槲皮素预处理调节AMPK/mTOR 信号通路介导的自噬途径改善大鼠肝缺血再灌注损伤
2022-04-19沈钦海张盟辉秦召敏
沈钦海张盟辉秦召敏*刘 军
(1.山东医学高等专科学校医学系,济南 250002;2.山东省济南市第四人民医院普通外科,山东大学附属省立医院,济南 250000;3.山东大学齐鲁医院,济南 250021)
肝缺血再灌注损伤常见于出血性休克、肝手术、肝移植术等过程中,可引起肝损伤、肝衰竭等,也是肝手术移植失败的重要原因[1]。 自噬是一个将自身细胞器或细胞质中的蛋白包被形成囊泡,通过自噬溶酶体,使囊泡内容物降解的过程,在机体生理和病理过程中常见[2],其发挥的作用在不同组织和细胞中各不相同。 前人研究发现,在肝缺血再灌注损伤过程中,上调细胞自噬具有保护肝功能的作用[3]。 另外,通过提高腺苷酸活化蛋白激酶(adenosine monophosphate activated protein kinase,AMPK)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路调节的自噬,可缓解缺血再灌注诱导的肝损伤[4]。 槲皮素是一种天然的膳食黄酮,具有显著的抗氧化作用,可通过降低炎症反应,对心脏等器官起保护作用[5]。 而且槲皮素能有效改善大鼠肝缺血再灌注损伤[6],但是槲皮素预处理对大鼠肝缺血再灌注损伤的缓解作用及对AMPK/mTOR 信号通路介导自噬途径的影响,未见报道。 本研究使用槲皮素及自噬抑制剂氯喹预处理肝缺血再灌注损伤的大鼠模型,旨在从AMPK/mTOR 信号通路探讨槲皮素对缺血再灌注损伤大鼠自噬的影响。
1 材料和方法
1.1 实验动物
SPF 级SD 大鼠(50 只,雄性,5 周龄,体重170~180 g)购自山东大学医学院实验中心[SCXK(鲁)2018-0003],于山东大学实验室饲养[SYXK(鲁)2019-0043],符合山东大学实验室动物伦理保护标准及相关法律规定(2020-S-09),按照3R 原则关照实验动物。
1.2 主要试剂与仪器
槲皮素(原料药,纯度≥98%)购自南京泽朗医药科技有限公司;自噬抑制物-氯喹(规格:50 mg,纯度:97%),购自麦克林生化科技有限公司。
苏木素-伊红(HE)染色试剂盒购自上海雅吉生物 科 技 有 限 公 司; 单 丹 磺 酰 尸 胺(monodansylcadaverin,MDC)购自上海基尔顿生物科技有限公司; β-actin 鼠抗购自Sigma 公司;Beclin1、磷酸化(phosphorylation,p)-AMPK、AMPK、p-mTOR、mTOR 一抗和辣根过氧化物酶标记的IgG二抗均购自Abcam 公司。
全自动生化分析仪(BK-200 型)购自山东博科;酶标仪(Fax-20100 型)购自美国INStat;光学显微镜(SMZ745 型)购自日本尼康;ChemiDoc-MP 全能型凝胶成像分析系统购自山东三瑞科技有限公司。
1.3 实验方法
1.3.1 肝缺血再灌注大鼠模型的建立及分组
将SPF 级SD 大鼠使用随机数字表法分为对照组,模型组、槲皮素组、氯喹组和槲皮素+氯喹组。手术前3 天,槲皮素组大鼠灌胃给予槲皮素(0.5%羧甲基纤维素钠溶解),给药剂量0.1 g/kg[7],氯喹组大鼠腹腔注射0.02 g/kg 氯喹[8](自噬抑制剂,蒸馏水溶解),槲皮素+氯喹组灌胃给予槲皮素同时腹腔注射氯喹,对照组和模型组给予等体积蒸馏水和0.5%羧甲基纤维素钠溶剂,每天1 次。 参考马志勇等[9]方法构建肝缺血再灌注大鼠模型:大鼠术前禁食12 h,自由饮水,腹腔注射1%戊巴比妥钠(30 mg/kg)麻醉,固定于手术板上,切开腹壁,游离肝蒂,使用血管夹钳夹肝蒂进行肝缺血,60 min 后松开血管夹使血液灌注6 h,其中对照组仅游离肝蒂不进行嵌夹,所有大鼠血液再灌注6 h 后处死,收集各组大鼠血液、肝组织进行检测。
1.3.2 全自动生化分析仪检测大鼠肝功能指标
分离上述1.3.1 中收集的各组大鼠部分新鲜血液中血清(剩余血清置于4℃冰箱中,用于后续检测),置于全动生化分析仪上检测血清中谷氨酸-丙酮酸转氨酶(ALT)和天门冬氨酸酰基转移酶(AST)水平。 两者用于反映肝功能的指标,水平越高表明肝损伤越严重。
1.3.3 HE 染色观察各组大鼠肝组织病理学变化
取上述1.3.1 中收集的各组大鼠部分新鲜肝组织,经过固定(4%多聚甲醛,24 h)、包埋(石蜡)、切片(5 μm),然后脱蜡(二甲苯)、脱水(梯度乙醇)、染色(苏木精-伊红)等过程,具体操作步骤严格按照HE 染色试剂盒进行,最后在石蜡切片中滴1 滴中性树胶进行封片,光学显微镜观察。
1.3.4 ELISA 法检测血清中炎性因子含量
取上述1.3.1 中置于4℃冰箱中的各组大鼠剩余血清,严格按照IL-6、TNF-α、IL-1β ELISA 试剂盒说明书进行操作。
1.3.5 MDC 观察并计算各组肝组织细胞中自噬率
取上述1.3.1 中收集的各组大鼠新鲜肝组织各0.05 g 剪碎、胰蛋白酶制成单细胞悬液(剩余肝组织置于-80℃冰箱中保存),接种至6 孔板(2 mL/孔),将6 孔板离心、PBS 缓冲液洗涤、1 mL 4%多聚甲醛固定、50 μmol/L MDC 染色、37℃温育,30 min 后,观察并计数MDC 阳性细胞,MDC 阳性细胞率即为细胞自噬率。
1.3.6 Western blot 法检测各组大鼠肝组织中Beclin1、AMPK、mTOR 蛋白表达水平
取上述1.3.5 中置于-80℃冰箱中的大鼠肝组织,提取总蛋白并对蛋白进行定量,然后进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳、转膜、封闭,与Beclin1、AMPK、p-AMPK、p-mTOR、mTOR、β-actin鼠抗(稀释比均为1 ∶2000)4℃孵育过夜,与辣根过氧化物酶标记羊抗鼠IgG 二抗(1 ∶5000)室温孵育2 h 后、显色、凝胶成像分析系统分析条带灰度值。
1.4 统计学方法
使用软件SPSS 24.0 进行统计分析,平均数±标准差(¯x±s)表示计量数据,多组间比较和进一步两两间比较分别行单因素方差分析和SNK-q检验,P<0.05 表示差异有统计学意义。
2 结果
2.1 槲皮素预处理对肝缺血再灌注大鼠肝功能指标的影响
模型组ALT 和AST 水平显著高于对照组(P<0.05);槲皮素组ALT 和AST 水平显著低于模型组(P<0.05),氯喹组ALT 和AST 水平显著高于模型组(P<0.05)。 与槲皮素组相比,槲皮素+氯喹组ALT 和AST 水平显著升高(P<0.05);与氯喹组相比,槲皮素+氯喹组ALT 和AST 水平显著降低(P<0.05)。 见表1。

表1 各组大鼠肝功能指标比较(¯x±s,n=10)Table 1 Liver function indexes of rats in each group
2.2 槲皮素预处理对肝缺血再灌注大鼠肝组织病理学变化的影响
对照组大鼠肝组织结构完整,肝细胞排列整齐,无显著坏死现象;模型组大鼠肝组织结构紊乱,肝细胞排列疏松,出现坏死,槲皮素组较模型组大鼠肝组织病理损伤有所缓解,氯喹组较模型组大鼠肝组织病理损伤加重;槲皮素+氯喹组较槲皮素组大鼠肝组织病理损伤加重,较氯喹组大黄素肝组织病理损伤减轻。 见图1。
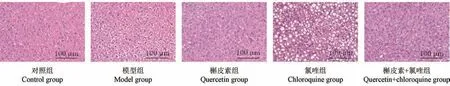
图1 各组大鼠肝组织病理学HE 染色图Figure 1 Hepatic histopathological HE staining of rats in each group
2.3 槲皮素预处理对肝缺血再灌注大鼠血清中炎性因子含量的影响
模型组大鼠血清中IL-6、TNF-α、IL-1β 含量显著高于对照组(P<0.05);与模型组相比,槲皮素组大鼠血清中IL-6、TNF-α、IL-1β 含量显著降低(P<0.05),氯喹组大鼠血清中IL-6、TNF-α、IL-1β 含量显著升高(P<0.05)。 与槲皮素组相比,槲皮素+氯喹组大鼠血清中IL-6、TNF-α、IL-1β 含量显著升高(P<0.05);与氯喹组相比,槲皮素+氯喹组大鼠血清中IL-6、TNF-α、IL-1β 含量显著降低(P<0.05)。见表2。

表2 各组大鼠血清中IL-6、TNF-α、IL-1β 含量比较(¯x±s,n=10)Table 2 Contents of IL-6, TNF-α and IL-1β in serum of rats in each group
2.4 槲皮素预处理对肝缺血再灌注大鼠肝组织细胞自噬率的影响
与对照组相比,模型组大鼠肝组织细胞自噬率显著降低(P<0.05);与模型组相比,槲皮素组大鼠肝组织细胞自噬率显著升高(P<0.05),氯喹组大鼠肝组织细胞自噬率显著降低(P<0.05)。 与槲皮素组相比,槲皮素+氯喹组大鼠肝组织细胞自噬率显著降低(P<0.05);与氯喹组相比,槲皮素+氯喹组大鼠肝组织细胞自噬率显著升高(P<0.05)。 见表3、图2。

注:箭头所示为MDC 染色阳性细胞。
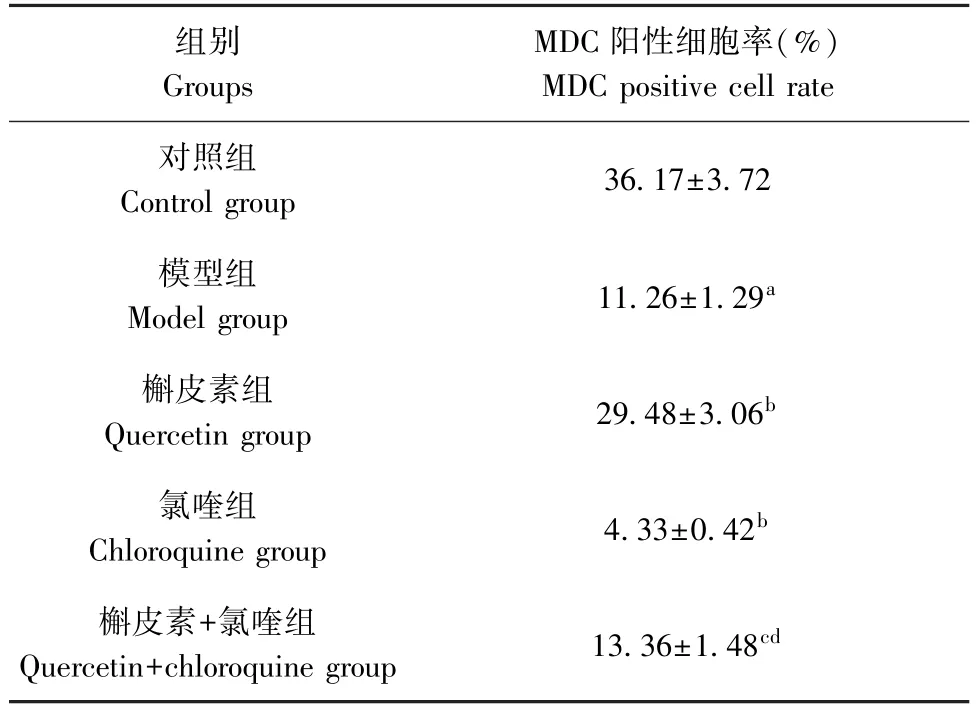
表3 各组大鼠肝组织细胞自噬率比较(¯x±s,n=10)Table 3 Autophagy rates in liver tissue cells of rats in each group
2.5 槲皮素预处理对肝缺血再灌注大鼠肝组织Beclin1、AMPK、mTOR 蛋白表达水平的影响
模型组大鼠肝组织中Beclin1 蛋白表达水平及AMPK 蛋白磷酸化水平显著低于对照组(P<0.05),mTOR 蛋白磷酸化水平显著高于对照组(P<0.05)。槲皮素组大鼠肝组织中Beclin1 蛋白表达水平及AMPK 蛋白磷酸化水平显著高于模型组(P<0.05),mTOR 蛋白磷酸化水平显著低于模型组(P<0.05);氯喹组大鼠肝组织中Beclin1 蛋白表达水平及AMPK 蛋白磷酸化水平显著低于模型组(P<0.05),mTOR 蛋白磷酸化水平显著高于模型组。 与槲皮素组比,槲皮素+氯喹组大鼠肝组织中Beclin1 蛋白表达水平及AMPK 蛋白磷酸化水平显著降低(P<0.05),mTOR 蛋白磷酸化水平显著升高(P<0.05);与氯喹组比,槲皮素+氯喹组大鼠肝组织中Beclin1蛋白表达水平及AMPK 蛋白磷酸化水平显著升高(P<0.05),mTOR 蛋白磷酸化水平显著降低(P<0.05)。 见表4、图3。

表4 各组大鼠肝组织中Beclin1 蛋白表达及AMPK 和mTOR 蛋白磷酸化水平比较(¯x±s,n=10)Table 4 Comparison of Beclin1 protein and AMPK,mTOR phosphorylation proteins expression levels in liver tissue of rats in each group
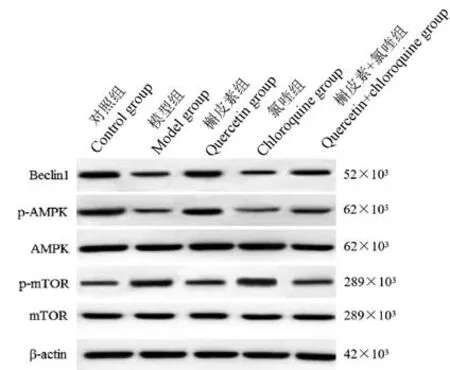
图3 各组大鼠肝组织中Beclin1、p-AMPK、AMPK、p-mTOR、mTOR 蛋白表达条带图Figure 3 Expression of Beclin1, p-AMPK, AMPK,p-mTOR and mTOR proteins in liver tissue of rats in each group
3 讨论
肝缺血再灌注是肝手术或肝移植的必要组成部分,缺血过程中不可避免会造成肝细胞损伤,再灌注后肝功能也不太可能迅速恢复正常[10]。 在大多数情况下,术后会出现肝炎症、损伤甚至严重的肝功能障碍,严重者甚至可导致多器官功能衰竭甚至死亡[11]。 因此,预防和减轻肝缺血再灌注损伤对改善患者预后、降低死亡率具有重要影响。 何莹等[12]研究发现老年大鼠肝缺血再灌注损伤伴随自噬作用降低及自噬相关蛋白水平显著下降。 本研究通过构建大鼠肝缺血再灌注损伤,发现模型组大鼠肝组织结构紊乱,肝细胞排列疏松,出现坏死,ALT 和AST 水平、IL-6、TNF-α、IL-1β 含量显著升高,肝组织细胞自噬率、Beclin1 蛋白表达水平显著降低,提示肝缺血再灌注大鼠肝组织出现病理损伤及炎症反应,且细胞自噬减少。
槲皮素可以降低血压、血脂,抗癌、抗炎和抗氧化应激,对多种心血管疾病具有良好的治疗效果,广泛存在于双子植物中,是一种黄酮类化合物[13]。其中,槲皮素不但能显著抑制乳腺癌细胞的生长[14],还能诱发原发积液性淋巴瘤细胞的自噬[15]。另外,Uylas 等[16]研究发现,槲皮素在正确剂量下可有效预防肝缺血再灌注损伤,He 等[17]研究发现槲皮素可以通过mTOR 途径增强缺氧诱导的肺动脉平滑肌细胞自噬,治疗缺氧相关性肺动脉高压疾病。 本研究发现,槲皮素可显著缓解肝缺血再灌注大鼠肝组织病理损伤,降低肝功能指标ALT 和AST水平以及炎性因子IL-6、TNF-α、IL-1β 含量,提高肝组织细胞自噬率和Beclin1 蛋白表达水平,提示槲皮素能够激活细胞自噬,缓解肝损伤。 但其中的机制尚需进一步研究。
Wang 等[18]研究发现高血糖通过抑制AMPK/mTOR 介导的自噬,促进肝内巨噬细胞NLRP3 炎症小体的激活,加重急性肝损伤。 本研究发现,肝缺血再灌注模型大鼠肝组织中Beclin1 蛋白表达水平、AMPK 蛋白磷酸化水平显著降低,mTOR 蛋白磷酸化水平显著升高,提示AMPK/mTOR 信号通路介导的自噬在模型大鼠中处于抑制状态,而经槲皮素预处理后,AMPK/mTOR 信号通路介导的自噬得到激活。 另外,肾上腺髓质素可能通过AMPK/mTOR 轴激活自噬,从而保护间质细胞的甾体生成功能,防止细胞焦亡[19];阻碍AMPK/mTOR 信号通路介导的自噬能够促进小鼠非酒精性脂肪肝[20]。 为进一步探究槲皮素是通过AMPK/mTOR 信号通路介导的自噬发挥肝缺血再灌注损伤的保护作用,本研究通过采用自噬抑制剂氯喹单独及槲皮素和氯喹联合预处理肝缺血再灌注大鼠,发现大鼠肝组织病理损伤程度介于槲皮素和氯喹单独干预之间;ALT 和AST 水平、IL-6、TNF-α、IL-1β 含量以及mTOR 蛋白磷酸化水平比槲皮素单独干预升高,比氯喹单独干预降低,肝组织细胞自噬率、Beclin1 蛋白表达水平及AMPK 蛋白磷酸化水平比槲皮素单独干预降低,比氯喹单独干预升高,提示槲皮素改善肝缺血再灌注大鼠肝损伤的作用可被氯喹逆转,进一步说明槲皮素减轻肝缺血再灌注大鼠肝损伤的作用机制与激活AMPK/mTOR 信号通路介导的自噬有关。
综上所述,槲皮素预处理可能通过激活肝缺血再灌注大鼠肝组织中AMPK/mTOR 信号通路介导的自噬,缓解肝损伤。 但是自噬涉及的信号通路较多且肝缺血再灌注的作用机制较为复杂,槲皮素预处理对肝缺血再灌注大鼠的保护作用,是否还涉及自噬相关的其他信号通路,尚需进一步研究。
