MRI 弥散张量成像在颅内肿瘤切除术术前评估中的应用价值
2022-04-18卢禹石梦园杨博
卢禹,石梦园,杨博
南阳医学高等专科学校第一附属医院1核磁共振科,2病理科,河南 南阳 473000
颅内肿瘤是临床常见的肿瘤类型,近年来发病率呈现升高趋势,有研究发现颅内肿瘤发病率占全身肿瘤的5%,而且其他部位恶性肿瘤近1/5会转移到脑部,对患者的生活质量和身心健康产生严重的影响。目前颅内肿瘤主要以手术治疗为主,因此术前准确评估颅内肿瘤生物学行为和良恶性对治疗方案制订和预后评估具有重要的意义[1]。MRI一直是临床诊断颅内肿瘤的重要方法,根据病变大小、形态、数目、信号特点、水肿情况等对颅内肿瘤进行诊断,但是对于表现不典型的患者则定性诊断相对困难。随着医学技术的发展,MRI逐渐广泛应用于临床,弥散张量成像(diffusion ten-sor imaging,DTI)是在弥散加权成像基础上发展的新技术,也是目前研究活体脑组织的唯一非侵入式方法,可以对脑实质病理与生理状态变化进行定量分析[2]。本研究分析了MRI DTI在颅内肿瘤切除术术前评估中的应用价值,以期为临床提供诊疗依据,现报道如下。
1 资料与方法
1.1 一般资料
收集2017年1月至2020年2月于南阳医学高等专科学校第一附属医院治疗的颅内肿瘤患者的病历资料。纳入标准:①在南阳医学高等专科学校第一附属医院接受颅内肿瘤切除术,且经病理学检查确诊;②MRI检查结束后7天内接受手术治疗;③在南阳医学高等专科学校第一附属医院接受MRI常规及DTI扫描;④图像质量佳;⑤恶性胶质瘤世界卫生组织(WHO)分级为2~4级。排除标准:①图像伪影重;②术前有放化疗等治疗史。根据纳入、排除标准,共纳入74例颅内肿瘤患者,其中,男性44例,女性30例;年龄34~72岁,平均(60.15±9.80)岁。本研究经医院伦理委员会审批通过,所有患者均知情同意并签署知情同意书。
1.2 MRI检查
采用Siemens Magnetom Verio Dot 3.0T MRI成像系统开展MRI检查,头部相控阵线圈,患者取仰卧位,常规MRI包括轴位T1加权成像(T1 weighted image,T1WI)、T2加权成像(T2 weighted image,T2WI)及增强T1WI。横轴位自旋回波(spin echo,SE)序列 T1WI参数:回波时间(echo time,TE)15 ms,重复时间(repetition time,TR)430 ms,视野(field of view,FOV)230×230,矩阵256×256,扫描间隔1 mm,扫描层厚5 mm;横轴位快速自旋回波(fast spin echo,FSE)T2WI参数:TE 100 ms,TR 4800 ms,FOV 230×230,矩阵256×256,扫描间隔1 mm,扫描层厚5 mm;横轴位T1WI增强扫描,注射0.1 mmol/kg钆喷酸葡胺。DTI扫描:单次发射平面回波成像(echo planar imaging,EPI)序列横轴位,TE 86 ms,TR 4600 ms,FOV 240×240,矩阵128×128,扫描间隔0 mm,扫描层厚3 mm,在20个方向施加弥散梯度,扩散敏感系数取0 s/mm2和800 s/mm2,成像494层,采集时间255 s。
1.3 图像分析
根据平扫和增强图像将强化区最显著区域记为肿瘤实质区,低级别胶质瘤显示无强化,可将T2WI信号最高区域的实质部分作为感兴趣区域,肿瘤周围1.5 cm以内、无强化区域标记为瘤周区,各区感兴趣区域应选择病灶实质信号均匀的区域,避开不均匀的区域,测量3次,结果以平均值为准[3]。将数据传送至工作站进行处理,自动生成表观扩散系数(apparent diffusion coefficient,ADC)、各向异性分数(fractional anisotropy,FA);相对各向异性分数(relative fractional anisotropy,rFA)=肿瘤实质区FA值/对侧相对应正常区域FA值,相对表观扩散系数(relative apparent diffusion coefficient,rADC)=肿瘤实质区ADC值/对侧正常区域ADC值。所有数据均由两名5年以上具有医学影像诊断资格的医师单独阅片,存在意见不统一情况则共同商讨并确定结论。
1.4 统计学处理
采用SPSS 22.0软件进行数据分析,计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以例数及率(%)表示,组间比较采用χ2检验;价值分析采用受试者工作特征(receiver operator characteristic,ROC)曲线分析。以P<0.05为差异有统计学意义。
2 结果
2.1 病理结果
术后病理诊断结果:74例颅内肿瘤患者中,良性脑肿瘤32例(均为脑膜瘤),恶性脑肿瘤42例(均为脑胶质瘤),其中低级别脑胶质瘤(low grade glioma,LGG)28例(WHO 2级),高级别脑胶质瘤(high grade glioma,HGG)14例(WHO 3~4级)。良性脑肿瘤患者中,男性19例,女性13例;平均年龄(59.47±9.12)岁。恶性脑肿瘤患者中,男性25例,女性17例;平均年龄(61.03±10.28)岁。良性脑肿瘤与恶性脑肿瘤患者的性别、年龄比较,差异均无统计学意义(P>0.05)。
2.2 良恶性脑肿瘤患者ADC、rADC、FA、rFA值的比较
恶性脑肿瘤患者ADC值、FA值和rFA值均明显低于良性脑肿瘤,差异均有统计学意义(P<0.01);良恶性脑肿瘤患者rADC值比较,差异无统计学意义(P>0.05)。(表1)
表1 良恶性脑肿瘤患者ADC、rADC、FA、rFA值的比较(±s)
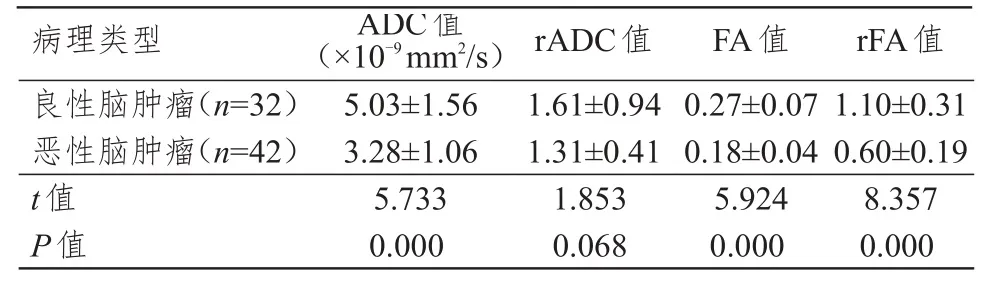
表1 良恶性脑肿瘤患者ADC、rADC、FA、rFA值的比较(±s)
病理类型良性脑肿瘤(n=3 2)恶性脑肿瘤(n=4 2)t值P值5.0 3±1.5 6 3.2 8±1.0 6 5.7 3 3 0.0 0 0 1.6 1±0.9 4 1.3 1±0.4 1 1.8 5 3 0.0 6 8 0.2 7±0.0 7 0.1 8±0.0 4 5.9 2 4 0.0 0 0 1.1 0±0.3 1 0.6 0±0.1 9 8.3 5 7 0.0 0 0 A D C值(×1 0-9 m m 2/s)r A D C值F A值r F A值
2.3 不同级别脑胶质瘤ADC、rADC、FA、rFA值的比较
HGG患者ADC值、FA值和rFA值均明显低于LGG患者,差异均有统计学意义(P<0.01);HGG和LGG患者rADC值比较,差异无统计学意义(P>0.05)。(表2)
表2 不同级别脑胶质瘤患者ADC、rADC、FA、rFA值的比较(±s)
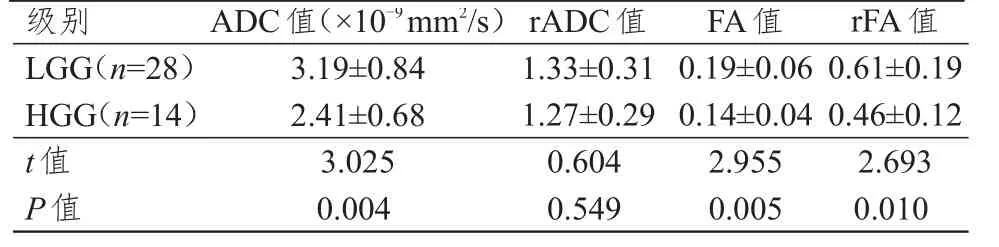
表2 不同级别脑胶质瘤患者ADC、rADC、FA、rFA值的比较(±s)
级别L G G(n=2 8)H G G(n=1 4)t值P值3.1 9±0.8 4 2.4 1±0.6 8 3.0 2 5 0.0 0 4 1.3 3±0.3 1 1.2 7±0.2 9 0.6 0 4 0.5 4 9 0.1 9±0.0 6 0.1 4±0.0 4 2.9 5 5 0.0 0 5 0.6 1±0.1 9 0.4 6±0.1 2 2.6 9 3 0.0 1 0 A D C值(×1 0-9 m m 2/s)r A D C值F A值r F A值
2.4 ADC、FA及rFA 的诊断价值
ADC、FA及rFA联合检测诊断恶性脑肿瘤的ROC曲线下面积为0.987,其诊断价值高于各单项指标的诊断价值(表3、图1);ADC、FA及rFA联合检测诊断HGG的ROC曲线下面积为0.908,其诊断价值高于各单项指标的诊断价值(表4、图2)。

图1 ADC、FA及rFA 单独及联合检测诊断恶性脑肿瘤的ROC曲线
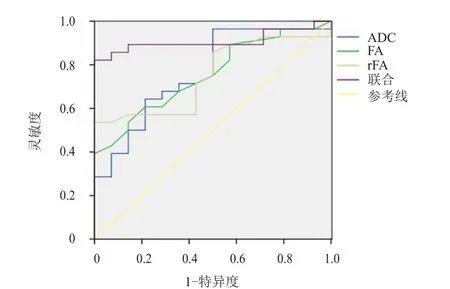
图2 ADC、FA及rFA 单独及联合检测诊断HGG的ROC曲线
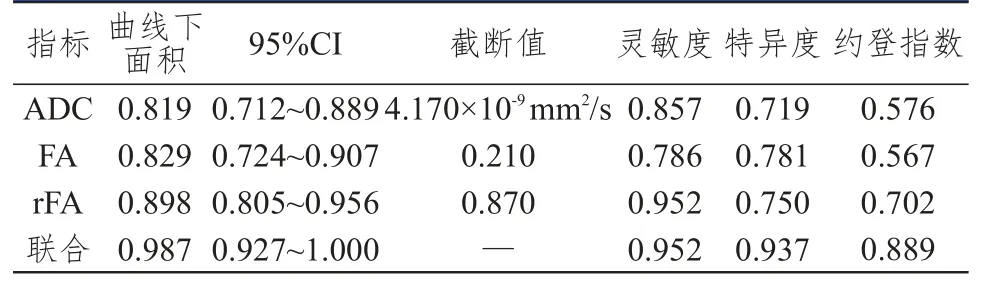
表3 ADC、FA及rFA单独及联合检测对恶性脑肿瘤的诊断价值
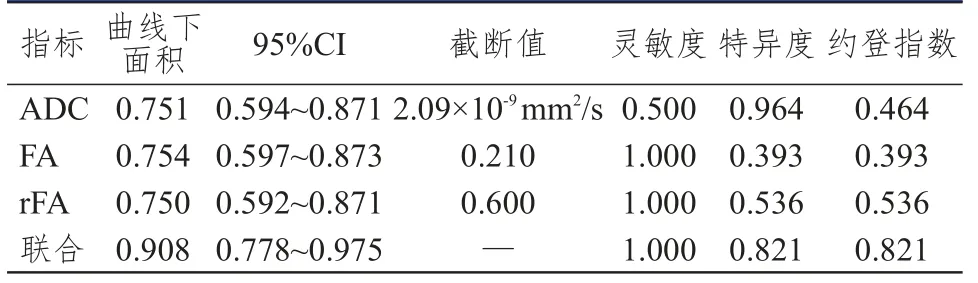
表4 ADC、FA及rFA单独及联合检测对HGG的诊断价值
3 讨论
颅内肿瘤是临床常见的肿瘤之一,对患者神经功能损伤较大,随着对患者神经压迫会导致出现相应的临床症状与体征。颅内肿瘤起源自颅脑不同区域,目前临床手术为有效的治疗方案,但是人体脑部的血管和神经分布较多且复杂,可能会出现肿瘤对血管推移和包埋,增加了手术难度[4]。手术前有效掌握颅内肿瘤部位、与周围邻近组织关系、血流状况等对于手术顺利进行、减少手术操作对患者脑组织损伤具有重要的意义[5]。研究发现,肿瘤的生物学行为不同,良恶性肿瘤生长方式不一样,肿瘤侵犯程度和增殖速度均存在明显的差异[6],因此手术治疗前要对颅内肿瘤进行准确定性,评估肿瘤侵犯范围,为临床选择合适的治疗方法提供依据[7]。MRI检查是临床常用的影像学检查方法,通过平扫和增强扫描能够根据信号特点和强化方式对典型肿瘤进行诊断,但是对于影像表现重叠患者诊断较为困难,对临床的决策和指导就无法起到有效的作用,部分胶质瘤患者由于浸润性生长,影像学表现为正常的区域也会出现肿瘤细胞,因此仅依据常规的MRI检查确定肿瘤切除范围会导致复发率较高,多次手术切除肿瘤也不利于患者预后,严重影响了患者生活质量与术后康复效果[8-9]。
随着MRI技术的发展,各种功能成像开始在临床广泛应用,为临床多种疾病的诊断提供了新的依据。DTI是弥散加权成像技术的进一步发展,是弥散加权成像技术的革新和延伸。DTI常用参数主要为FA、ADC、rFA、rADC等指标,颅内肿瘤类型不同,血管、细胞的密度及排列各异,因此DTI各参数值不同,可以通过测量肿瘤实质区、肿瘤周边白质区、对侧正常白质区DTI参数对肿瘤进行定性以及初步判断浸润范围[10-11]。研究发现,生物组织水分子弥散过程极为复杂,在脑组织内,轴突、髓鞘、神经元及细胞膜等结构是影响水分子弥散的主要因素,水分子弥散特性能够反映脑组织的细微结构,水分子在各个方向扩散的范围相同则为各向同性,如果不同运动的范围有差别则为各向异性,DTI可以在人体内无创地显示脑白质纤维束的走向、病理状态及纤维束与邻近病灶的位置关系[12]。
本研究显示,恶性脑肿瘤ADC、FA和rFA值均明显低于良性脑肿瘤,提示采用DTI对于鉴别脑部肿瘤良恶性具有重要的意义。HGG患者ADC、FA和rFA值均明显低于LGG患者。DTI参数中FA值与纤维束的完整性有关,反映脑组织受肿瘤浸润部分的比例关系,随肿瘤细胞恶性程度增加,其密度增加,导致细胞间隙减少、细胞核质比增加,致使水分子运动受限,FA值会明显降低[13];ADC值为水分子在各个弥散梯度方向上弥散情况与阻力情况的表现,肿瘤恶性程度越高弥散程度越低,ADC值越低[14];rFA为病变侧FA值与对侧正常白质区FA值的比值,主要用于消除FA值和ADC值在大脑不同白质区的异常变化情况[15-16];通过这些指标不仅能辨别肿瘤的良恶性,还能明确肿瘤的恶性程度,恶性程度越高肿瘤浸润性越强,就越能导致这些指标出现显著改变,这些指标的应用与既往影像学的区别在于可以明确肿瘤对周围脑组织的浸润情况和术前分级。通过绘制ROC曲线分析发现,ADC、FA和rFA联合检测诊断恶性脑肿瘤的ROC曲线下面积为0.987,其诊断价值高于各单项指标的诊断价值;ADC、FA和rFA联合检测诊断HGG的ROC曲线下面积为0.908,其诊断价值高于各单项指标的诊断价值;单项指标由于肿瘤实质部分细胞密度差异、细胞外间隙、白质纤维髓鞘完整性、肿瘤浸润与水肿区分存在一定难度等多种原因导致诊断肿瘤分级时价值相对偏低,而采用DTI中ADC、FA、rFA 3个指标联合诊断在鉴别颅内肿瘤良恶性和恶性肿瘤分级中具有良好的灵敏度和特异度,这也改变了既往常规MRI对肿瘤术前分级特异度不高的局面[17-18]。本研究分析了采用MRI DTI在颅内肿瘤中的诊断价值,为临床早期制订治疗方案和评估预后奠定了基础,但该技术可能因诸多因素如运动伪影、信号丢失、年龄等造成相关指标计算结果出现差异,还需要进一步深入论证分析。
综上所述,MRI DTI在颅内肿瘤切除术术前评估中有较好的应用价值,有助于鉴别良恶性肿瘤以及脑胶质瘤病理分级。
