程序性死亡受体1抑制剂联合化疗治疗晚期非小细胞肺癌患者的临床疗效及对甲状腺功能的影响
2022-04-18李杨闫艳菊陈贡斌周倩宇
李杨,闫艳菊,陈贡斌,周倩宇
商丘市第一人民医院肿瘤内科,河南 商丘 476100
肺癌是中国发病率和病死率均较高的恶性肿瘤之一,对患者的生命健康造成严重威胁[1]。临床将肺癌分为小细胞肺癌(small cell lung cancer,SCLC)和非小细胞肺癌(non-small cell lung cancer,NSCLC),超过80%的肺癌为NSCLC,NSCLC病灶极易出现远处转移,具有较高的病死率[2]。早期NSCLC患者基本无症状,大多数患者确诊时已为晚期,错过了最佳治疗时机[3]。临床中多采用化疗治疗晚期肺癌患者,可显著缓解临床症状,延长患者生存期。培美曲塞/多西他赛/吉西他滨/长春瑞滨+卡铂/顺铂/奈达铂为临床常用的肺癌化疗方案,治疗效果确切,但其不良反应较大,部分患者耐受性差,导致治疗总有效率较低,患者生存期较短,不利于患者预后[4]。研究发现,肿瘤特异性免疫检查点抑制剂类药物可有效延长NSCLC患者的生存期[5]。程序性死亡受体1(programmed cell death 1,PDCD1,也称PD-1)是免疫细胞的一种共抑制分子,是T细胞常见的免疫检查点,PD-1抑制剂单独使用效果较差,仅有20%~40%的患者获益[6]。甲状腺是人体最大的内分泌器官,化疗药物可引起内分泌异常,PD-1抑制剂联合化疗对患者甲状腺功能减退是否具有协同作用目前尚无统一定论。本研究探讨了PD-1抑制剂联合化疗治疗晚期NSCLC患者的临床疗效及对甲状腺功能的影响,现报道如下。
1 资料与方法
1.1 一般资料
选择2019年6月至2021年10月商丘市第一人民医院收治的晚期NSCLC患者。纳入标准:①经病理组织穿刺活检、影像学检查确诊为NSCLC;②临床分期为Ⅲ~Ⅳ期;③具有完整的病史及肺部影像学检查资料;④化疗为首选治疗方案;⑤卡氏功能状态(Karnofsky performance status,KPS)评分≥60分。排除标准:①合并其他部位恶性肿瘤;②不符合化疗适应证;③对治疗药物不耐受。根据纳入和排除标准,本研究共纳入56例NSCLC患者。按照治疗方法不同将患者分为对照组(n=30,采取常规化疗方案)和联合组(n=26,采取PD-1抑制剂联合化疗)。两组患者的年龄、性别、病理类型、临床分期比较,差异均无统计学意义(P>0.05)(表1),具有可比性。本研究经医院伦理委员会审批通过,所有患者均知情同意并签署知情同意书。
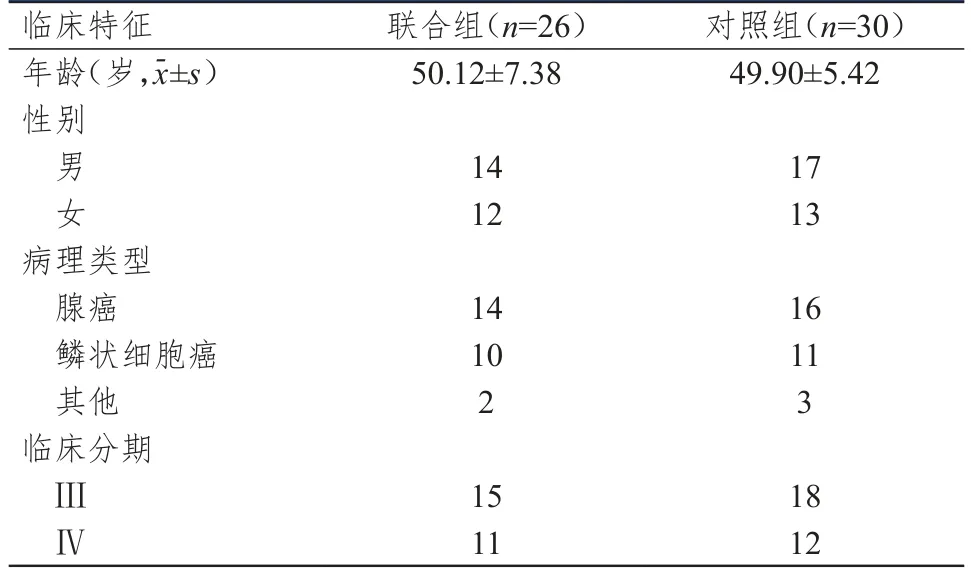
表1 两组患者的临床特征
1.2 治疗方法
对照组患者采取常规化疗方案,静脉滴注培美曲塞500 mg/m2或吉西他滨1000 mg/m2或多西他赛75 mg/m2,联合顺铂75 mg/m2或卡铂血药浓度-时间曲线下面积(area under the curve,AUC)=5或奈达铂75 mg/m2,21天为一个周期。联合组患者在对照组的基础上采用卡瑞利珠单抗治疗,每次200 mg,静脉滴注30~60 min,每3周1次,当患者出现病情进展、药物不良反应不可耐受时停止治疗,3周为一个周期。治疗过程中密切关注患者病情、药物耐受情况,并酌情调整用药。两组患者均治疗6个月。
1.3 观察指标及评价标准
①采用实体瘤疗效评价标准(response evaluation criteria in solid tumor,RECIST)[7]评价两组患者的临床疗效。完全缓解(complete response,CR):肿瘤病灶完全消失,至少持续1个月;部分缓解(partial response,PR):基线病灶长径总和缩小≥30%,至少持续1个月;病情稳定(stable disease,SD):基线病灶长径总和缩小<30%或增大<20%;疾病进展(progressive disease,PD):基线病灶长径总和增大≥20%或出现新病灶。客观缓解率(objective response rate,ORR)(%)=(CR+PR)例数/总例数×100%,疾病控制率(disease control rate,DCR)=(CR+PR+SD)例数/总例数×100%。②采集患者治疗前1天、治疗2个周期后第3周的清晨空腹静脉血5 ml,3000 r/min离心15 min后,取上清液冷冻保存待检。采用放射免疫分析法测定甲状腺功能指标,包括促甲状腺激素(thyroid stimulating hormone,TSH)、总三碘甲状腺原氨酸(total triiodothyronine,TT3)、总甲状腺素(total thyroxine,TT4)、游离三碘甲状腺原氨酸(free triiodothyronine,FT3)、游离甲状腺素(free thyroxine,FT4)水平,所有操作均严格按照试剂盒说明书进行。采用全自动化学发光免疫分析仪测定自身免疫性甲状腺炎诊断指标,包括抗甲状腺球蛋白抗体(anti-thyroglobulin antibody,anti-TGAb)、抗甲状腺过氧化物酶自身抗 体(anti-thyroid peroxidase autoantibody,anti-TPOAb)水平,所有操作均严格按照配套anti-TGAb、anti-TPOAb定量测定试剂盒说明书进行。③根据不良事件通用术语标准(common terminology criteria for adverse event,CTCAE)4.0版[4]评估两组患者的不良反应发生情况,包括骨髓抑制、皮疹、腹痛腹泻、恶心呕吐、肝肾功能不全、治疗相关性肺炎,不良反应分为0~4级。
1.4 统计学方法
采用SPSS 22.0软件对数据进行统计分析,符合正态分布且方差齐性的计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以例数和率(%)表示,组间比较采用χ2检验,等级资料的比较采用秩和检验;以P<0.05为差异有统计学意义。
2 结果
2.1 临床疗效的比较
联合组患者的ORR和DCR分别为42.31%(11/26)和80.77%(21/26),与对照组患者的26.67%(8/30)和70.00%(21/30)比较,差异均无统计学意义(χ2=1.520、0.862,P>0.05)。(表2)
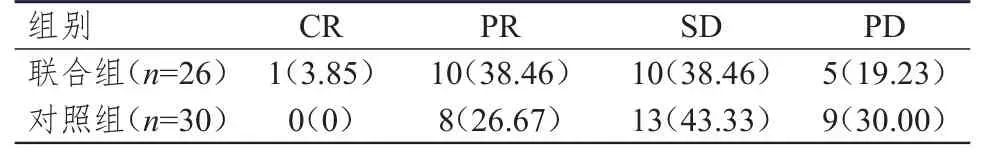
表2 两组患者的临床疗效[n(%)]
2.2 甲状腺功能指标的比较
治疗前,两组患者的TSH、TT3、TT4、FT3、FT4水平比较,差异均无统计学意义(P>0.05);治疗后,两组患者的TSH水平均高于本组治疗前,TT3、TT4、FT3、FT4水平均低于本组治疗前,且联合组患者的 TSH水平高于对照组,TT3、TT4、FT3、FT4水平均低于对照组,差异均有统计学意义(P<0.05)。(表3)
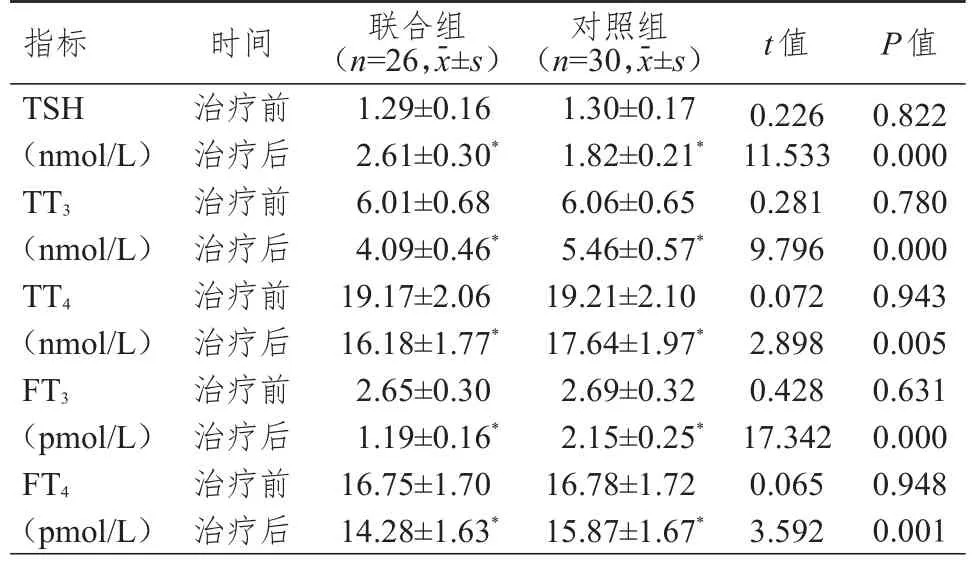
表3 治疗前后两组患者甲状腺功能指标的比较
2.3 anti-TGAb、anti-TPOAb水平的比较
治疗前,两组患者的anti-TGAb、anti-TPOAb水平比较,差异均无统计学意义(P>0.05);治疗后,两组患者的anti-TGAb、anti-TPOAb水平均高于本组治疗前,且联合组患者的anti-TGAb、anti-TPOAb水平均高于对照组,差异均有统计学意义(P<0.05)。(表4)

表4 治疗前后两组患者anti-TGAb、anti-TPOAb水平的比较
2.4 不良反应发生情况的比较
两组患者的不良反应以2级及以下为主,经过升高白细胞、升高血小板、抗过敏、止吐、保肝、护胃等对症治疗后均好转,不良反应较严重的患者通过调整PD-1抑制剂和化疗药物用量后均可耐受。两组患者骨髓抑制、皮疹、恶心呕吐、肝肾功能不全及治疗相关性肺炎的发生情况比较,差异均无统计学意义(P>0.05);联合组患者腹痛腹泻情况轻于对照组,差异有统计学意义(Z=7.223,P=0.027)。(表 5)
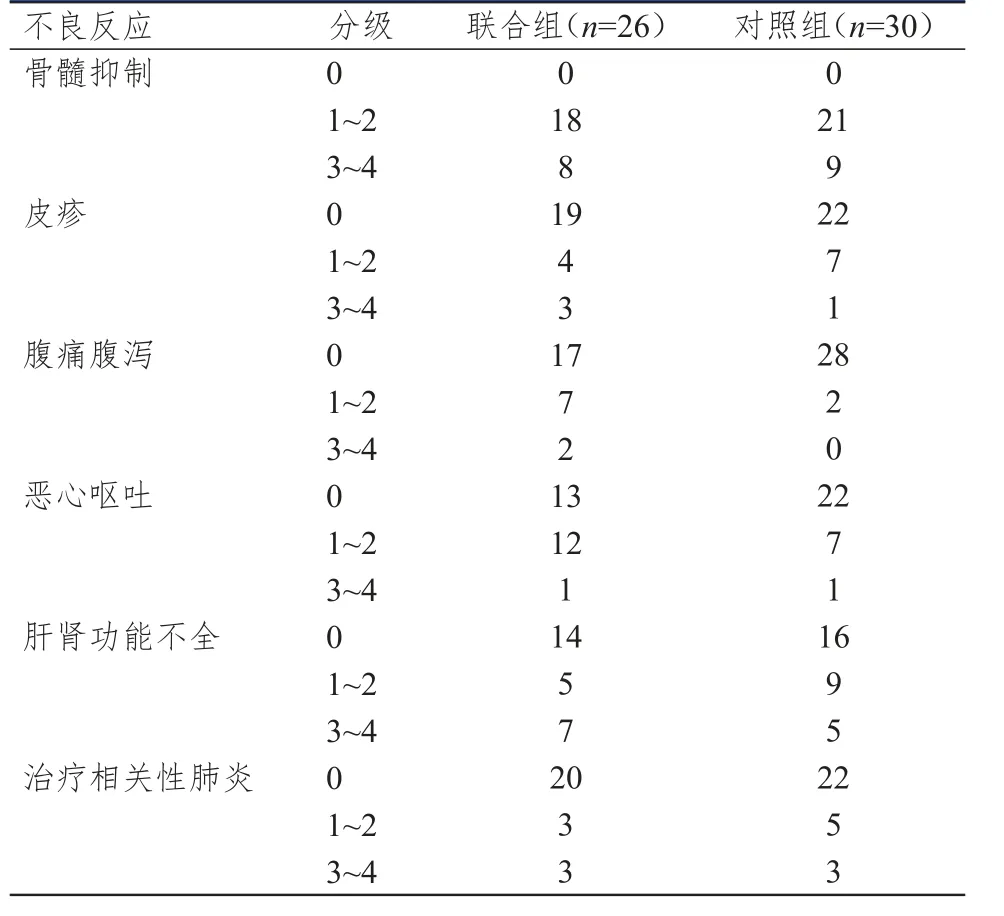
表5 两组患者的不良反应发生情况
3 讨论
肺癌具有发病率高、病死率高的特点,确诊后需及时采取手术、放疗、化疗等治疗[8]。早期NSCLC诊断困难,30%~40%的患者确诊时已发展至晚期,无法进行手术切除治疗,针对此类患者,主要采用化疗、靶向治疗等治疗方法[9]。临床常采用培美曲塞/多西他赛/吉西他滨/长春瑞滨+卡铂/顺铂/奈达铂全身化疗对肺癌进行治疗。研究表明,培美曲塞/多西他赛/吉西他滨/长春瑞滨+卡铂/顺铂/奈达铂全身化疗对NSCLC患者的治疗效果较为理想,但几乎所有化疗药物在杀伤肿瘤细胞的同时,也会损伤正常细胞,且当肿瘤已经扩散、转移时,化疗将失去作用,需采用其他方式辅助治疗[10]。近年来,免疫检查点抑制剂治疗已成为研究热点,研究显示,PD-1抑制剂治疗晚期NSCLC的疗效确切,能够延长患者的生存期,且耐受性良好[11-12]。本研究结果显示,联合组患者的ORR和DCR分别为42.31%和80.77%,分别高于对照组患者的26.67%、70.00%,表明PD-1抑制剂联合化疗治疗晚期NSCLC患者可取得较好的近期疗效,但两组患者的ORR和DCR比较,差异均无统计学意义(P>0.05),这与既往研究结果不一致[13],可能是由于本研究纳入的样本量较少,后续应加大样本量进行研究。
本研究结果显示,治疗后,联合组患者的TSH水平明显高于对照组,TT3、TT4、FT3、FT4水平均明显低于对照组,差异均有统计学意义(P<0.01)。表明PD-1抑制剂联合化疗治疗NSCLC可导致患者甲状腺功能减退。可能是因为化疗导致患者的甲状腺组织产生继发性免疫反应,抑制患者甲状腺组织的代偿性,从而导致甲状腺功能减退。本研究进一步比较治疗前后两组患者的自身免疫性甲状腺炎诊断指标anti-TGAb和anti-TPOAb,结果显示,治疗后两组患者的血清anti-TGAb、anti-TPOAb水平均高于本组治疗前,且联合组患者的血清anti-TGAb、anti-TPOAb水平均高于对照组,差异均有统计学意义(P<0.05)。表明甲状腺自身抗体可能参与了PD-1抑制剂导致的甲状腺炎的发生发展过程,这与Delivanis等[14]研究认为PD-1抑制剂影响T细胞、自然杀伤细胞相关通路,而与自身抗体无关不一致。另有研究报道,PD-1可导致甲状腺功能出现一定的异常,但不会成为患者的治疗障碍[15-16]。因此,后续应加大样本量,延长anti-TGAb、anti-TPOAb水平的监测时间。两组患者骨髓抑制、皮疹、恶心呕吐、肝肾功能不全及治疗相关性肺炎的发生情况比较,差异均无统计学意义(P>0.05);联合组患者腹痛腹泻情况轻于对照组(P<0.05);所有患者经过升高白细胞、升高血小板、抗过敏、止吐、保肝、护胃等对症治疗后均好转,不良反应较严重的患者通过调整PD-1抑制剂和化疗药物用量后均可耐受。表明PD-1免疫检查点抑制剂联合化疗治疗晚期NSCLC的不良反应可耐受。
综上所述,PD-1抑制剂联合化疗治疗晚期NSCLC的疗效显著,且不良反应可耐受,但其可能导致甲状腺功能减退和自身甲状腺相关抗体水平增加。因此在治疗过程中应注意监测患者甲状腺激素水平,避免产生全身性代谢异常综合征,从而最大程度地提高患者的远期生存率。
