食欲刺激素对乙酸致大鼠胃损伤的保护作用及机制
2022-04-13姜剑伟王贵彬张建军
袁 月,姜剑伟,唐 波,王贵彬,张建军
(中国医学科学院北京协和医学院药物研究所,新药作用机制研究与药效评价北京市重点实验室,北京 100050)
胃穿孔是胃溃疡最严重的病变阶段,该阶段的胃体组织被胃酸及胃蛋白酶腐蚀出现孔洞样损伤,造成胃内容物流出,从而诱发腹腔炎和全身炎症反应,继而可能引起中毒反应导致死亡。临床上主要通过给予质子泵抑制剂抑制胃酸分泌,同时配合抗炎药物和饮食结构的调理,从而间接促进胃体的自我修复,对于病情严重患者也会采取手术缝合,目前缺少直接促进胃损伤组织修复的药物[1]。
食欲刺激素(ghrelin)是一种胃源性含28个氨基酸的肽,最早发现于啮齿类动物和人类胃底组织,是生长素促分泌受体(growth hormone secretagogue receptor,GHS-R)的内源性配体。生物体内的食欲刺激素有酰化和未酰化2种存在形式,目前研究较多的是酰化食欲刺激素的生理活性[2]。酰化食欲刺激素作用于中枢神经系统的GHS-R,能剂量依赖性地促进生长激素的释放及胃肠蠕动和摄食行为的发生[3]。除调节正常生理活动外,食欲刺激素还有众多病理保护作用。动物实验表明,食欲刺激素对缺血引起的大脑[4]、心[5]和肾[6]等的组织损伤有显著保护作用,同时还具有十分显著的抗炎作用,对脓毒症引起的大鼠肺损伤有较好的保护作用[7]。此外食欲刺激素不仅对乙醇诱导的急性胃损伤具有保护作用[8],还能促进乙酸诱导的大鼠胃溃疡和十二指肠溃疡的愈合和恢复[9],但其机制尚未完全阐明。
本实验室前期实验表明,通过浆膜下注射乙酸诱发大鼠胃穿孔样损伤模型,连续ip给予食欲刺激素30 μg·kg-1能够有效促进乙酸诱导的大鼠胃溃疡的愈合,本研究通过系统性观察食欲刺激素对乙酸致大鼠慢性胃溃疡愈合过程的作用,检测其对大鼠胃组织损伤修复过程中炎症因子和促血管生成因子的影响,探究其对乙酸诱导的大鼠胃损伤修复作用的机制。
1 材料与方法
1.1 动物、试剂和仪器
雄性Wistar大鼠,体重为200~220 g,采购自斯贝福生物技术有限公司,许可证号:SCXK(京)2019-0010,动物合格证号:110324201102363727。实验期间(除手术造模时间外)动物饲养于含有柔软木屑的鼠笼,标准饲料喂养,饮水自由,室温恒定(21~23℃),湿度为20%~25%,12 h昼夜交替。本动物实验获中国医学科学院药物研究所伦理委员会批准。
重组大鼠O-酰基化食欲刺激素(AS-24160,美国AnaSpec有限公司),使用时溶于注射用生理盐水;免疫组化高效试剂盒(abs957,美国Absin公司);RIPA裂解液(P0013B,碧云天生物技术研究所);蛋白浓度测定试剂盒(CW0014S,康为世纪生物技术有限公司);山羊抗大鼠诱导型NO合酶(inductible NO synthase,iNOS)多抗(MAB9502)、山羊抗兔内皮型NO合酶(endothelial NO synthase,eNOS)多抗(NB300-500)和山羊抗兔增殖核抗原(prolif-erating cell nuclear antigen,PCNA)多抗(P12004)以及白细胞介素1β(IL-1β)(RLB00)、肿瘤坏死因子 α(tumor necrosis factor-α,TNF-α)(RTA00)和血管内皮生长因子(vascular endothelial growth factor,VEGF)(RRV00)ELISA试剂盒均购于美国R&D System;NO合酶(NO synthase,NOS)活性检测试剂盒(A014-1-2,南京建成生物试剂有限公司);5×上样缓冲液和ECL超敏显色剂(P1010-500)购于北京普利莱基因技术有限公司;山羊抗大鼠β肌动蛋白抗体(北京博奥锐京公司);辣根过氧化酶标记山羊抗兔IgG抗体(中山金桥公司);辣根过氧化酶标记山羊抗大鼠IgG抗体(SA00001-1,美国 proteintech 公司);NaCl,KCl,Na2HPO4·12H2O和KH2PO4购于北京国药集团化学试剂有限公司。
3-18 KS低温高速离心机(德国Sigma公司);MQX 200酶标仪(美国BioTek公司);JY96II超声波细胞粉碎机(宁波新芝生物科技股份有限公司);Image Quant LAS 4000化学发光成像分析仪(美国GE公司);DYY7C电泳仪(北京六一仪器厂);手动转轮式切片机(莱卡生物有限公司)。
1.2 大鼠胃损伤模型的制备、分组和处理
24只Wistar大鼠禁食不禁水24 h后开始造模,2%戊巴比妥钠(50 mg·kg-1,ip)进行麻醉,在大鼠剑突下约1 cm位置,沿剑突方向纵向打开腹腔,开口约1 cm,直镊将大鼠腺胃部分小心夹出,用微量注射器向浆膜下注射30 μL乙酸后将胃体小心送回,注射处形成清亮凸起,且针头旋出后无明显乙酸漏液即造模成功。手术缝合伤口,伤口周围涂抹少许青霉素粉剂。假手术组12只大鼠只打开腹腔后缝合,不进行乙酸注射。术后第2天造模成功大鼠随机分成模型组和模型+食欲刺激素30 μg·kg-1组(ip,每日2次),假手术组和模型组ip给予同体积生理盐水,每天9∶00 am称量大鼠体重和进食量。分别在给药第3,6和9天后(D3,D6和D9),从各组随机选择4只,5%水合氯醛麻醉(50 mg·kg-1,ip)后摘眼球取血,置含肝素钠EP管中,室温静置30 min后1000×g离心15 min,取血浆4℃保存。随后打开大鼠腹腔,剪断贲门和幽门后将胃体完整取出,沿胃大弯将胃体剪开,在生理盐水中涮洗冲净,大头针固定胃组织,在受损组织旁置25 mm2正方形纸片,拍照记录,统计溃疡面积与正方形纸片面积比值。根据溃疡创口面积,分别用直径为32,16和8 mm的圆孔取材器,以溃疡处为中心等面积取材,假手术组取相同位置处胃组织。ELISA检测血浆IL-1β含量,NOS试剂盒检测血浆iNOS活性。取出的胃组织一部分置于4%多聚甲醛中固定,用于免疫组化染色观察PCNA阳性细胞比例,另一部分用于ELISA测定组织中炎症因子TNF-α和IL-1β及Western印迹法测定iNOS和eNOS蛋白表达。
1.3 免疫组化染色法检测胃溃疡周围黏膜组织中PCNA阳性细胞比例
取1.2分组处理获得的胃溃疡周围组织浸泡于4%多聚甲醛中固定,每天更换一次多聚甲醛溶液,石蜡包埋,切片机切片(6 μm厚),按试剂盒说明书进行免疫组化实验。显微镜目镜放大倍数10,物镜20倍下观察染色结果,采用DSCapture成像软件拍照记录(曝光时间61 ms,增益4,伽马0),根据染色细胞情况定性判定PCNA阳性细胞比例。
1.4 NOS试剂盒检测血浆中iNOS活性
1.2分组处理大鼠的血浆,PBS稀释2倍后,每孔100 μL置于96孔板中,按NOS检测试剂盒说明书进行操作,酶标仪530 nm测定吸光度(A530nm),根据说明书方法计算血浆中iNOS活性。
1.5 ELlSA测定血浆中lL-1 β及胃溃疡组织匀浆中TNF- α,lL-1 β和VEGF含量
1.2分组处理大鼠的血浆,PBS稀释5倍后,按ELISA试剂盒说明操作检测IL-1β含量。取溃疡周围胃组织,按照组织(mg)∶PBS(μL)=1∶10的比例在大鼠胃溃疡周围组织块中加入预冷PBS,用眼科小剪将组织剪成碎块,然后在冰上用组织匀浆机进行破碎制成10%组织匀浆,5000×g,4℃离心15 min,取上清,BCA法测定上清中总蛋白含量。将上清用PBS分别稀释为1×,5×,10×溶液,按试剂盒说明书分别检测TNF-α,IL-1β和VEGF含量。
1.6 Western印迹法检测胃溃疡周围组织中iNOS和eNOS蛋白表达
1.2分组处理大鼠的胃溃疡周围组织按1∶10(m∶V)加含有蛋白酶抑制剂和磷酸酶抑制剂的RIPA强裂解液,于冰上用剪刀将组织剪碎,匀浆后超声破碎,静置30 min,12 000×g,4℃离心20 min,取上清。BCA法测定蛋白质浓度,用裂解液将蛋白终浓度稀释至8 g·L-1,加1/4体积的5×缓冲液后,98℃处理5 min,冷却至室温后分装,每孔分别取40 μg蛋白质样品上样,用10%SDS聚丙烯酰胺凝胶电泳分离蛋白,电转移至PVDF膜上,5%脱脂牛奶室温封闭1 h后,分别用一抗(抗iNOS 1∶200;抗eNOS 1∶500)4℃摇床孵育过夜,辣根过氧化酶标记二抗(1∶5000)室温孵育1 h,采用 ECL显色液显色。通过Image J软件对蛋白条带的积分吸光度进行分析,以大鼠胃溃疡周围组织中目的蛋白(iNOS和eNOS)与内参蛋白积分吸光度值的比值表示目标蛋白表达水平。
1.7 统计学分析
实验结果数据用±s表示,采用Photoshop像素比值统计溃疡面积,GraphPad Prism 8.0统计生化指标数据,不同组间比较采用two way-ANOVA分析处理,P<0.05表示差异有统计学意义。
2 结果
2.1 外源性食欲刺激素对乙酸致胃损伤大鼠体重和摄食量的影响
造模后D1~D9,假手术组大鼠体重从(222.8±2.7)g上升至(307.3±1.6)g,模型组大鼠从(217.6±3.3)g上升至(288.0±2.1)g,模型+食欲刺激素组从(216.5±2.4)g上升至(295.0±1.9)g。在同一天中,各组间无显著性差异(图1A)。

Fig.1 Effect of ghrelin on body mass(A)and food intake(B)of rats with gastric injury induced by acetic acid.Wistar rats were microinjected with 30 μL acetic acid into the gastric membrane to establish a model before being randomly separated into the model and model+ghrelin group.The abdomens of rats in the sham group were opened and sutured without gastric ulcer induction.After operation,rats in the model+ghrelin group were given continuous intraperitoneal injection of ghrelin(30 μg·kg-1,twice per day),while the model and sham groups were given the same amount of saline.Body mass and food intake were measured everyday on 9∶00 am from one day before model induction(D-1).±s,n=4.*P<0.05,compared with the sham group;#P<0.05,compared with the model group.
手术造模前各组大鼠日均摄食量相近。造模后D2~D5,模型+食欲刺激素组大鼠日均摄食量显著高于模型组和假手术组(P<0.05),而在造模后D7~D9假手术组日均摄食量最高,但在造模后的整个实验期间,模型+食欲刺激素组大鼠日均摄食量整体高于模型组(图1B)。
2.2 外源性食欲刺激素对乙酸致大鼠胃溃疡的促愈合作用
胃展开观察结果显示(图2),假手术组大鼠胃组织健康完整,模型组大鼠D3胃组织可见穿孔样胃溃疡,D6溃疡处基底组织基本形成,但溃疡面积未见缩小,D9溃疡创口面积开始缩小。模型+食欲刺激素组D3大鼠胃组织可见明显凹陷状胃溃疡,但溃疡处基底组织已形成。模型+食欲刺激素组大鼠胃溃疡面积相对于同一时间点模型组均显著缩小(D6,P<0.05;D9,P<0.01),D9胃溃疡基本痊愈。

Fig.2 Effect of ghrelin on healing of gastric ulcer induced by acetic acid.See Fig.1 for the rat treatment.Rat gastrics in each group were taken out and unfolded after 3,6 and 9 d of saline or ghrelin administration(D3,D6 and D9).A:tissue morphology of rat stomach;B:statistical analysis of ulcer areas.±s,n=4.*P<0.05,**P<0.01,compared with the model group on the same day.
2.3 外源性食欲刺激素对胃溃疡周围黏膜组织中PCNA阳性细胞数的影响
免疫组化染色结果显示(图3),假手术组大鼠胃黏膜组织细胞连接紧密,并均匀分布少量PCNA阳性细胞。模型组大鼠D3胃黏膜组织黏膜形态疏松,无PCNA阳性细胞,D6靠近基底组织附近的黏膜出现较多PCNA阳性细胞,D9 PCNA阳性细胞数进一步增加,但黏膜层细胞形态仍较为疏松。模型+食欲刺激素组大鼠D3胃黏膜靠近基底层出现较多PCNA阳性细胞,D6 PCNA阳性细胞数进一步增加,且集中于黏膜表层,D9 PCNA阳性细胞数继续增加,胃黏膜细胞排列均匀。在整个实验期间,模型+食欲刺激素组PCNA阳性细胞比例整体水平高于同时间模型组。

Fig.3 Effect of ghrelin on proliferating cell nuclear antigen(PCNA)positive cells in gastric mucosa of rats with gastric injury induced by acetic acid.See Fig.1 for the rat treatment and Fig.2 for the taking out of rat gastrics.Margin of gastric ulcer was taken via round-hole sampling instrument.Arrows show PCNA positive cells.
2.4 外源性食欲刺激素对模型大鼠血浆中lL-1 β含量和iNOS活性的影响
ELISA检测结果显示(图4A),假手术组大鼠血浆中IL-1β含量在整个实验期间保持较低水平(<100 ng·L-1),D3和D6模型组大鼠血浆中IL-1β含量(>300 ng·L-1)显著高于假手术组(P<0.01)。模型+食欲刺激素组大鼠D3和D6血浆中IL-1β含量与同时间模型组相比显著降低(P<0.01)。各组大鼠D9血浆中IL-1β含量无显著差异。
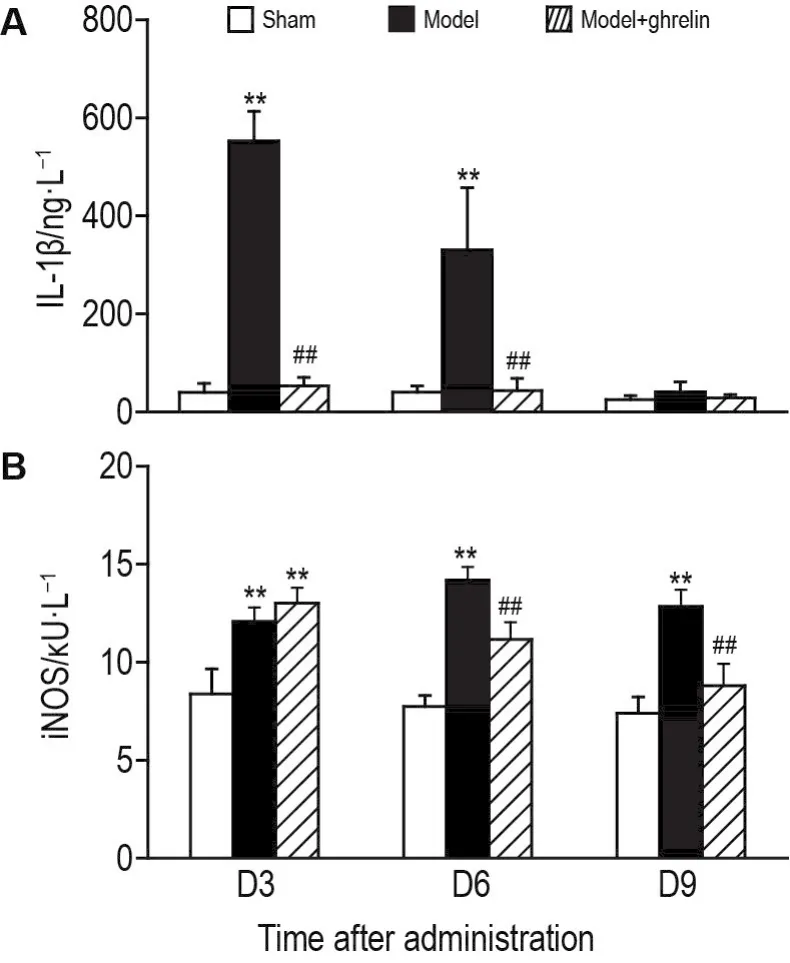
Fig.4 Effect of ghrelin on interleukin-1 β (lL-1 β) concentration(A)and inducible NO synthase(iNOS)activity(B)in rat plasma via ELlSA and nitric oxide synthase(NOS)kits,respectively.See Fig.1 for the rat treatment.Rat plasma was collected 3,6 and 9 d after administration(D3,D6,D9)in each group.x±s,n=4.**P<0.01,compared with the sham group on the same day;##P<0.01,compared with the model group on the same day.
NOS活性测定结果表明(图4B),在整个实验期间,模型组大鼠血浆iNOS活性均显著高于假手术组(P<0.01)。虽观察到D3模型组与模型+食欲刺激素组大鼠血浆中iNOS活性水平无差异,但D6和D9模型+食欲刺激素组大鼠血浆iNOS活性显著性降低(P<0.01)。
2.5 外源性食欲刺激素对大鼠胃溃疡周围组织中lL-1 β,TNF- α和VEGF含量及iNOS和eNOS蛋白表达水平的影响
ELISA检测结果表明(图5),与假手术组相比,模型组大鼠胃溃疡周围组织中IL-1β(>300 ng·g-1)和TNF-α(>100 ng·g-1)含量均显著增加(D3和D6,P<0.01),VEGF含量显著降低(D3,D6和D9,P<0.01)。与模型组相比,模型+食欲刺激素组大鼠损伤周围胃组织中IL-1β含量显著降低(D3和D6,P<0.01)。TNF-α变化趋势与IL-1β相似,相比于同时间模型组,模型+食欲刺激素组大鼠溃疡周围胃组织中TNF-α含量同样显著下降(D3和D6,P<0.01);D9各组大鼠受损胃组织中IL-1β和TNF-α含量无显著差异。与模型组相比,模型+食欲刺激素组大鼠胃溃疡周围组织中VEGF含量在整个实验期间显著增加(P<0.01)。

Fig.5 Effect of ghrelin on content of lL-1 β(A),tumornecrosis factor- α(TNF- α)(B)and vascular endothelial growth factor(VEGF)(C)in lesion areas via ELlSA.See Fig.1 for the rat treatment and Fig.2 for collection of rat gastrics.±s,n=4.*P<0.05,**P<0.01,compared with the sham group on the same day;#P<0.05,##P<0.01,compared with the model group on the same day.
Western印迹结果显示(图6),与假手术组相比,模型组胃溃疡周围胃组织中iNOS蛋白表达水平在整个实验期间显著增加(P<0.01),eNOS表达水平先显著降低(D3,P<0.05),后显著增加(D9,P<0.01)。与模型组相比,模型+食欲刺激素组大鼠受损部位周围胃组织中iNOS蛋白表达水平显著降低(D3,P<0.01;D6,P<0.05;D9,P<0.01),eNOS蛋白表达水平先提高(D3,P<0.01),后降低(D9,P<0.01),达到假手术组同水平。D6各组大鼠溃疡周围胃组织中eNOS蛋白表达水平无显著差异。

Fig.6 Effect of ghrelin on protein levels of iNOS(A)and endothelial NO synthase(eNOS)(B)in lesion area via Western blotting.See Fig.1 for the rat treatment and Fig.2 for collection of rat gastrics.A2 and B2 were the semiquantitative results of A1 and B1,respectively.±s,n=4.*P<0.05,**P<0.01,compared with the sham group on the same day;#P<0.05,##P<0.01,compared with the model group on the same day.
3 讨论
本研究结果表明,外源性食欲刺激素能够增加模型大鼠的摄食量,促进乙酸诱导的大鼠胃损伤的修复,组织层面表现为促进溃疡处新生基底组织的形成,加速创口面积缩小;分子层面表现为一定程度抑制血浆及溃疡周围组织中IL-1β/iNOS通路和一定程度上促进溃疡周围胃组织中VEGF/eNOS通路。
当胃组织发生穿孔样损伤时,免疫炎症因子IL-1β能够通过激活巨噬细胞、单核细胞以及平滑肌细胞的NF-κB从而激活iNOS表达,iNOS表达的适度增加能够增加创口处血流量,减少细菌附着,减轻炎症反应,有利于胃溃疡组织营养供给以及创伤修复[10]。但过量iNOS催化底物精氨酸生成大量NO,产生细胞毒效应,促进细胞凋亡[11]。因此IL-1β/iNOS的表达对创伤的恢复具有双向性,创伤早期的IL-1β/iNOS表达增加有利于创伤组织的修复[12],而创伤后期IL-1β/iNOS的持续高表达则不利于损伤修复[13]。VEGF是一种高度特异性的促进血管内皮生长的细胞因子,其与eNOS对胃溃疡受损组织中内皮细胞的迁移、增殖和新生血管形成有重要促进作用[14]。体外实验表明,VEGF对血管新生的促进作用有赖于eNOS的表达[15];动物实验也表明,外源性VEGF对eNOS基因敲除小鼠的促创口愈合作用较弱[16],可见该通路对胃溃疡的愈合也可能有重要作用。
本研究结果显示,大鼠胃浆膜下注射乙酸会引起大鼠胃部出现穿孔样损伤,在胃溃疡中前期(D3和D6),模型组大鼠血浆和溃疡周围胃组织中炎症因子IL-1β和TNF-α含量显著增加,且大鼠血浆中iNOS活性以及溃疡周围胃组织中iNOS表达在整个实验期间维持在较高水平,提示造模引起了胃穿孔,诱发了局部以及整个机体发生剧烈的炎症反应,而iNOS作为炎症因子的下游通路之一可能对胃溃疡的修复有重要影响。外源性食欲刺激素能够在整个实验期间有效降低模型+食欲刺激素组大鼠血浆中IL-1β和胃溃疡周围胃组织中IL-1β和TNF-α含量,减轻胃溃疡局部以及机体的炎症反应。相比模型组,模型+食欲刺激素组大鼠D6血浆中iNOS活性降低,并在整个溃疡期间降低胃溃疡周围组织中iNOS蛋白的过表达。表明食欲刺激素能够通过降低炎症因子的过表达,并在在一定程度上抑制iNOS的表达和活性,在抑制细菌增殖的同时,不会过度影响血小板的黏附以及创口愈合。此外,模型组大鼠在整个胃溃疡期间溃疡周围胃组织中VEGF含量维持低水平,D3胃溃疡周围组织中eNOS表达显著降低,提示模型组大鼠溃疡周围组织中促组织修复因子整体表达水平较低。食欲刺激素能够显著促进模型+食欲刺激素组大鼠胃溃疡周围组织中VEGF的表达,同时在造模前期(D3)促进损伤组织中eNOS蛋白表达,表明食欲刺激素可能在造模前期通过促进VEGF/eNOS通路,加速胃溃疡处组织血管新生以及组织愈合。
由此可见,外源性食欲刺激素对乙酸致大鼠慢性胃损伤有显著促修复作用,其作用机制可能与之对IL-1β/iNOS炎性通路的抑制和对VEGF/eNOS通路的促进有关,通过抑制炎症因子过表达,调节NO合成酶的稳态表达,加速胃溃疡早期损伤周围组织血管新生,促进胃溃疡组织的愈合。因此,作为一种内源性活性肽,食欲刺激素在胃保护作用领域具有较好的应用前景。
