在体记录清醒小鼠丘脑网状核场电位多通道电生理技术平台的建立和验证
2022-04-13姚云霞张树卓苏瑞斌李明媛
姚云霞,张树卓,苏瑞斌,李明媛
(1.天津科技大学生物工程学院,天津市透明质酸应用研究企业重点实验室,天津 300457;2.军事科学院军事医学研究院毒物药物研究所,抗毒药物与毒理学国家重点实验室,神经精神药理学北京市重点实验室,北京 100850)
神经元节律性活动,即振荡,是大脑功能的基本特征,也是神经元集合之间交流的重要手段[1],其中γ振荡是维持大脑中长距离通讯的神经振荡,频率在30~80 Hz之间,参与多种认知过程,如选择性注意[2]、感觉刺激特征的绑定[3]和记忆[4]等。γ振荡主要由小清蛋白(parvalbumin,PV)中间神经元通过突触与锥体神经元共同构成神经网络活动时产生。θ振荡(4~7 Hz)与γ振荡间存在相位耦合[5-6]。Klausberger等[7]研究表明,海马PV中间神经元的一些放电活动与θ振荡高度相关。Yao等[8]研究表明,小鼠前额叶皮质在活跃觉醒状态下频繁出现θ振荡,并伴随γ振荡和高频节律。此外,40 Hz和8 Hz嵌套的光遗传刺激内侧前额叶PV中间神经元可以正向调节社会行为[9]。神经精神类疾病常伴随有γ振荡紊乱,如精神分裂症[10]和自闭症谱系障碍患者[11-12]中可见感觉诱发的γ功率降低;抑郁症[13-14]和阿尔茨海默病患者[15-17]亦存在γ振荡功率谱变化,前者γ振荡功率降低,后者γ振荡功率升高,提示γ振荡可能是多种精神类疾病潜在的共同特征。探讨不同脑区γ振荡的变化在脑进行信息整合和执行认知时发挥的作用,有助于其成为研究精神疾病病因和病理生理学的一个有价值的工具。
由于丘脑网状核(thalamic reticular nucleus,TRN)是γ-氨基丁酸(γ-aminobutyric acid,GABA)能神经元富集的核团,且富含GABA A型受体(GABA type A receptor,GABAAR)的表达,类似于“闸门”一样,整合和调控丘脑皮质之间的信息传递,似贝壳状覆盖于丘脑前外侧部[18],参与感觉处理、选择性注意和睡眠[19-20],对认知功能至关重要。目前,国内外研究集中于大鼠的前额叶皮质[21]和海马脑区[22],采用离体脑片[23]和麻醉急性在体[24]记录等方法研究γ振荡,但在清醒自由活动小鼠,特别是TRN脑区进行γ振荡的研究未见报道。GABAAR拮抗剂荷包牡丹碱(bicuculline)能阻断由电和化学刺激所诱导的γ振荡[25]。因此,本研究在小鼠TRN脑区植入记录电极,应用在体多通道技术,建立清醒自由活动小鼠TRN脑区场电位γ和θ振荡记录平台,用工具药荷包牡丹碱对清醒自由活动小鼠TRN脑区γ和θ振荡进行验证。同时,利用T型钙通道拮抗剂TTAA2〔(R)-2-(4-cyclopropylphenyl)-N-(1-(5-(2,2,2-trifluoroethoxy)pyridin-2-yl)ethyl)acetamide〕进一步探究参与维持γ和θ振荡的机制,以期为揭示神经精神疾病分子机制及新药研发提供实验手段。
1 材料与方法
1.1 动物、药物、试剂和仪器
SPF级C57BL/6J雄性小鼠,20~22 g,购自北京华阜康生物科技股份有限公司,实验动物许可证号:SCXK(京)2019-0008,所有实验小鼠均常规饲养于24℃环境中,12 h/12 h昼夜交替,自由饮水和进食。实验动物的使用遵循军事科学院军事医学研究院动物管理细则。
荷包牡丹碱(批号:S70107),美国Selleck公司;TTA-A2,上海陶素生化科技有限公司。戊巴比妥钠(批号:140828),国药集团化学试剂有限公司;0.9%生理盐水(批号:2106223201),石家庄四药集团有限公司;3%双氧水(批号:200918),山东利尔康医疗科技股份有限公司;4%多聚甲醛(批号:BL539A),北京兰杰柯科技有限公司;OTC包埋液(批号:oct 4583),德国Leica公司;红霉素眼膏(批号:H44023088),广州白云山药业;生物胶(Kwik-sil),美国WPI公司;尼氏染色剂焦油紫(批号:33410),美国MedChem Express公司;多聚赖氨酸防脱片(批号:ZLI-9802),南通海伦生物医学器材制造有限公司;中性树脂封片剂(批号:abs9177),爱必信生物科技有限公司。微操纵器、多通道电生理记录系统、Offline Sorter和NeuroExplore软件,美国Plexon公司;体视解剖显微镜、颅骨钻、立体定位仪和气体麻醉机,瑞沃德生命科技公司;蠕动泵(型号:BT300-lF),保定兰格恒流泵有限公司;冰冻切片机(型号:1950),德国Leica公司;荧光显微镜(型号:U-REF-T)和激光共聚焦显微镜(型号:FV3000),日本奥林巴斯公司;16通道电极,苏州科斗公司;颅钉,瑞沃德生命科技公司;牙科水泥、小鼠血管夹及常规手术器械及用品若干。
1.2 小鼠记录电极的植入
1%戊巴比妥钠溶液60 mg·kg-1(ip)麻醉小鼠,5 min后夹小鼠后趾或尾部无疼痛反应等现象即可进行开窗植入电极手术。剃除小鼠颅顶两耳连线及两眼连线间的毛发,暴露颅面皮肤,将小鼠固定于脑立体定位仪并使用碘伏进行消毒,眼部涂抹红霉素眼膏,保护视力免受损伤。使用手术刀划开颅骨顶部皮肤,用棉签蘸取3%双氧水清洁颅骨表面,凸显骨缝及标志点。用小鼠血管夹分别夹取两边划开的皮肤,上翻至旁边使其形成一个凹槽便于储存生理盐水,防止骨面干燥损伤脑组织。为了保证定位准确,利用立体定位仪测量前囟(bregma)后囟(lambda)的水平高度以及左右脑水平高度,并进行调平。在小鼠颅骨表面植入2~3颗颅钉(直径1.20 mm,长2.00 mm)用于电极固定、地线缠绕和信号记录。根据第三版小鼠脑图谱定位TRN(前囟前后0.70 mm,旁开左右1.42 mm,颅骨表面以下3.25~3.50 mm),记号笔标记,并以其为中心用颅骨钻在周围开一个长、宽各2.00 mm的窗口,暴露蛛网膜,自制小针头(图1)挑破硬脑膜后用精细镊撕开窗口的硬脑膜。清洁目标脑区上皮质表面后开始电极植入操作。首先将电极移至目标脑区皮质表面上方后进行地线缠绕,而后通过自动微操纵器按50~100 μm·min-1的速度缓慢将电极植入大脑。待电极进入皮质后,在电极周边滴加生理盐水溶解包裹在电极周围的聚乙二醇(polyethylene glycol,PEG),同时可保持暴露脑区湿润。随后利用生物胶覆盖大脑暴露区域,静待10~15 min后,用牙科水泥固定裸露的电极丝。待牙科水泥完全干后用生理盐水继续溶解剩余的包裹电极的PEG。最后吸干水分,利用牙科水泥对整个电极进行固定。术后,小鼠置饲养笼中进行单独饲养,恢复期间,每日抓取小鼠进行抚触2~3 min,并进行电极抓持模拟操作,使其适应探头(headstage)插拔动作。术后恢复1周,进行在体神经信号数据采集。电极植入手术过程如图1A和B,图1C为在体电极记录设置示意图。
1.3 电生理信号的采集和处理
将术后小鼠提前1~3 d转移至实验室,并每天置记录箱(锡纸包裹)30 min适应环境。实验前后轻抚小鼠5 min以减少应激反应。记录前将小鼠置气体麻醉机,用2%异氟烷诱导麻醉5 min,气体流速0.5 L·min-1。麻醉后将探头插到小鼠电极上,将其置活动箱自由活动。前期小鼠适应环境,同时将不必要的仪器断电,排除噪声和50 Hz工频的干扰。小鼠原始信号和场电位分别以40 kHz和1 kHz采样频率进行采样,通过多级放大以及数模转换将信号传输至计算机,用Plexon在体多通道记录系统采集信号。待信号稳定后记录基线30 min,结束后ip给予荷包牡丹碱(2.5 mg·kg-1)(n=4)或 TTA-A2(1.0 mg·kg-1)(n=6),记录信号30 min。
将采集到的信号用Offline Sorter进行预处理。该软件一般用于处理Plexon记录系统采集得到的原始数据,对原始数据进行1~100 Hz带通滤波处理得到低频的场电位,有交互式的可视化界面。再将其转移至NeuroExplore进行进一步滤波。滤波器用于提取感兴趣的振荡信号。由于γ和θ振荡均在低频范围内,所以采取了低通Butterworth滤波器,阶数为3,通过带通滤波提取γ和θ振荡。
1.4 记录电极位置的验证
1.4.1 灌流取脑
实验结束后,蠕动泵一端连接置碎冰上4℃预冷的生理盐水或4%多聚甲醛固定液,一端连接静脉输液针用于小鼠心脏灌流。1%戊巴比妥钠溶液按60 mg·kg-1(ip)麻醉小鼠,将其仰卧位置于自制泡沫板上并固定四肢,U字形剪开皮肤、肌肉直至两腋下,剪开肋骨、膈肌,止血钳夹持剑突连带胸腔向上翻固定,充分暴露心脏;小心去除心包,针尖轻轻插入左心室心尖,剪开右心耳后用生理盐水快速置换出脑组织中的血液;待右心耳流出液体澄清透亮后更换4%多聚甲醛继续灌流用于固定。在灌注多聚甲醛过程中可见小鼠四肢抽搐、尾巴摆动或翘起,灌流结束后小鼠内脏鼓起、四肢肌肉僵硬,即可认为灌注成功。将小鼠处死后置冰上,剪开后颈皮肤,小心抠除颅骨表面的电极(勿破坏脑组织和电极轨迹),而后取出完整的脑组织置4%多聚甲醛中4℃冰箱保存。
1.4.2 冰冻切片
将上述脑组织置于30%蔗糖溶液中脱水,待沉底后置样本托上,用OTC胶包埋后转移至-20℃预冷30~60 min的冰冻切片机中,待包埋剂完全凝固后将完整的TRN部分切成厚30 μm冠状切片,将脑片贴于黏附性载玻片上,自然风干后于-20℃冰箱保存。
1.4.3 尼氏染色
将切片从冰箱取出置室温平衡10 min,1×PBS缓冲液漂洗3次,每次5 min;80%乙醇浸洗2次,每次30 s;0.1%焦油紫染液染色30 s,蒸馏水冲洗多余的染色剂;80%乙醇浸洗30 s、90%乙醇浸洗30 s、无水乙醇浸洗30 s梯度脱水;二甲苯透明2次,每次5 min;中性树胶封片。待封片剂完全干后于显微镜下观察电极轨迹,扫描拍片。
1.5 统计学分析
实验结果数据以±s表示。应用GraphPad Prism 8.0.2统计软件,利用配对t检验比较同一通道给药前后场电位功率谱密度。P<0.05认为差异有统计学意义。
2 结果
2.1 荷包牡丹碱降低丘脑网状核场电位 γ振荡的功率谱
小鼠植入记录电极恢复1周后记录清醒自由活动小鼠TRN脑区场电位,经滤波分析观察到γ和θ振荡(图2A1和B1),随后用GABAAR拮抗剂荷包牡丹碱进一步验证(图2A2和B2)。与基线相比,荷包牡丹碱(2.25 mg·kg-1)显著减少γ振荡(30~80 Hz和 35~45 Hz)的功率谱(图3A 和 B,P<0.05,P<0.01),θ振荡(4~7 Hz)功率谱未见明显改变(图3C)。

Fig.2 γ and θ oscillations recorded in TRN of freely moving mice.A:example of local field potential(LFP)(black line)and γ oscillation(blue line)recorded in the TRN before(A1)and after(A2)intraperitoneal injection of bicuculline(2.25 mg·kg-1);B:example of LFP(black line)and θ oscillation(blue line)recorded in the TRN before(B1)and after(B2)intraperitoneal injection of bicuculline.
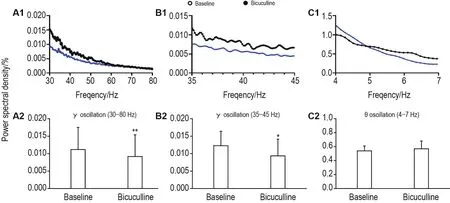
Fig.3 Bicuculline reduced γ oscillation power spectrum in TRN of freely moving mice.A1,B1 and C1:the power spectral density of γ oscillations(30-80 Hz and 35-45 Hz)and θ oscillation(4-7 Hz)in TRN before(baseline)and after intraperitoneal injection of bicuculline(2.25 mg·kg-1)for 30 min;A2,B2 and C2:the resluts of statistical analysis of A1,B1 and C1,respectively.±s,n=4.*P<0.05,**P<0.01,compared with corresponding baseline.
2.2 TTA-A2降低丘脑网状核场电位 γ和 θ振荡的功率谱
与基线相比,TTA-A2(1.0 mg·kg-1)降低γ和θ振荡的功率谱(P<0.01,图4和5),与文献[26]报道一致;而且小鼠脑中低频信号能量高,高频信号能量低,亦符合小鼠体内生物节律信息。

Fig.4 Effect of TTA-A2 on γ and θ oscillations in TRN of freely moving mice.A:example of LFP(black line)and γ oscillation(blue line)recorded in the TRN before(A1)and after(A2)intraperitoneal injection of T-type calcium channel antagonist(R)-2-(4-cyclopropylphenyl)-N-(1-(5-(2,2,2-trifluoroethoxy)pyridin-2-yl)ethyl)acetamide(TTA-A2)(1.0 mg·kg-1);B:example of LFP(black line)and θ oscillation(blue line)recorded in the TRN before(B1)and after(B2)intraperitoneal injection of TTA-A2.

Fig.5 TTA-A2 reduced γ and θ oscillations power spectrum in TRN of freely moving mice.A1,B1 and C1:the power spectral density of the γ oscillations(30-80 Hz and 35-45 Hz)and θ oscillation(4-7 Hz)in TRN before(baseline)and after intraperitoneal injection of TTA-A2(1.0 mg·kg-1)for 30 min;A2,B2 and C2:the resluts of statistical analysis of A1,B1 and C1,respectively.±s,n=6.**P<0.01,compared with corresponding baseline.
2.3 记录电极位置的确定
如图6所示,电信号记录实验结束后,经尼氏染色观察脑组织尼氏体,TRN处可见清晰的电极轨迹,电极尖端处于目标脑区(红星标记部位),证明电极埋植位置正确。
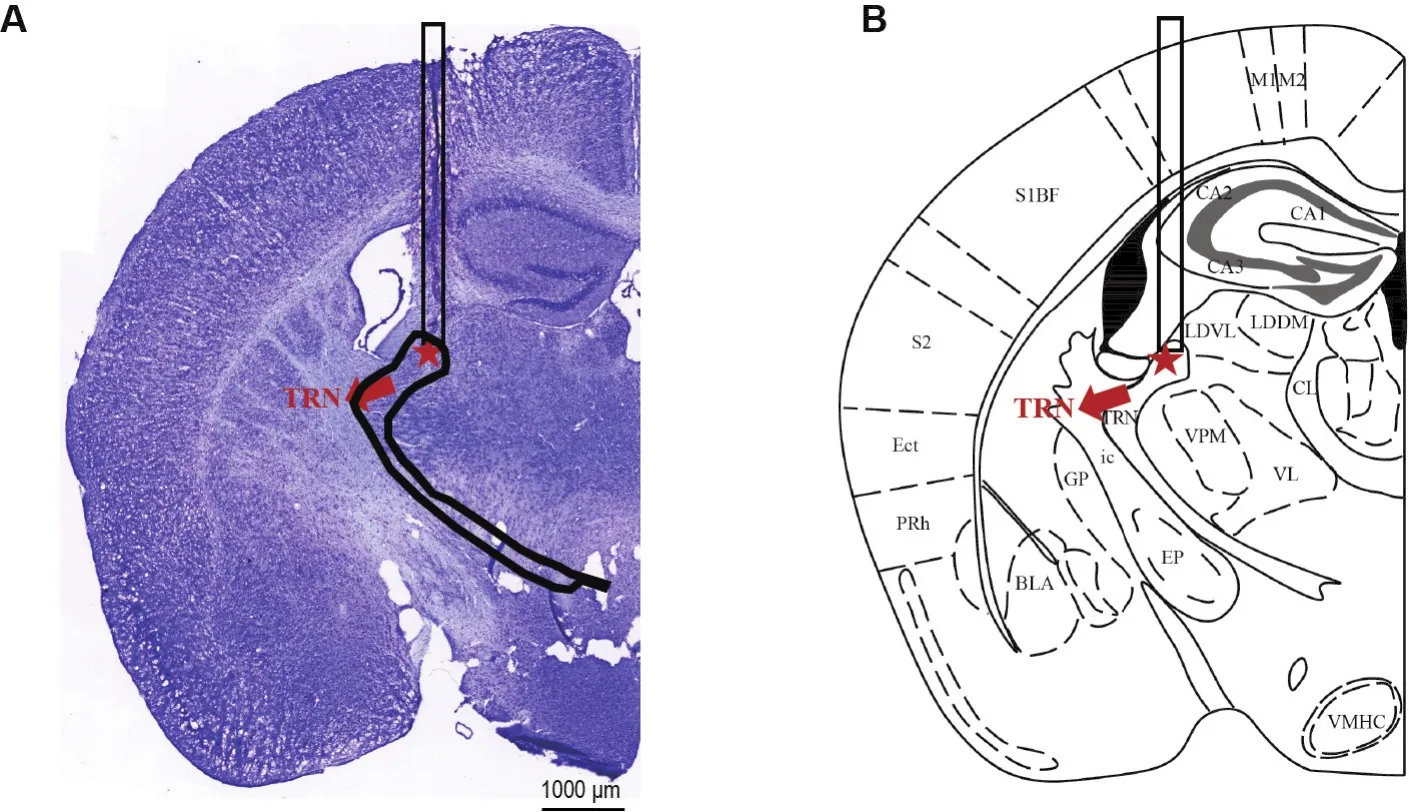
Fig.6 Location of recording electrodes in TRN of freely moving mice.A:post hoc histological image of electrode recording;B:TRN in the mouse brain map.The light red arrow indicates the position of TRN.The red pentacle arrow indicates the position of an electrode.
3 讨论
TRN主要负责整合和调控丘脑皮质之间的信息传递,其中存在大量的PV神经元。γ振荡主要是由PV神经元介导产生的维持大脑中长距离通讯的神经振荡,具有参与编码认知及注意力的重要功能。T型钙通道参与维持γ振荡活动。1992年,Pinauit等[27]建立了在体大鼠TRN γ振荡的研究方法,该方法支持对清醒自由活动大鼠TRN进行神经电生理研究。目前国内外尚无关于小鼠TRN γ振荡的相关报道。本研究采用多通道提高单次记录的通量,在清醒小鼠自由活动状态下记录TRN神经元场电位。由于神经元的共振源于被动(时间依赖的低通滤波)和特定的主动(电压依赖的高通滤波)膜特性的相互作用[28],并且低通和高通滤波机制的适当组合可以产生谐振器(带通滤波器)、陷波器(带阻滤波器)和阈下振荡器,使研究特定频率范围的节律性振荡成为可能[29]。据报道,γ振荡是GABAAR参与介导的[30]。本研究在清醒自由活动小鼠TRN记录γ和θ振荡场电位,通过对TRN的精准定位植入记录电极,保证记录数据的空间精度,同时对信号分析处理,滤波得到γ和θ振荡,并利用工具药荷包牡丹碱对其进行了验证。研究结果表明,荷包牡丹碱(2.25 mg·kg-1)可显著降低清醒自由活动小鼠TRN脑区γ振荡功率谱,表明该清醒自由活动小鼠TRN脑区场电位记录平台建立成功。
TRN中的GABA能神经元与丘脑多个背侧核形成强大的抑制性连接,从而控制丘脑皮质系统的注意、感觉加工和同步振荡。文献报道,在TRN脑区突触GABAAR的激活,触发神经元的突触后去极化[31]。由于TRN脑区的Cl-离子平衡电位高于其他脑区,因而GABAAR的激活可引起神经元去极化,低电压T型钙通道被激活,从而有效控制TRN神经元产生的棘波,进一步参与维持γ和θ振荡。据报道,低电压激活的T型钙通道CaV3.3在TRN神经元中大量表达[32];低电压T型钙通道在TRN脑区高表达,并参与维持神经元兴奋性的阈值。因此,为进一步验证该清醒自由活动小鼠TRN脑区γ振荡记录平台,本研究进一步探究了T型钙通道拮抗剂TTA-A2对TRN脑区γ及θ振荡的影响。通过清醒自由活动小鼠在体多通道记录并经数据分析,TTAA2降低TRN脑区γ及θ振荡的功率谱,影响了γ振荡的维持。γ和θ振荡的这种耦合被认为是促进认知等功能的一种协调神经信息处理的方式,从而提示T型钙通道参与认知及疼痛等生理功能。因此,本研究平台将有助于探究不同脑区神经网络电信号产生、维持的机制以及新药评价体系的建立。
神经科学的一个主要目标是识别神经精神障碍中的神经回路异常,这些异常可以在动物模型中进行研究,以促进新疗法的开发。场电位的细胞外记录,是研究麻醉或清醒动物神经元功能的首选方法[33],同时为疾病机制研究与新药开发提供了强有力的技术手段[34]。急性电生理记录,不论清醒还是麻醉状态下,不可避免存在一些与事件或行为无关的因素,如小鼠焦虑、恐惧等情绪及麻醉剂对实验指标的影响等,难以真实反映小鼠生理状态下的神经活动,更不能与行为相联系。本研究建立的清醒自由活动多通道在体记录平台,将电极植入到小鼠深部脑区,恢复后即可进行多次信号记录,能够更准确、真实地反映脑区神经电生理特性,亦有将行为与特定脑区神经电信号关联起来的明显优势。本平台的难点在于小鼠颅骨小,操作窗有限,且由于解剖学特性TRN脑区范围小。因此,如何精准定位、保护神经元不受损伤并记录到神经元放电是关键因素。
为解决以上问题,在实验操作过程中,首先需注意电极植入的手术过程,其次改善信号记录时的实验环境。本研究的解决方法为:①使用多通道电极,增加记录到信号的概率。②植入电极过程中需注意:颅钉与颅骨连接要紧密,绕银丝也不能使其松动;银丝在电极植入脑组织之前绕在颅钉上,避免植入后缠绕动作扰动电极损伤大脑;需缓慢植入电极,给予脑组织足够长的形态恢复时间,避免大脑回弹不及时压迫脑组织,影响神经元活性及后期记录效果;在植入电极的过程中可利用多通道电生理系统实时观察过程中电信号的变化,并寻找目标脑区范围内信号较强的位置;牙科水泥固定电极之前确保颅骨干燥,尤其是电极周围,这是排除运动干扰的重要手段,必要时使用日本进口牙科水泥进行固定,防止日后电极脱落;小鼠术后应置饲养笼中单独饲养,避免相互之间啃食电极;同时也可以避免小鼠在饲养笼中活动,导致头部电极频繁撞击笼盖,影响电极稳定。③记录信号时尽量排除噪声,同时将不必要的仪器断电,在小鼠记录箱周围包裹锡纸或覆盖铜网接地。④Plexon Control是研究人员与系统交互的承担者,可实现信号可视化,其中的参数设置随记录过程中信号的变化而变化,特别强调阈值线和放大率(Mag)值2个参数,前者的设置决定了记录到的信号,应根据每个通道信号具体分析设定;后者是视图内容的垂直缩放,在可靠地观察到尖峰放电(spike)和局部场电位中具有重要作用。注意此放大率只影响查看,不影响记录信号。
综上所述,本研究建立的清醒自由活动小鼠在体多通道记录平台,记录了TRN脑区γ和θ振荡,将有助于研究神经元网络功能,并可能为揭示神经元同步化和疾病发生的关系提供研究平台,并为疾病治疗和新药研发奠定技术基础。该平台的未来使用将可能直接测试大脑状态对动物行为信息处理的影响,并有可能改善大脑疾病模型中的功能状态。
