Ce-Li-LSX制氧分子筛增强吸附机理的DFT研究
2022-03-29付耀国刘应书
付耀国,刘应书
(1.北京科技大学能源与环境工程学院,北京,100083;2.北京科技大学北京高校节能与环保工程研究中心,北京,100083)
氧气是用于化学生产的第三大化学物质,广泛应用于高炉富氧、电炉炼钢、有色、化工、造纸等行业[1]。目前,低温深冷和变压吸附分别是大规模和中小规模制氧的两大主要技术[2-5]。吸附空分是基于沸石独特的吸附特性,在吸附孔道中附着了金属阳离子,N2和O2进入了沸石吸附孔道中,与金属阳离子发生相互用,由于N2和O2四极矩的差异,金属阳离子对N2和O2的吸附量不同,使沸石对N2和O2具有选择性。1960年,美国将变压吸附制氧工业化应用,主要使用Ca-A型和Na-X型沸石分子筛(其N2/O2分离系数分别约为3.0和3.5)[6-7]。1989年,美国UOP公司将Li-X型沸石分子筛(N2/O2分离系数约为4.5)用于真空解吸变压吸附(VPSA)制氧,使得制氧设备投资成本降低、回收率大幅升高、能耗降低[8]。2000年后,随着Li-LSX 在PSA制氧上的大量普及(N2/O2分离系数约为6.2),PSA制氧迅速发展[9-10]。但LSX 型沸石分子筛硅铝物质的量比接近1,其结构中容纳的阳离子数量接近极限,制氧分子筛性能发展到Li-LSX 就很难再有提升。锂是金属活动性最强的金属,电荷密度很大并且有稳定的氦型双电子层,容易极化其他的分子或离子,是目前公认用于N2和O2吸附分离的最佳阳离子。
FEUERSTEIN 等[11]通过中子衍射和NMR 研究了Li-LSX中的Li+位置,发现Li+在沸石中只有SI',SII 和SIII 这3 个位置可以被占据,SI'位于沸石中六棱柱顶部,SII 和SIII 分别位于方钠石笼的氧六元环和氧四元环中心[12]。其中SI'位置的Li+被六棱柱的氧原子包围,空间上接触不到进入超笼的N2和O2分子,只有暴露在超笼中的SII 和SIII 位置的Li+才对N2和O2分子有吸附作用。尽管如此,超笼中阳离子周围电场还是部分被围绕的氧原子所屏蔽,这种屏蔽作用削弱了阳离子对N2和O2分子的吸附能力。HUTSON 等[13]将少量的Ag+与Li-LSX沸石进行离子交换得到了Ag-Li-LSX 沸石,发现Ag-Li-LSX 沸石较Li-LSX 沸石有更高的氮气吸附量和N2/O2选择性系数。通过X 射线光谱(XPS)分析,Ag+的主要负载位置为SI,SI'和SII*,其中SII*位置在方钠石笼内氧六元环平面上方,该位置的Ag+周围氧原子对Ag+的屏蔽作用较SII 的更小,且Ag+与N2之间存在络合弱化学作用,使得Ag-Li-LSX 沸石对N2/O2选择性系数更高。由此可见,减弱SII位置的氧原子对阳离子的屏蔽作用,可以有效提高N2吸附量和N2/O2选择性。陈宗蓬等[14]以Na-X型硅铝酸盐作为基本骨架,与Ce3+进行离子交换,制得铈离子交换率为20%的稀土X型沸石,剩余阳离子交换成NH4-稀土X型沸石,再与Li-OH溶液进行Li+交换,得到Li-Ce-LSX 沸石,在温度为15 ℃、压力为0.1 MPa条件下测得Li-Ce-LSX沸石的氮吸附量1.2 mmol/g,N2/O2选择性系数可达10.0,但未对阳离子Li+和Ce3+在沸石中的具体位置和负载了Ce3+后氮吸附量增加和选择性系数上升的机理进行解释。NERY 等[15]将NaY 沸石用Ce3+进行离子交换,得到了稀土阳离子改性的Y 分子筛,利用核磁共振NMR方法确定了稀土阳离子经过煅烧(500 ℃)后的结晶位置,结果表明,经过离子交换的Ce3+位于SI'位置。杨富邦等[16]采用水溶液离子交换法以Ce3+为阳离子交换剂制备了Ce-Li-LSX分子筛,并考察了Ce-Li-LSX 分子筛对O2/Ar 的吸附分离性能,研究发现Ce-Li-LSX 沸石较Li-LSX 沸石对O2和Ar的吸附量和分离系数均有所上升,这是因为Ce3+在分子筛中的分布形成了强电场,提升了Ce-Li-LSX的吸附分离性能,但并未定量和系统的对Ce-Li-LSX增强吸附性能进行解释。左蕊等[17]采用离子交换法将Ce3+交换到Na-X 分子筛上,所得分子筛也具有较好的氧气吸附性能。通过以上研究可以推测,用Ce3+交换Li-LSX 分子筛中SI'位置的Li+可能会对氮气吸附作用有增强效果,但增强吸附机理不明,对该现象进行验证和解释是一项值得研究的工作。
随着计算化学的发展,用量子化学计算方法取代传统实验可以有效节约新材料的设计时间和实验成本,特别是在材料性能筛选上有很大优势[18-19]。密度泛函理论(DFT)方法是公认的研究沸石与气体分子吸附相互作用的工具[20]。借助DFT计算方法,可以模拟计算气体在固体上的吸附,揭示吸附机理。本文作者以FAU 结构的沸石为基础,构建包含方钠石笼和六棱柱原子的计算模型,用Ce3+替换模型上SI'号位置的Li+,对N2和O2在2种沸石表面模型上的吸附过程进行计算,通过对吸附体系的吸附结构、吸附能、成键机理、电荷密度及态密度等性质的分析,对比考察N2和O2在纯Li+模型和加入Ce3+的混合模型上的吸附行为,研究Ce3+对N2和O2分子的增强吸附机理,为实验合成具有增强吸附功能的制氧分子筛提供理论参考。
1 计算方法与模型
1.1 计算方法
计算采用基于第一性原理的Materials Studio软件的CASTEP模块[21],采用广义梯度近似(GGA)中的Perdew-Burke-Ernzerh (PBE)交换关联势描述电子交换相关作用[22]。截断能设为600 eV,用超软赝势(ultra-soft)描述价电子和离子实的相互作用[23],采用BFGS 优化算法[24],自洽场收敛精度设定为1×10-5eV/atom。色散校正采用DFT-D 的Grimme修正[25]。几何优化收敛标准如下:原子最大位移为0.000 2 nm,原子间作用力为0.05 eV/10-10m,每个原子体系总能量变化为2.0×10-5eV,所有计算均在倒易空间中进行。构建的吸附剂-吸附质表面吸附模型置于边长为25×10-10m的周期性晶胞中结构优化,吸附构型布里渊区k点选取Gamma 点,热拖尾(smearing)值设置为0.2 eV。
1.2 表面模型
FAU 构型的分子筛按结构中的硅铝比(物质的量比)分为X 型和Y 型,当硅铝比<3 时,为X 型,当硅铝比≥3 时,为Y 型,其中硅铝比小于1.15 时通常称为低硅型(LSX)[26]。分子筛由含铝、氧、硅的分子筛框架和非框架阳离子Mn+组成,骨架结构为FAU 型,属于六方晶系,空间群为FD-3M,结构中含有一种孔道,孔道由12个TO4四面体构成,该分子筛的分子式为M96/nAl96Si96O384,n表示阳离子M的化合价[27]。图1所示为沸石表面模型在FAU框架中的空间位置示意图,模型中包含了SI',SII和SIII 位置的阳离子,从此模型中取出包含3 个位置阳离子的表面模型为研究对象,探索Ce3+在SI'号位置取代Li+后,沸石分子筛对N2和O2吸附影响和机理。为了减少在结构优化过程中表面模型原子缺少沸石框架支撑的影响,表面模型采用框架原子固定,阳离子和吸附的气体分子不固定的方式进行结构优化。

图1 沸石表面模型Fig.1 Zeolite surface model
气体分子在表面的吸附能定义为[28]

式中:Eads为气体分子在沸石表面吸附能,eV;Eads/surf为气体分子吸附在表面模型上的总能量,eV;Eads和Esurf分别为气体分子和表面模型的能量,其中Eads为负值,表面吸附放热,能够处于吸附稳定状态,绝对值越大,吸附能力越强。
2 结果与讨论
2.1 N2和O2在沸石表面吸附
吸附构型优化是计算体系在寻找能量最低点的过程,未固定的原子不断改变原子位置及与原子间距离,直至满足计算设置的收敛标准。对N2和O2在沸石表面模型上的吸附构型进行结构优化,以SII 和SIII 位置周围氧原子构成的六元环和四元环中心位置为参照,优化后的阳离子位置与中心位置的距离。N2和O2在吸附构型中的最终优化位置如图2所示。从图2(a)和(c)可以看出:纯Li-LSX分子筛吸附N2分子后,处于SII和SIII位置的Li+分别距离氧六元环和氧四元环中心距离为0.093×10-10m和1.168×10-10m;用Ce3+替代SI'位置的Li+结构优化后,Ce-Li-LSX 分子筛中,处于SII 和SIII 位置的Li+分别距离氧六元环和氧四元环中心距离为0.095×10-10m 和1.187×10-10m,说明由于Ce3+的加入,引起了SII和SIII的Li+位置变化,使在空间上能够直接与N2接触的SII和SIII的Li+有远离周围氧原子屏蔽的趋势。Ce-Li-LSX 和Li-LSX 分子筛吸附O2分子后的吸附构型也有类似现象。N2在Ce-Li-LSX 和Li-LSX 上与SIII 的Li+的距离分别为2.115×10-10m 和2.238×10-10m,O2在Ce-Li-LSX 和Li-LSX 上与SIII 的Li+的距离分别为2.099×10-10m和2.117×10-10m。通过气体吸附能公式对N2和O2在Ce-Li-LSX和Li-LSX在2种吸附构型上的吸附能进行计算,得到N2在2 种结构上的吸附能分别为-0.517 eV 和-0.306 eV,O2的吸附能分别为-0.195 eV 和-0.170 eV。可见:在SI 位置加入Ce3+使得沸石上其他位置阳离子对N2吸附能增加了40.8%,对O2吸附能增加了12.8%,N2吸附能增加幅度更大,说明Ce-Li-LSX 较Li-LSX 沸石有更高的N2/O2吸附分离系数。为进一步了解增强吸附原理,需对研究对象的电子性质进行分析。

图2 N2和O2在Ce-Li-LSX和Li-LSX沸石模型上吸附构型Fig.2 N2 and O2 adsorbed on Ce-Li-LSX and Li-LSX zeolite
2.2 电子性质分析
2.2.1 电荷差分密度分析
通过电荷差分密度图可以定性地判断吸附发生时整个吸附体系的电荷转移情况。图3所示为N2和O2在Ce-Li-LSX 和Li-LSX 上吸附的电荷差分密度图,图中颜色深浅表示电子云的密度,颜色越深,电子云密度越大,原子间的成键作用越强。差分电荷密度图采用蓝一白一红3色表示,蓝色表示作用后失去电荷,红色为作用后得到电荷,颜色越深,绝对值越大。在Ce-Li-LSX和Li-LSX这2个模型的3 个不同方向上进行切片,记为Sliece1~Sliece3。 对 比Ce-Li-LSX-Sliece1 和Li-LSX-Sliece1可以看出:SI'位置加入Ce3+后,Ce3+与沸石框架上相邻的氧原子形成了共价键,而SI'位置的Li+以离子键形式存在;Ce-Li-LSX-Sliece2 方向上Li+-N2分子之间相互作用,形成电荷集聚,这种电荷集聚明显强于Li-LSX-Sliece2 上Li+-N2之间的作用,从此处电荷差分密度可以判断出N2分子在Ce-Li-LSX 上的吸附作用更强;而Ce-Li-LSXSliece3与Li-LSX-Sliece3上的电荷差分密度较为相似,故O2在2种沸石上的吸附能接近。

图3 N2和O2在Ce-Li-LSX和Li-LSX上吸附电荷差分密度图(OZ代表沸石框架上氧原子,O为氧分子中氧原子)Fig.3 N2 and O2 charge differential density on Ce-Li-LSX and Li-LSX(OZ represents oxygen atoms on zeolite frame,O represents oxygen atoms in oxygen molecules)
2.2.2 态密度分析
N2和O2在Ce-Li-LSX 和Li-LSX 上吸附前后的电子态密度图如图4所示。从图4(a)可见:在N2分子吸附前,p 轨道的最高峰对应的能量在-4.5 eV左右,在Li-LSX 和Ce-Li-LSX 沸石上吸附后峰值对应能量降低至-7 eV和-7.5 eV;靠近费米能级附近的s轨道峰值对应的能量从-6 eV降低至-9 eV和-9.5 eV 左右。费米能级附近的密度分别是由成键轨道和反键轨道决定的。在N2吸附过程中,p 和s轨道能量分布逐渐向较低的能量范围转移,这说明N 原子上电荷向沸石中阳离子方向集聚,原子活性降低,趋于稳定状态,从N 原子能级移动程度看,在Ce-Li-LSX沸石上的吸附更为稳定。从图4(b)可见:在O2分子吸附后,O 原子上s 和p 轨道的峰值有所降低,但峰值对应的能量变化不大,可见:O2分子在Li-LSX 和Ce-Li-LSX 沸石上均发生了吸附现象,且从电子态密度图上推断O2在2种分子筛上吸附状态相似。

图4 N2 和O2在Ce-Li-LSX和Li-LSX上的态密度图Fig.4 States density of N2 and O2 on Ce-Li-LSX and Li-LSX
2.2.3 成键分析
对Ce-Li-LSX 和Li-LSX 沸石模型上的原子进行Mulliken电荷布居数计算,计算的原子编号如图5 所示,其中关键原子间的电荷布居数见表1。从表1可见:在2种分子筛上处于SII位置的Li+(编号Li1)与周围沸石框架上连接的氧原子(O5,O35,O37,O41,O18,O39)间Mulliken布居数为负或者为0,Li+与周围的氧原子之间未发现共用电子对现象,这说明Li+与沸石框架之间以离子键形式结合,且一定程度上受周围氧原子上负电荷屏蔽。分析处于SI'位置的阳离子Ce3+和Li+与O40之间的成键情况,Ce3+—O40的Mulliken 布居数0.31,Ce3+—O40的配位键的共价性较大;Li+—O40之间Mulliken 布居数0,为纯离子键。Ce-Li-LSX 沸石上O40原子与其相邻的Al11,Si11之间电荷布居数分别为0.39和0.53,电荷布居数小于Li-LSX上O40与Al11,Si11之间的电荷布居数(0.46和0.60),这是由于Ce3+与O40原子形成的配位键影响到O40原子与Al11,Si11原子上的电荷分布,进而影响到Al11,Si11原子与其相邻的O39,O41,O18和O37原子上的电荷分布。其原子间电荷影响路径分别为Ce3+—O40—Al11—(O39和O41)和Ce3+—O40—Si11—(O18和O37),如图5中箭头所示。通过以上影响路径,最终在SI'位置加入Ce3+后,增强了Li1+附近沸石框架上的Si和Al原子与周围框架氧原子的共用电子程度(即共价性),使得Li1+周围的沸石框架氧原子对它的屏蔽作用减弱,在结构上表现为Li1+有远离沸石框架趋势,由于阳离子向沸石分子筛的超笼中心靠近,在空间上更容易接触进入沸石超笼中的N2和O2分子,在屏蔽效应减弱的共同耦合作用下,对气体分子具有增强吸附的作用。

图5 Ce3+对沸石框架原子电荷布居数影响Fig.5 Effect of Ce3+on atomic charge distribution in zeolite frames
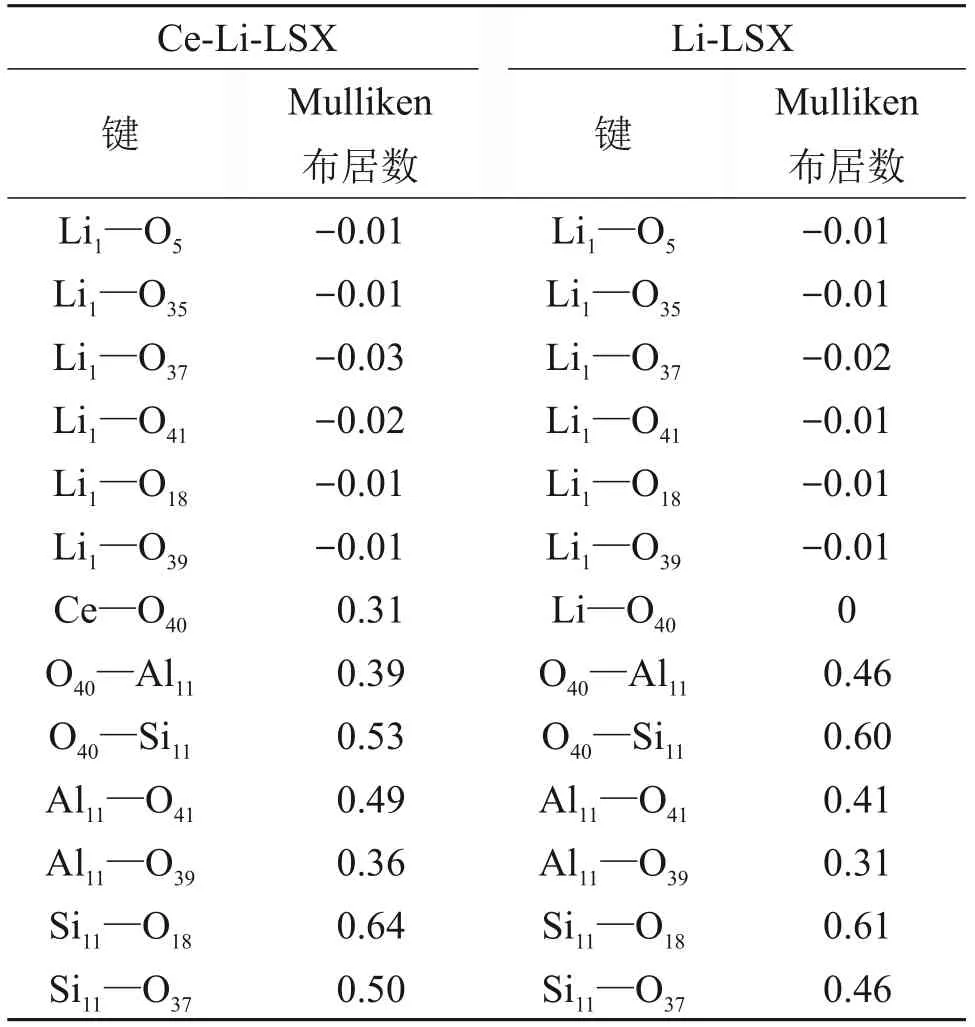
表1 Ce-Li-LSX和Li-LSX沸石表面模型中原子Mulliken布居数Table 1 Mulliken population in Ce-LI-LSX and Li-LSX zeolite surface models
3 结论
1) 在SI'位置加入Ce3+后,N2和O2分子在Ce-Li-LSX 沸石上的吸附能较Li-LSX 上的增强,N2在2 种结构上的吸附能分别为-0.517 eV 和-0.306 eV,O2的吸附能分别为-0.195 eV和-0.170 eV,N2和O2分子的吸附能分别增加了40.8%和12.8%。
2)Ce3+加入到SI'位置后与周围沸石框架上氧原子形成配位键,而Li+以离子键形式存在。N2和O2分子在2 种沸石上吸附时,与Li+之间发生相互作用,N2和O2电子向Li+方向集聚。
3)Ce3+通过与周围氧原子形成配位键影响其与氧原子相邻的其他原子之间电荷分布,最终传导至超笼中起吸附作用的Li+周围氧原子,通过这种方式减弱了超笼中Li+周围的氧原子对它的屏蔽作用,从而对气体分子具有增强吸附的作用。
