NOX2、NLRP3在肝纤维化患者血清中的表达及其生物学意义*
2022-03-29谭莉霞魏书堂闫春晓王航宇杨丙信徐梦阳仝甲钊
肝纤维化是由各种原因导致肝脏纤维结缔组织沉积,是各种慢性肝病向肝硬化、肝癌发展的关键步骤。激活肝星状细胞(HSC)是肝纤维化发展的关键,活化的HSC会转变为肌成纤维细胞,导致细胞外基质(ECM)大量分泌,引起肝纤维化发生
。研究表明氧化应激与HSC的激活及肝纤维化的发生有关
。活性氧(ROS)不仅可以直接促进肝纤维化的发生发展,还可通过炎症反应、细胞凋亡等过程参与肝纤维化发展
。烟酰胺腺嘌呤二核苷酸磷酸氧化酶(NOX)是ROS的主要来源,在肝纤维化的进展中起着至关重要的作用
,炎症反应是导致大多数慢性肝病及肝纤维化的主要因素之一,核苷酸结合寡聚化结构域样受体家族吡啉结构域蛋白3(NLRP3)炎症小体的激活与肝脏损伤及肝纤维化形成的机制有关
。因此,本研究通过检测肝纤维化患者血清NOX2、NLRP3表达情况,再通过体外培养人HSC细胞,研究NOX2、NLRP3对HSC细胞增殖和凋亡的影响,探讨两者在肝纤维化中的表达及生物学意义。
1 资料与方法
1.1 一般资料 选取2017年9月至2020年9月我院收治的80例肝纤维化患者为研究对象,其中男47例,女33例;年龄43~75岁,平均(57.31±8.52)岁。所有患者均经肝脏穿刺活检,符合《肝纤维化诊断及治疗共识》中肝纤维化的诊断标准
,根据纤维化诊断分期将患者分为S1期34例,S2期24例,S3期16例,S4期6例。同期选取80例酒精性肝炎患者为对照组,患者经肝脏穿刺病理学检查未发生肝纤维化,其中男43例,女37例;年龄42~78岁,平均(58.64±9.45)岁。两组研究对象在年龄、性别间比较差异无统计学意义(
>0.05)。所有患者及其家属知情并同意参与此次研究。
1.2 药品与试剂 人肝星状细胞系LX-2(CL-0560)、DMEM培养基(PM150210)购自武汉普诺赛生命科技有限公司;胎牛血清(10099)、青霉素-链霉素(15070063)、胰蛋白酶(25200056)购自美国Gibco公司;Lipofectamine 3000试剂盒(批号HUDY03)购自美国Invitrogen公司;NOX2、NLRP3酶联免疫吸附(ELISA)试剂盒(OKEH07548、OKCD09236)购自美国Aviva Systems Biology公司;RNAiso plus(9108Q)、PrimeScriptTM RT reagent Kit with gDNA Eraser(RR037)、SYBR Premix Ex TaqTM Ⅱ(RR820Q)购自日本TAKARA公司;单抗CyclinD1(ab16663)、CDK4(ab108357)、Caspase-3(ab13847)、Caspase-9(ab32539)、NOX2(ab129068)、NLRP3(ab263899)、IL-18(ab243091)、IL-1β(ab234437)、GAPDH(ab8245)、山羊抗兔IgG H&L(AlexaFlour 594)(ab150080)购自abcam公司;细胞计数试剂盒(CCK-8)试剂盒、Annexin V-FITC细胞凋亡双染试剂盒、活性氧检测试剂盒、细胞蛋白提取试剂盒、BCA蛋白定量试剂盒、(货号:C0037、C1062、S0033、A0303、P0033、P0012)购自南通碧云天生物技术公司;NOX2 mRNA、NLRP3 mRNA、GAPDH、siRNA NOX2由生工生物工程(上海)股份有限公司合成;多功能酶标仪(Varioskan
LUX)购自美国ThermoFisher公司;实时荧光定量PCR(qRT-PCR)仪(CFX96)、蛋白凝胶成像仪(Gel Doc)购自美国Bio-Rad公司;流式细胞仪(FACS Canto Ⅱ)购自美国BD公司。
四要着力夯实管理基础。要进一步健全部门基础信息数据库,实现对行政事业单位机构、编制、人员、资产、经费等数据的动态管理。要加快完善水利财务管理信息系统,以信息化促进水利财务管理工作的科学化、精细化。要加强水利财务统计工作,全面、准确地掌握财务状况和水利家底,为水利改革发展提供可靠依据。
1.3 实验方法
1.3.1 EILSA法检测血清中NOX2、NLRP3的表达 利用ELISA试剂盒检测所有受试者血清中NOX2、NLRP3的表达,严格按照试剂盒说明书进行操作。
2.1 两组患者血清中NOX2、NLRP3的表达情况 见表2。
2.2 各组细胞中NOX2、NLRP3的mRNA表达情况 见表3。
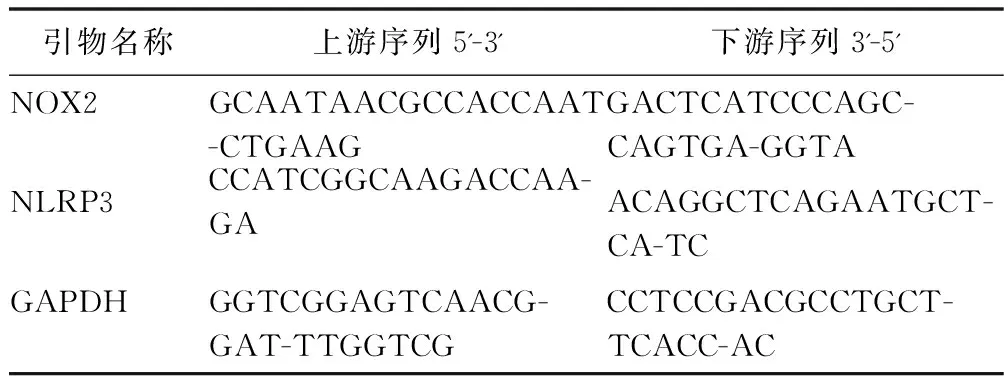
1.3.3 实时荧光定量聚合酶链反应(qRT-PCR)检测细胞中NOX2、NLRP3的mRNA表达水平 引物序列见表1。
1.3.4 CCK-8法检测细胞增殖抑制率 收集培养48 h后各组对数期细胞,0.25%胰蛋白酶消化,调整细胞浓度为4×10
个/孔,接种至96孔板中,每组设置6个复孔,37℃、5% CO
培养箱中培养48 h,加入10 μl CCK-8试剂,37℃遮光培养2 h,弃上清液。酶标仪450 nm处检测吸光度OD值,计算细胞增殖抑制率(%)=[(对照孔OD值-实验孔OD值)/对照孔OD值]×100%。
半夜刚过,警察小哥靠在门边坐下,跟我分了新一天烟的份额。抽完了他说女朋友跟他分手了,可他还保持着那个习惯。他说我已经想不起她的样子了,习惯真是可怕的东西。
1.3.6 2’,7’-二氯二氢荧光素二乙酸酯(DCFH-DA)法检测细胞ROS水平 荧光显微镜观察各组细胞内ROS荧光图像。
1.3.7 蛋白免疫印迹(WB)法检测相关蛋白表达 检测各组细胞CyclinD1、CDK4、Caspase-3、Caspase-9蛋白表达水平。
2.5 干扰NOX2表达对LX-2细胞增殖、凋亡蛋白表达的影响见表6。

1.3.5 流式细胞术检测细胞凋亡 收集培养48 h后各组对数期细胞,0.25%胰蛋白酶消化,调整细胞浓度为5×10
个/ml,每组设置3个重复,吸取200 μl细胞悬液至新离心管中,预冷PBS重悬细胞,加入5 μl Annexin V-FITC,轻混均匀,4℃遮光孵育15 min;加入PI染液,轻混均匀,流式细胞仪观察各组细胞凋亡情况。
2 结果
这个“科普”之名的奖,引来了记者访谈.主题是:能够获奖的科普著作为何没在大陆出版?然后发表了不着边际的评论文章.如果她但凡有点水平,评论的焦点恐怕应该是:究竟什么是科普著作(前提是认同还是否定“吴大猷科普奖”的属性)?

1.3.2 细胞培养与分组 对LX-2细胞进行常规复苏,转移至含10%胎牛血清和1%青霉素-链霉素的DMEM培养基中,37℃、5% CO
培养箱中培养。细胞融合度达到80%~90%时,0.25%胰蛋白酶消化,传代培养,每2~3 d更换1次培养液,细胞生长良好且达对数期时进行后续实验。细胞饥饿24 h后,添加含6 ng/ml转化生长因子-β1(TGF-β1)
的培养液刺激LX-2细胞24 h之后正常培养。取上述TGF-β1刺激24 h后处于对数生长期的LX-2细胞,0.25%胰蛋白酶消化,调整细胞浓度为5×10
个/孔,接种至6孔板中,37℃、5% CO
培养箱中培养。细胞融合度达到60%时,弃去培养板中培养液,加入新鲜培养基,按照Lipofectamine 3000试剂盒说明书对LX-2细胞进行转染,并将细胞分为Control组(只添加培养液)、NC组(转染空质粒组)、NOX2 siRNA组(转染NOX2 siRNA)。
2.3 干扰NOX2表达对LX-2细胞增殖抑制率的影响 见表4。

2.4 干扰NOX2表达对LX-2细胞凋亡率的影响 见表5。

(2)市场导向及公众压力。可持续发展这一概念的提出能够促进社会以及人的全面、长久发展。加强生态文明的建设力度,加深人民的环保意识是当前社会公众极为重视的话题。消费者在市场众多产品中选择时,也越来越多的将是否环保这一点纳入考虑范畴之内。而企业在将产品推向市场时,其营销策略也会更多的迎合消费者们在环保方面的意愿与需求,逐渐将环保作为一大卖点。尤其当重污染企业也将环保纳入考量范围,社会公众对其产品的接受度也会有所提升,企业也将迎来更广阔的市场。将这种公众压力合理地转化为动力,并通过良好的环境行为创造出新的企业价值,是重污染企业作出的明智选择。

2.7 干扰NOX2表达对LX-2细胞蛋白NOX2、NLRP3、IL-18、IL-1β表达的影响 见表8。

2.6 干扰NOX2表达对LX-2细胞ROS含量的影响 见表7。
3 讨论
肝纤维化是由慢性肝损伤导致的持续性病理改变,病毒性肝炎、寄生虫感染、酗酒、免疫性肝炎等均是引起肝纤维化的因素。如若治疗不及时,可能会发展为肝硬化甚至肝癌,严重威胁人体健康。因此,研究影响肝纤维化发生的有关机制至关重要。Gan等
研究表明与肝纤维化组大鼠比较,熊果酸干预后的肝纤维化大鼠肝脏组织中蛋白NOX1、NOX2、NOX4表达显著降低。Huang等
研究表明丹参酮ⅡA可能通过抑制NOX2的表达减轻脂多糖诱导的小鼠心脏纤维化。本研究结果表明肝纤维化组患者血清NOX2、NLRP3表达显著高于对照组,提示NOX2、NLRP3可能与肝纤维化的发生有关。TGF-β是影响HSC活化的关键纤维化细胞因子之一
,因此本研究进一步利用TGF-β1刺激肝星状细胞LX-2,分析NOX2、NLRP3对活化LX-2细胞的影响。
苏秋琴、白玉儿、毛娣、黄小燕和米菊她们是男人们返村后才回来的,这本身就让她们的男人们非常恼火,他们带着一身焦渴赶回家里,却发现自己的女人还在城里,还在做那种生意。当然,在女人们掏出她所挣的相当可观的钱之后,多数男人看在钱的面子上,也就原谅了自己的女人,只是把怨愤推到苏秋琴一个人身上。都是这个婊子,教坏了他们的女人,明天找白天明和苏秋琴算账去!
HSC的活化是肝纤维化发生的主要原因,肝脏损伤后,静止状态的HSC被激活,转化为肌成纤维细胞,肌成纤维细胞会分泌大量胶原纤维,从而导致ECM沉积,导致肝纤维化的发生
。氧化应激与肝纤维化的发展密切相关,肝细胞中过量ROS的产生会导致肝细胞的凋亡,HSC细胞的异常增殖,进而导致肝纤维化的发生
。NOX是由多种蛋白亚基组成的跨膜复合体,同时是肝细胞中ROS的主要来源
。Lan等
研究表明肝硬化患者肝脏组织中NOX1、NOX4蛋白表达显著高于酒精性肝病患者,且与CCl4处理的野生型小鼠比较,NOX1、NOX4基因敲除小鼠HSC增殖减少,且肝脏炎症、氧化反应和纤维化程度显著下降。本研究对LX-2细胞转染NOX2 siRNA,结果表明NOX2 siRNA组细胞的NOX2 mRNA表达显著降低,提示细胞转染成功。进一步研究表明转染NOX2 siRNA能够抑制活化的LX-2的增殖,促进LX-2凋亡,降低细胞内ROS含量,提示NOX2可能通过介导氧化应激影响LX-2的增殖、凋亡,进而促进肝纤维化的发展。
NLRP3炎症小体是一种多蛋白复合物,是炎症反应关键的调节和转录因子,能够诱导促炎因子的活化和释放。炎症反应同样是导致肝纤维化发生的机制之一,Li等
研究表明与未发生肝纤维化患者比较,肝纤维化患者肝脏中醛固酮、NLRP3表达显著增加,体外实验又表明醛固酮通过促进NLRP3炎性小体的表达诱导了原代小鼠HSC的活化,而敲除NLRP3基因可减轻醛固酮引起的小鼠肝纤维化。Cai等
研究表明HSC中ROS的增加可能通过激活NLRP3炎性小体导致HSC细胞的活化。陈凯等
研究表明白桦酯酸可能通过抑制NOX2/ROS/NLRP3通路改善肝纤维化大鼠的肝组织损伤程度,抑制肝组织纤维化。本研究结果表明与Control组和NC组比较,NOX2 siRNA组LX-2细胞中NLRP3的表达显著降低,提示NOX2可能能够调控NLRP3的表达。细胞内NLRP3受到ROS刺激后会使pro-caspase-1活化为caspase-1,释放IL-18、IL-1β从而引发炎症反应,促进肝纤维化的发展
。本研究结果表明NOX2 siRNA组LX-2细胞蛋白IL-18、IL-1β表达显著低于Control组和NC组,提示NOX2可能通过增加LX-2中ROS的含量激活NLRP3的表达,导致IL-18、IL-1β等炎症因子的释放,从而参与肝纤维化的发生发展,具体机制有待进一步验证。
螺柱及焊接工件的材料,由于其自身的材料化学成分影响,本文不做详细讨论。在此主要研究螺柱及工件外形、表面状态等因素对焊接质量的影响。
综上所述,NOX2、NLRP3可能与肝纤维化的发生及LX-2细胞的增殖、凋亡有关,NOX2可能调控LX-2细胞中NLRP3的表达,进而参与肝纤维化发生发展。本研究仅针对NOX2、NLRP3对HSC细胞的影响进行探讨,下一步需研究两者对肝细胞及Kupffer细胞的影响,进一步解析NOX2、NLRP3在肝纤维化发生机制中的可能作用。
[1] Chen Z, Jain A, Liu H,
. Targeted drug delivery to hepatic stellate cells for the treatment of liverfibrosis[J]. J Pharmacol Exp Ther,2019, 370(3): 695-702.
[2] Zhang F, Jin H, Wu L,
. Diallyl trisulfide suppresses oxidative stress-induced activation of hepatic stellate cells through production of hydrogen sulfide[J]. Oxid Med Cell Longev,2017, 2017: 1406726.
[3] Zhang S, Yu D, Wang M,
. FGF21 attenuates pulmonary fibrogenesis through ameliorating oxidative stress in vivo and in vitro[J]. Biomed Pharmacother,2018,103(1):1516-1525.
[4] 吕艳杭,吴姗姗,王振常,等. 中医药调控活性氧(ROS)抗肝纤维化的研究进展[J]. 中华中医药学刊,2021,39(6):117-121.
[5] Liang S, Kisseleva T, Brenner DA. The role of NADPH oxidases (NOXs) in liver fibrosis and the activation of myofibroblasts[J]. Front Physiol,2016,7(1):17-17.
[6] Liu D, Qin H, Yang B,
. Oridonin ameliorates carbon tetrachloride-induced liver fibrosis in mice through inhibition of the NLRP3 inflammasome[J]. Drug Dev Res,2020,81(4):526-533.
[7] 中华肝脏病学会肝纤维化学组.肝纤维化诊断及疗效评估共识[J].中华肝脏病杂志,2002,10(5):327-328.
[8] Dong HN, Park SY, Le CT,
. Irisin regulates the functions of hepatic stellate cells[J]. Endocrinol Metab (Seoul),2020,35(3):647-655.
[9] Gan D, Zhang W, Huang C,
. Ursolic acid ameliorates CCl4-induced liver fibrosis through the NOXs/ROS pathway[J]. J Cell Physiol,2018,233(10):6799-6813.
[10] Huang L, Zhu J, Zheng M,
. Tanshinone IIA protects against subclinical lipopolysaccharide induced cardiac fibrosis in mice through inhibition of NADPH oxidase[J]. Int Immunopharmacol,2018,60(1):59-63.
[11] Dewidar B, Meyer C, Dooley S,
. TGF-beta in hepatic stellate cell activation and liver fibrogenesis-updated 2019[J].Cells,2019,8(11):1419-1419.
[12] Barry AE, Baldeosingh R, Lamm R,
. Hepatic stellate cells and hepatocarcinogenesis[J]. Front Cell Dev Biol,2020,8(1):709-709.
[13] 赵杰,齐永芬,鱼艳荣. 氧化应激在肝纤维化发生发展中的作用[J]. 临床肝胆病杂志,2019,35(9):2067-2071.
[14] Mortezaee K. Nicotinamide adenine dinucleotide phosphate (NADPH) oxidase (NOX) and liver fibrosis: A review[J]. Cell Biochem Funct,2018,36(6):292-302.
[15] Lan T, Kisseleva T,Brenner DA. Deficiency of NOX1 or NOX4 prevents liver inflammation and fibrosis in mice through inhibition of hepatics tellate cell activation[J]. PLoS One,2015,10(7):e129743.
[16] Li Y, Zhang Y, Chen T,
. Role of aldosterone in the activation of primary mice hepatic stellate cell and liver fibrosis via NLRP3 inflammasome[J]. J Gastroenterol Hepatol,2020,35(6):1069-1077.
[17] Cai SM, Yang RQ, Li Y,
. Angiotensin-(1-7) improves liver fibrosis by regulating the NLRP3 inflammasome via redox balance modulation[J]. Antioxid Redox Signal,2016,24(14):795-812.
[18] 陈凯,苏洪德,巴音达拉. 白桦酯酸对肝纤维化大鼠的保护作用[J]. 中国临床药理学杂志,2020,36(18):2817-2820.
[19] Patel MN, Carroll RG, Galvan-Pena S,
. Inflammasome priming in sterile inflammatory disease[J]. Trends Mol Med,2017,23(2):165-180.
[20] Tao Y, Wang N, Qiu T,
. The role of autophagy and NLRP3 inflammasome in liver fibrosis[J]. Biomed Res Int,2020,2020:7269150.
