基于网络药理学探讨化痰祛湿活血方治疗非酒精性脂肪性肝炎作用机制及实验验证*
2022-03-29顾亚娇张丽慧张剑波赵文霞
非酒精性脂肪性肝病(NAFLD)包括非酒精性肝脂肪变、非酒精性脂肪性肝炎(NASH)、肝硬化和肝细胞癌
。NASH存在肝细胞损伤和与炎症相关的肝微小变性,是肝脂肪变进展为肝纤维化、肝硬化的中间阶段,难以自行康复
,有进展为肝硬化及其并发症的风险
,阻止NASH进展成为重要的任务。化痰祛湿活血方是名老中医赵文霞教授近30年治疗NASH的经验方,临床和实验已证实其有效性,如化痰祛湿活血方可以减轻NASH小鼠的炎症及纤维化,改善肝细胞内脂肪沉积
,但其作用机制尚未明确。本文通过网络药理学的方法,系统性分析化痰祛湿活血方治疗NASH的作用机制,并通过实验进行验证。
1 资料与方法
1.1 数据库和生信分析软件 中药数据库(TCMSP),GeneCards数据库;STRING数据库;韦恩图软件;DAVID软件;Cytoscape软件(Version3.6.1)。
通过分析对本单位在国外工程施工过程中需要加大对施工设备进行保养、管理过程中面临的困境以及设备维修方面存在的现状,找到产生相关现象的原因,通过合理的措施更好地管理和使用相关的设备,充分发挥设备的最大实际效用。
但实际上,它的出现让英国人拥有了最为趁手的生产工具,农场主、工人、军人、市政公务员,几乎社会的每个方面都出现了它的身影,而在此之后直到2017年,它伴随着无数次的技术升级,逐渐变得文明起来,甚至衍生出了独立的车系。卫士是最为我们所熟悉的名字,但在卫士这个称谓诞生之前,它就是路虎,路虎就是它。
1.2 化痰祛湿活血方活性成分及靶点基因 以化痰祛湿活血方中泽泻、决明子、郁金、丹参、海藻、柴胡、山楂、水飞蓟等为关键词在TCMSP中进行成分及相应靶点的查询,以口服生物利用度(OB)≥30%和类药性(DL)≥0.18为条件进行筛选。将筛选出的化痰祛湿活血方药物活性成分群,输入Genecards数据库收集整理,获取化痰祛湿活血方的潜在治疗靶点。
CRD法虽然已经被广泛地应用于大断面浅埋偏压隧道的建设,但仍存在一定的技术问题,主要包括施工指导问题和防排水技术问题,这或多或少地导致大断面浅埋偏压隧道建设存在一些问题。
智慧园区建设需要遵循相应指导原则和标准,规范建设要求,优化智慧园区建设过程,为后续的智慧园区规划和管理提供可靠依据。智慧园区建设,其中集合了园区信息化基础设施建设、智能感知系统建设、支撑平台建设、传输网络建设以及软件服务建设等内容[5]。
1.4 网络构建与分析 将化痰祛湿活血方治疗NASH潜在靶点基因输入STRING数据库,建立PPI网络图。将PPI网络图导入Cytospace3.6.1软件,利用ClueGo插件进行免疫过程分析。利用CytoHubba进行权重分析,得出化痰祛湿活血方作用靶点图。
1.3 获取NASH基因靶点 利用Genecards数据库收集NASH基因靶点。
“夫缀文者情动而辞发”不少课文蕴涵着丰富的情感,有强烈的感染力,能够引起学生的共鸣。教师应深入细读文本,引导学生熟读体会,与文本产生共鸣,为情所动,让心中涌动的情感不吐不快。如教学《地震中的父与子》时,教师结合洛杉矶地震、四川大地震的有关报道和影片,引出小练笔:此时,眼前是——(学生:无边的黑暗),耳边不停传来——(学生:孩子的哭声),一个7岁的孩子,他害怕吗?他恐惧吗?他在想什么?他能干什么?请你写一写。
2.3 GO分析和KEGG通路富集分析 将372个关键基因导入DAVID数据库进行通路富集分析,得出KEGG通路106条,从前15项选择11项与NASH相关联大的信号通路,如Non-alcoholic fatty liver disease,Adipocytokine signaling pathway,TNF signaling pathway等。MF富集分析:蛋白质结合、受体结合、转录因子结合;BP富集分析:炎症反应、免疫反应、凋亡过程;CC富集分析:细胞外区域、细胞外空间、细胞外体等; EnrichedGO分析图(图1)。
1.6.1 药物 化痰祛湿活血方(泽泻、决明子、郁金、丹参、海藻、柴胡、山楂、水飞蓟)由四川新绿药业科技发展股份有限公司提供。多烯磷脂酰胆碱胶囊:赛诺菲(北京)制药有限公司,批号:5JD070。
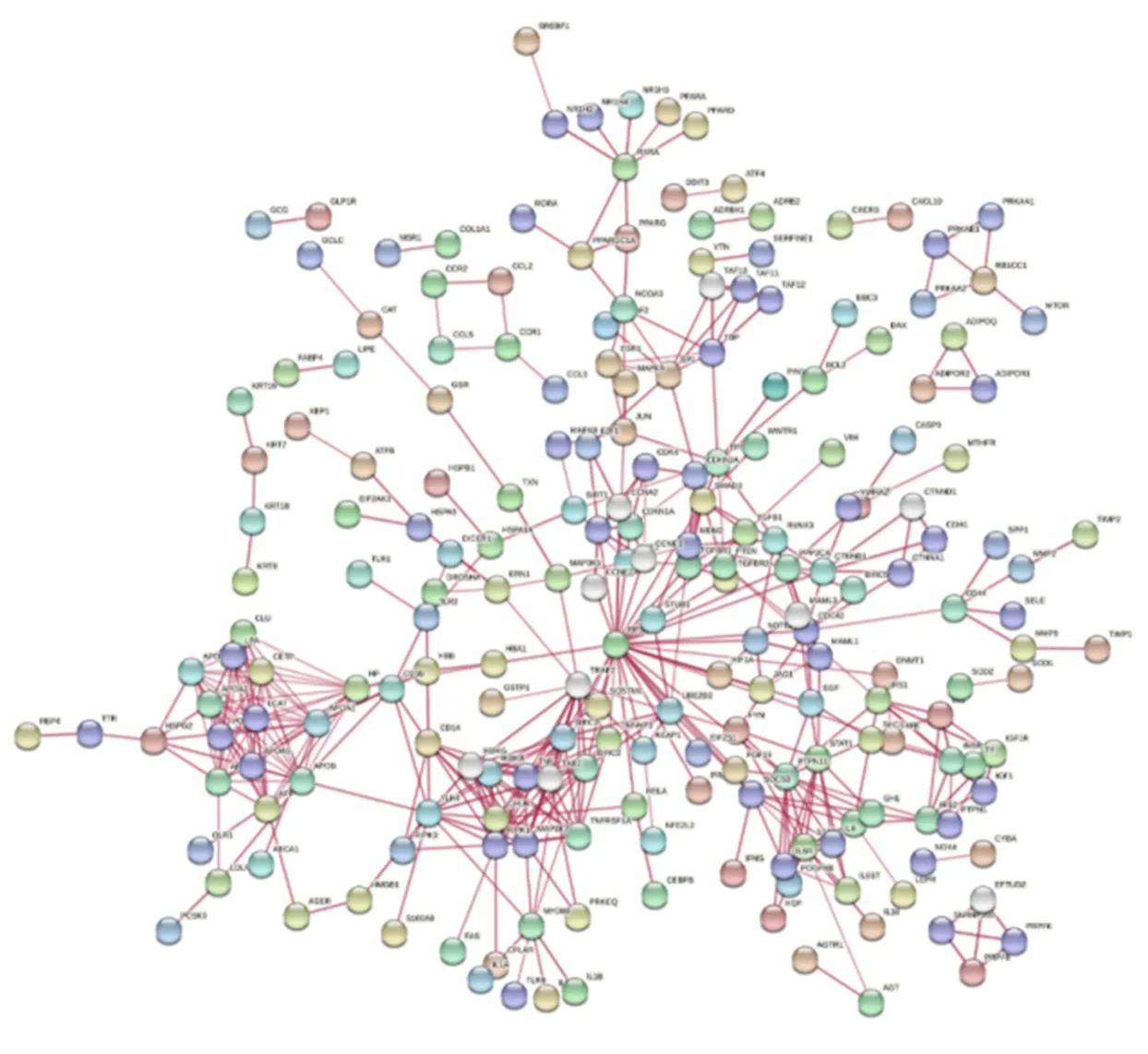
2.4 建立PPI(蛋白质-蛋白质相互作用)网络图 将关键基因输入String数据库,设定Homo sapiens,再利用Basic settings下的参数设定条件,选取“physical network”、“confidence”、“Textmining”、“Experiments”、“Databases”、“high confidence(0.700)”等参数,获得化痰祛湿活血方蛋白相互作用网络示意图(图2)。
2.5 网络构建分析 采用Cytoscape构建复方-靶点免疫机制图、复方-作用靶点网络图。将化痰祛湿活血方PPI导入Cytoscape软件,利用ClueGo 插件进行免疫过程分析,置信度设定为
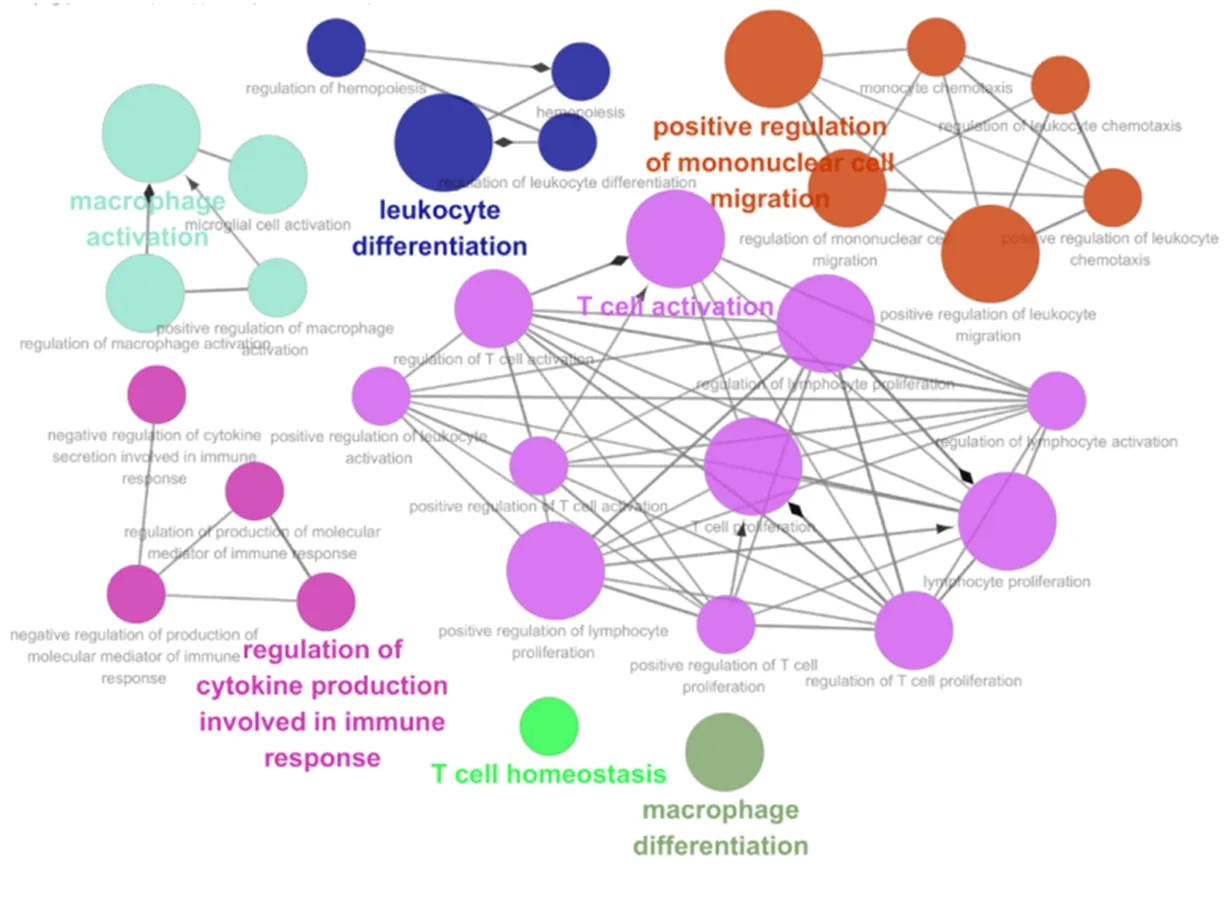
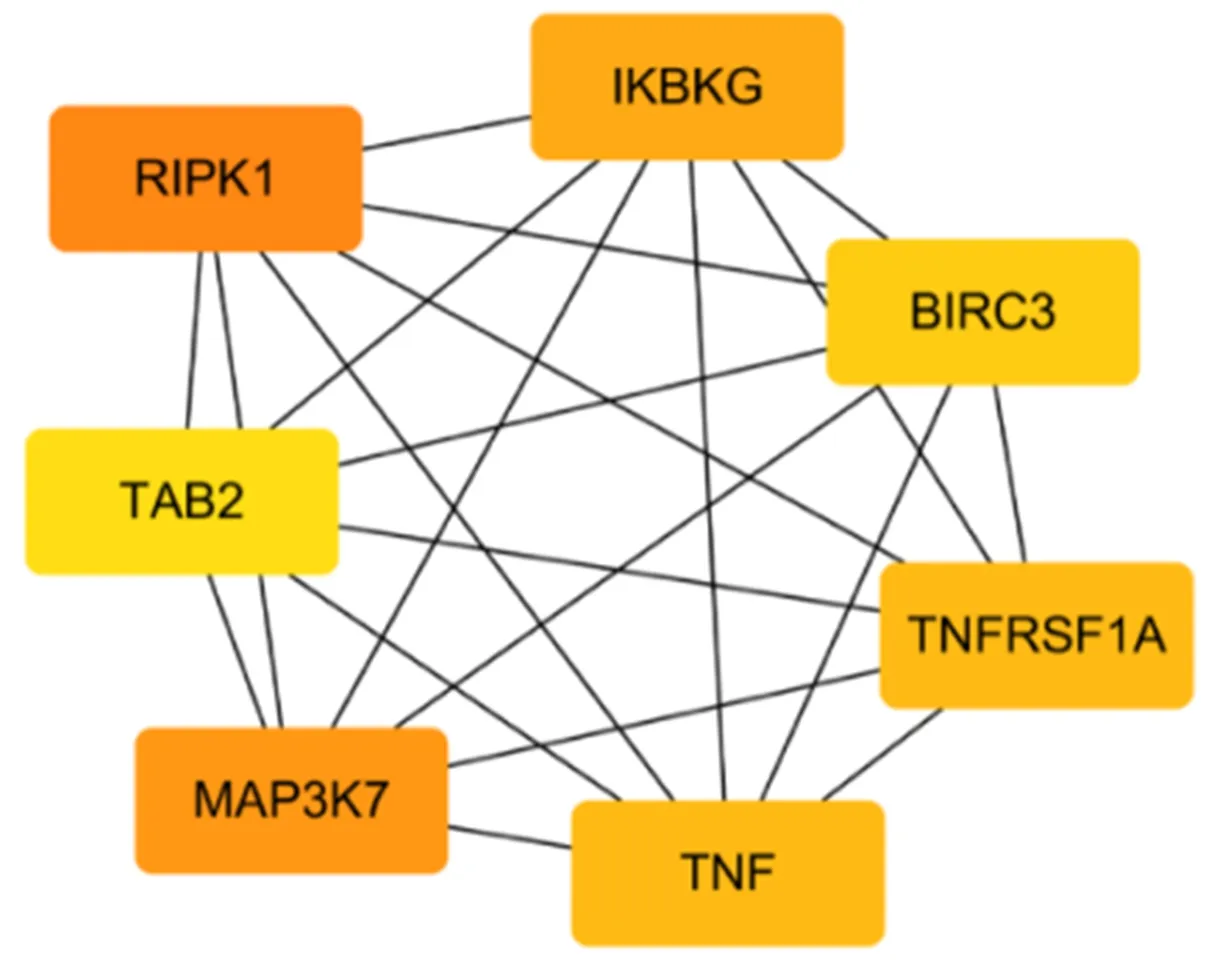
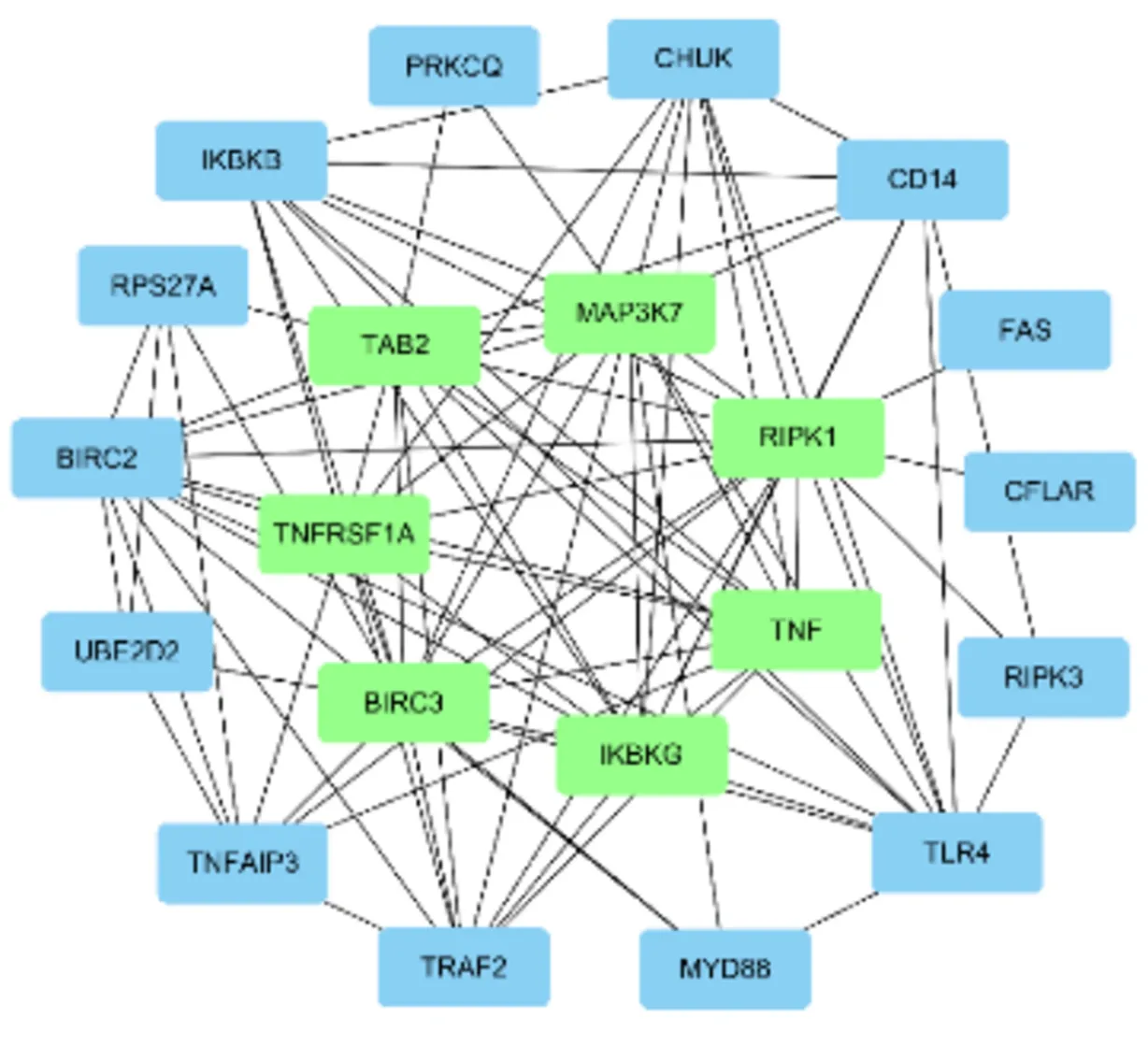
≤ 0.05,获取化痰祛湿活血方调控NASH的免疫机制过程分析图(图3)。从图中发现化痰祛湿活血方可以调控细胞因子分泌、T细胞活化、单核/巨噬细胞活化等。将PPI导入Cytoscape软件,并利用cytoHubba插件进行权重分析,分析出得分最高前20位基因,组成化痰祛湿活血方权重分析图(图4)。化痰祛湿活血方治疗NASH的重点基因:TNF、IKBKG、MAP3K7、RIPK1等。使用cytoHubba对重点基因进行关联分析得出化痰祛湿活血方作用靶点的示意图(图5)。结合重点通路构建出关键基因-作用靶点-通路网络图(图6)。
1.6.4 造模及处理 适应喂养1周后,按NASH大鼠模型制备方法:空白组给予普通饲料,用药组给予高脂饲料喂养9周。模型组给予生理盐水1 ml·100 g
·d
灌胃,中药组以化痰祛湿活血方灌胃,高剂量组为5.04 g·100 g
·d
,中剂量组为2.52 g·100 g
·d
,低剂量为1.26 g·100 g
·d,西药组以多烯磷脂酰胆碱胶囊混悬液灌胃,给药剂量0.028 5 g·100 g
·d
。10周后,处死大鼠,采集血液、肝组织。运用Western blot法检测肝组织PI3K、p-Akt、p- NF-κβ蛋白的表达。同时检测各组大鼠肝组织中PI3K、AKT、NF-κBCs mRNA相对表达量。
1.5 基因功能富集分析与生物过程分析 利用DAVID数据库对化痰祛湿活血方中核心作用靶点进行KEGG通路分析和GO功能分析。
1.7 统计学方法 采用SPSS 19.0软件,计量资料用均数±标准差表示,符合正态分布用
检验,不符合正态性分布用秩和检验;计数资料比较采用卡方检验。
<0.05为差异有统计学意义。
2 结果
2.1 化痰祛湿活血方药物成分及靶点筛选 把筛选出的化痰祛湿活血方药物活性成分群,输入Genecards数据库收集整理,获取化痰祛湿活血方活性成分作用的靶点基因3 149个。
2.2 NASH靶点筛选 以“non-alcoholic steatohepatitis”为关键词,从人类基因数据库(GenenCards)筛选出NASH基因靶点580个。将NASH获取的基因靶点与化痰祛湿活血方活性成分基因靶点,剔除重复后取交集,得出化痰祛湿活血方治疗NASH潜在的基因靶点372个。
密切观察患者尤其是使用了镇静剂患者的双侧瞳孔直径、形状、对光反射及神志变化,肌力变化和意识状态,及早发现脑出血及脑梗塞等并发症[7]。
1.6 实验验证

1.6.2 试剂及仪器 由ABCAM公司提供的Anti-PΙ3Kinase p85抗体(ab180967)、Anti-AKT1/2抗体(ab188099)、Anti-AKT1抗体(ab66134)、Anti-NF-κBp65抗体(ab16502)。电泳仪(BIO-RAD,美国)。
1.6.3 动物 72只SPF级SD雄性大鼠,体质量(150±10)g,购于北京维通利华实验动物技术有限公司,生产许可证号:SXYK(豫)2015-0005。随机分为空白组、模型组、中药组(化痰祛湿活血方低、中、高剂量组)及西药组(多烯组),每组12只。实验过程遵照河南中药药大学实验动物管理与使用准则进行。
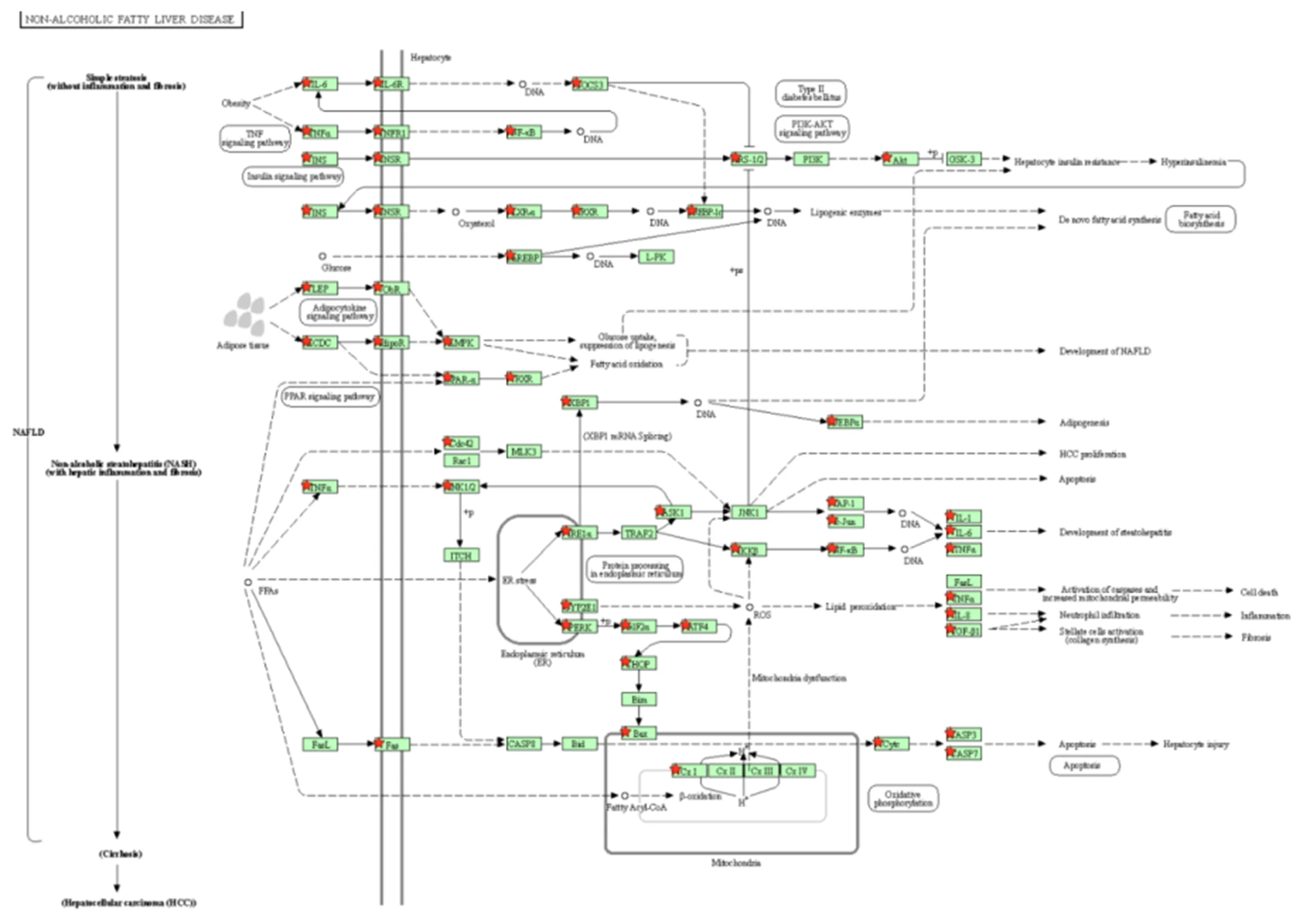
2.6 化痰祛湿活血方对NASH模型大鼠的影响
2.6.1 化痰祛湿活血方对NASH模型大鼠肝组织蛋白表达的影响 与空白组比较,模型组大鼠肝组织中PI3K、p-Akt蛋白表达明显降低,p-NF-κB蛋白表达明显升高(
均<0.05);与模型组比较,高剂量组、中剂量组、低剂量组PI3K蛋白表达明显降低(
均<0.05),各治疗组大鼠肝组织p-Akt蛋白表达明显升高(
值均<0.05),p-NF-κB蛋白表达明显降低(
均<0.05);与多烯组比较,高剂量组PI3K、p-Akt蛋白表达显著增加,p-NF-κB蛋白表达明显降低(
均<0.05),(图7)。
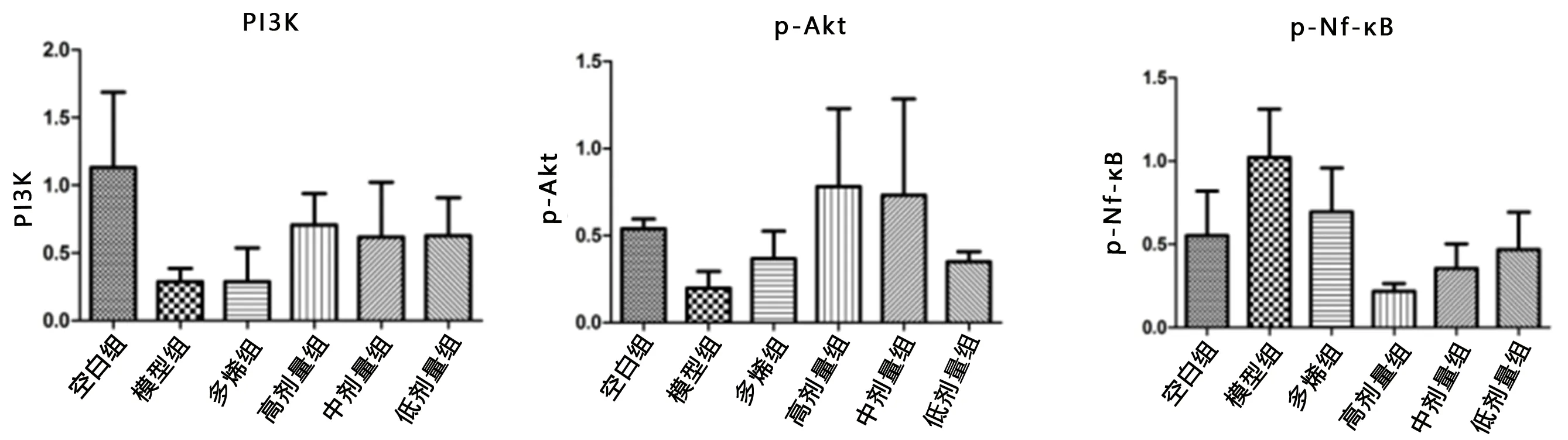
2.6.2 化痰祛湿活血方对NASH模型大鼠肝组织mRNA表达的影响 与空白组比较,模型组PI3K、AKT mRNA显著下降,NF-κB mRNA表达升高(
均<0.05);与模型组比较,中药高剂量组、多烯组PI3K、AKT mRNA表达升高(
均<0.05),中药高剂量组、中剂量组、低剂量组NF-κB mRNA表达降低(
均<0.05);与多烯组比较,中药高剂量组PI3K、AKT mRNA表达均升高(
均<0.05), NF-κB mRNA表达降低(
<0.05),(图8)。
基于野外调查,按代表性植被的分布在三处边坡中选取草本植被、草灌植被、草灌乔植被各两个样地,样地大小按1 m2(草本植被)、10 m2(草灌植被)和100 m2(草灌乔植被)设置,以S形在同一样地内采取5个样品。采集0~10 cm土层原状土,装入铝盒内带回实验室,风干后,沿土壤自然结构面人工剥成直径为10~12 mm的小土块,并剔除土中的植物根系及小石粒。
3 讨论
课题组多年的实践证实,化痰祛湿活血方不但可以改善NASH患者的临床症状,而且还可以改善NASH模型大鼠的指标。如化痰祛湿活血方可以改善NASH大鼠血清的ALT、AST、TG、TC等指标
;上调NASH大鼠的脂联素及其受体的表达
;激活NASH大鼠的ADPN/AMPK/ACC信号通路,影响脂肪酸的β氧化及合成
;可以下调NASH大鼠TNF-α、IL-1α、IL-6炎性因子的表达
;下调NASH大鼠MCp-1、PTGS2、NOS2、MDA氧化应激相关因子的表达
;调控炎症因子如TNF-α、IL-1α、IL-6、IL-10,改善脂肪变细胞炎症
。
网络药理学结果显示,化痰祛湿活血方活性成分137个,获得成分的靶点基因为3 149个,与NASH 靶点基因取交集,获得关键基因为372个。KEGG富集分析结果显示调控Non-alcoholic fatty liver disease,Adipocytokine signaling pathway,TNF signaling pathway等信号通路为化痰祛湿活血方治疗NASH潜在的作用机制。其中在Non-alcoholic fatty liver disease信号通路中包含AKt和NF-KappaB。蛋白激酶B/Akt是一种丝氨酸/苏氨酸激酶,主要位于细胞质内,是一种参与多种信号转导的信号蛋白。Akt是生长因子、细胞因子及其它刺激信号传导的中心节点,它将与PI3K脂质激酶偶联的受体与细胞合成代谢联系起来,它细胞内的活性由可逆磷酸化和分子内脂质调节。AKt属于AGC丝氨酸/苏氨酸激酶家族,具有共同的结构组织和调控机制
。在哺乳动物细胞中,AKt被表达为3种亚型,分别为AKt1、AKt2、AKt3
。AKt在不同的刺激下积累在细胞核中,细胞核中含有PI3K、PDK1和mTORC2,这些都是磷酸化AKt所必需的
。功能上,Akt将与PI3K偶联的细胞表面受体的信号转导途径控制细胞合成代谢过程
。Akt为PI3K/Akt信号传导通路的中心环节,受PI3K的磷酸化调控,为PI3K信号传导的下游靶激酶,被激活后参与介导复杂多样的生物学效应,PI3K-Akt signaling pathway 是insulin signaling pathway中的主要通路,如图8所示。而且有研究证明PI3K/Akt通路的障碍易导致胰岛素抵抗,促进非酒精性脂肪性肝病的发展
。Akt含有多个磷酸化调节位点,Ser473的磷酸化与Akt的活动密切相关。而我们通过大鼠实验验证了化痰祛湿活血方能上调肝组织中Ser473蛋白的表达,从而达到改善NASH大鼠肝脏炎症反应
。核因子(NF)κB(NF-κB)是一种调控免疫和炎症信号通路的转录因子,作为重要的调控因子,调节多种参与炎症反应相关基因的转录。哺乳动物中NF-κB家族有5个成员组成,分别是Rel(cRel)、RelB、p65、p50、p52 ,p65和p50为异源二聚体,p50和p52为同源二聚体。NF-κB通过不同的二聚体形式对不同基因的表达进行精细的调节。它的激活通过两种信号途径发生,包括经典途径和非经典途径。经典途径是各种炎症信号的诱发,并导致快速和短暂的NF-κB活化。在细胞核中,NF-κB蛋白激活可控制先天免疫和炎症
。活化后的NF-κB不但可以影响多种细胞因子基因的转录与调控,而且还可以诱导多种炎症因子的释放激发炎症反应,如介导IL-1、IL-6、TNFa等促炎细胞因子。动物实验和临床中发现,肝脏NF-κB的表达是增加的,活化的NF-κB通过信号转导通路介导肝脏炎症
。因此抑制NF-κB的活化,可以防治NASH发生与发展。我们也通过动物实验发现NASH大鼠中p-NF-κBp65表达是增加的,应用化痰祛湿活血方可以抑制肝脏组织中p- NF-κBp65的表达,从而达到防治NASH的作用
。
通过PPI网络发现,节点数380,边数466,根据连接度进行排列,高连接度的靶点依次为TLR4、TNF、MAP3K7、IKBKB、IL-6、IL-10、MAP3K5等。Toll-like receptor4(TLR4)主要位于细胞膜表面,一般在肝细胞、库弗细胞、星状细胞、肝窦内皮细胞以及脂肪细胞中表达,能识别多种损伤相关分子以及细菌来源的脂多糖等,诱发炎症产生
。TNF是体内最经典炎症因子,可被单核/巨噬细胞等免疫细胞分泌,并被认为是导致NASH发生的重要细胞因子
。
化痰祛湿活血方对NASH免疫调控机制图提示,化痰祛湿活血方对NASH免疫具有广泛的调节作用,可以调控巨噬细胞、T细胞的活化以及对免疫应答细胞因子的调节等等。肝脏的巨噬细胞分为两种,一种是肝脏固有巨噬细胞(枯否细胞);另一种是肝脏损伤时肝外来源的单核/巨噬细胞
。巨噬细胞可以分泌促炎性细胞因子加重肝脏的损伤、促进肝细胞凋亡。也有研究发现肝内巨噬细胞趋化因子受体2是NASH发生的重要因子
。肝脏巨噬细胞参与了炎症、纤维化的发生、发展,因此调控肝脏巨噬细胞的活化和表型可以改善肝脏疾病。如有研究发现影响肠道屏障可以减少肝脏巨噬细胞的活化,缓解NAFLD病情
。T细胞又称T淋巴细胞,在体内发挥细胞免疫作用,按照其不同的免疫功能可以分为3个亚群,辅助性T细胞、调节性T 细胞和细胞毒性T细胞。肝脏本身也是一个巨大的免疫器官,含有大量免疫细胞其中包括调节性T 细胞(Treg),有研究报道在NAFLD患者或者动物体内Treg细胞的含量是下降的
。而Th17/Treg细胞参与了炎症反应和免疫抑制的平衡,当该平衡被打破,Th17将加重肝脏炎症反应,促进NASH的发生
。
化痰祛湿活血方作用靶点图显示,肿瘤坏死因子-α(TNF-α)是化痰祛湿活血方重要的调控靶标。TNF-α主要是由单核-巨噬细胞分泌的促炎性细胞因子,在机体炎症免疫过程中起到促进和扩大炎症的作用
。在慢性肝脏疾病以及NASH中,由于持续的炎症损伤导致了TNF-α的持续表达。在非酒精性脂肪性肝炎患者肝脏中TNF-α表达水平增加。研究显示TNF-α水平升高与NAFLD和NASH相关纤维化的发展密切相关
。另一方面TNF-α通过不同方式参与脂质过氧化与氧化应激,诱发肝脏炎症反应,诱导其他炎症因子释放,使体内炎症反应失衡
。
[1] 中华医学会肝病学分会脂肪肝和酒精性肝病学组,中国医师协会脂肪性肝病专家委员会.非酒精性脂肪性肝病防治指南(2018年更新版)[J].实用肝脏病杂志,2018,21(2):177-186.
[2] 华鹏,郭薇,薛敬东,等.健脾化浊消脂方治疗非酒精性脂肪性肝炎临床疗效评价[J].中西医结合肝病杂志,2020,30(5):408-410.
[3] 李静,雷晓红,唐洁婷,等.非酒精性脂肪性肝炎治疗性试验终点的定义改进[J].肝脏,2020,25(2):107-110.
[4] 赵文霞,张丽慧,崔健娇.化痰祛湿活血方对非酒精性脂肪性肝炎大鼠炎症损伤及纤维化的干预作用[J].中华中医药学刊,2017,35(9):2229-2231.
[5] 赵文霞,闫乐,段荣章.化痰祛湿活血方对非酒精性脂肪性肝炎大鼠肝脏病理的影响[J].中医杂志,2014,55(14):1223-1226.
[6] 赵文霞,闫乐,段荣章.化痰祛湿活血方对非酒精性脂肪性肝炎大鼠脂联素及其受体的干预研究[J].中华中医药杂志,2014,29(9):2975-2977.
[7] 赵文霞,闫乐,邵明义,等.化痰祛湿活血方对非酒精性脂肪性肝炎大鼠ADPN/AMPK/ACC通路的影响[J].临床肝胆病杂志,2017,33(5):932-936.
[8] 赵文霞,崔健娇,张丽慧.化痰祛湿活血方对非酒精性脂肪性肝炎大鼠相关炎性因子的影响[J].中华中医药杂志,2017,32(4):1721-1723.
[9] 赵文霞,许顺畅.化痰祛湿活血方对非酒精性脂肪性肝炎大鼠相关氧化应激因子的影响[J].辽宁中医杂志,2017,44(5):1100-1102.
[10] 刘君颖,张丽慧,桑锋,等.化痰祛湿活血方对脂肪变L02细胞促炎抑炎因子的影响[J].中西医结合肝病杂志,2019,29(5):395-398.
[11] Pearce LR,Komander D,Alessi DR.The nuts and bolts of AGC protein kinases[J]. Nat Rev Mol Cell Biol,2010,11(1): 9-22.
[12] Toker A, Marmiroli S.Signaling specificity in the Akt pathway in biology and disease[J]. Adv Biol Regul,2014,55: 28-38.
[13] Yudushkin I.Control of Akt activity and substrate phosphorylation in cells[J].IUBMB Life,2020,72(6):1115-1125.
[14] Manning BD,Toker A.AKT/PKB signaling: navigating the netwo-rk[J].Cell,2017,169(3):381-405.
[15] 王宁,李京涛,常占杰,等.PI3K/AKt信号通路在胰岛素抵抗所致非酒精性脂肪性肝病中作用机制的研究进展[J].胃肠病学和肝病学杂志,2019,28(11):1308-1311.
[16] 赵文霞,张丽慧,崔健娇,等.化痰祛湿活血方干预非酒精性脂肪性肝炎大鼠ADPN/AKT/NF-κB通路的研究[J].中国中西医结合杂志,2017,37(8):961-967.
[17] Betzler AC, Theodoraki MN, Schuler PJ,
. NF-κB and its role in checkpoint control[J]. Int J Mol Sci,2020,21(11):3949.
[18] Cai D, Yuan M, Frantz DF,
. Local and systemic insulin resistance resulting from hepatic activation of IKK-beta and NF-kappaB[J].Nat Med,2005,11(2): 183-190.
[20] Roh Y S,Seki E. Toll-like receptors in alcoholic liver disease,non-alcoholic steatohepatitis and carcinogenesis[J]. J Gastroenterol Hepatol,2013,28,1(1):38-42.
[21] 栾梅,邱雅慧,栾博,等.祛脂调肝中药对非酒精性脂肪SD大鼠瘦素和肿瘤坏死因子-α的影响[J].中国老年学杂志,2018,38(16):4015-4017.
[22] Sun YY, Li XF, Meng XM,
. Macrophage phenotype in liver injury and repair[J]. Scand J Immunol,2017,85(3):166-174.
[23] Wynn TA,Chawla A, Pollard JW. Macrophage biology in development, homeostasis and disease[J]. Nature,2013,496(7446):445-455.
[24] Krenkel O, Tacke F. Liver macrophages in tissue homeostasis and disease[J].Nat Rev Immunol,2017,17(5):306-321.
[25] 金岳,胡义扬,冯琴.调节性T细胞与非酒精性脂肪性肝病[J].中国免疫学杂志,2019,35(11):1394-1398.
[26] Tang Y, Bian Z, Zhao L,
. Interleukin-17 exacerbates hepatic steatosis and inflammation in non-alcoholic fatty liver disease[J]. Clin Exp Immunol,2011,166(2):281-290.
[27] 孙婷婷,李京涛,魏海梁,等.TNFα/NF-κB信号通路调控非酒精性脂肪性肝病的研究现状[J].临床肝胆病杂志,2019,35(9):2095-2098.
[28] 陈艳珍,陈成良,洪宇,等.非肥胖型非酒精性脂肪性肝纤维化、肝硬化的发病机制及危险因素[J].临床肝胆病杂志,2018,34(10):2227-2231.
[29] Lopetuso LR, Mocci G, Marzo M,
. Harmful effects and potential benefits of anti-tumor necrosis factor(TNF)-α on the liver[J]. Int J Mol Sci,2018,19(8):2199.
[30] 张子龙,黄樱硕,范煜东,等.血脂康对非酒精性脂肪性肝病大鼠肝炎症及氧化应激影响[J].临床军医杂志,2018,46(6):605-609.
