基于肠道菌群探讨黄精水提物改善高脂高糖饮食所致大鼠认知功能损伤的作用机制
2022-03-25王洋韩玉生赵福红宫铭海周忠光杨波
王洋,韩玉生,赵福红,宫铭海,周忠光✉,杨波
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.齐齐哈尔医学院,黑龙江 齐齐哈尔 161000)
高脂高糖饮食已经成为现代社会的主要饮食结构。长期或过量高脂高糖饮食可诱导肥胖,出现葡萄糖稳态失衡及血脂异常的代谢紊乱。同时,高脂高糖饮食还能够破坏海马形态、诱导神经细胞炎症改变并伴随着认知功能损伤[1]。已有研究表明高能量饮食会增加中枢神经系统疾病的发病率,如易感阿尔茨海默病[2]、帕金森病等[3]。
肠道微生物群特定物种丰度的变化与肥胖、代谢异常密切相关[4],且肠道微生态失调会引发慢性低度炎症[5]。脂多糖(LPS)是革兰氏阴性菌外膜上最主要的成分,也被称为内毒素,是炎症中主要的致病因子[6]。肠道微生物失衡对炎症状态的激活,部分是由肠道通透性改变介导的,大量LPS 聚集增加了肠道和血脑屏障的渗透性,在肠壁黏膜损伤环境下,LPS 可能“渗漏”到血液循环中,导致循环中LPS的浓度增加,从而刺激Toll 样受体4(Toll-like-receptor 4,TLR-4),增加促炎细胞因子的浓度并导致多种炎症性病变的发生[7],亦可引起神经炎症、大脑神经退行性样改变[8]。TLR4/NF-κB信号通路是LPS介导的信号传导通路中最重要的下游通路[9],可上调NLRP3炎症小体的表达,分泌释放出众多内源性生物活性炎症因子,发挥其毒性作用[10]。因此,高脂高糖饮食诱导肥胖引起的肠道微生态失调和大脑神经炎症之间的联系可能与认知功能损伤有关。肠道菌群组成及其代谢产物调节宿主代谢、行为和认知功能,与神经炎症、神经退行性变的发生、发展密切相关,肠道菌群已成为防治疾病的新靶点。
黄精取自百合科植物滇黄精、黄精或多花黄精的干燥根茎,属于药食同源类中药材。具有补气养阴、健脾润肺、益肾之功效,其主要化学成分包括黄酮类、皂苷类、多糖类、生物碱类化合物。大量研究证明,黄精具有广泛的药理学活性,包括抗炎[11]、抗衰老[12]、降血糖血脂[13]、免疫调节[14]、抗疲劳[15]及神经保护[16]作用。本研究通过观察黄精水提物对高脂高糖饮食诱导认知功能损伤大鼠肠道微生物群、肠道黏膜屏障以及认知行为的影响,评估黄精水提物是否能通过改变肠道微生物群而影响肠-脑轴相互作用,进而改善高脂高糖大鼠认知功能的作用机制。
1 材料与方法
1.1 实验动物
SPF 级SD 雄性大鼠40 只,体质量(200 ± 20)g,由黑龙江中医药大学实验动物中心提供,动物许可证号:SCXK(黑)2021-005。所有动物置于SPF 级动物实验室,温度(22±2)℃,相对湿度50%~60%,12 h光照/黑暗环境,自由摄食、饮水。适应性喂养1 周后,正常对照组大鼠给予基础饲料,造模大鼠给予高糖高脂饲料,主要成分包括63.5%基础饲料,15%猪油,20%蔗糖,1.3%胆固醇,0.2%胆盐。
1.2 药品与试剂
水合氯醛(四川佰春科技有限责任公司,H37022603);4%多聚甲醛固定液(上海碧云天生物技术有限公司,批号:P0099);2.5%戊二醛固定液(上海远慕生物科技有限公司,批号:DE0055);大鼠脂多糖(LPS)ELISA 试剂盒(江苏酶免实业有限公司,批号:MM-0647R1);TLR4 抗体、NF-κBp65 抗体、NLRP3抗体、Caspase-1抗体(万类生物技术有限公司,批号:WL00196、WL02169、WL02635、WL03450);羊抗兔IgG-HRP(万类生物技术有限公司,批号:WLA023);内参抗体β-actin(万类生物技术有限公司,批号:WL01372);苏木素、伊红染色液(上海碧云天生物技术有限公司,批号:C0107、C0109)。
1.3 仪器
WMT-100S Morris 水迷宫视频分析系统(成都泰盟软件有限公司);DZKW-S-4 型电热恒温水浴锅(天津天泰仪器有限公司);H1850 台式高速离心机(北京宏达恒业科技有限公司);梅特勒-托利多AB204-N 型电子天平(上海世义精密仪器有限公司);VE-180 微型垂直电泳槽、VE-186 转移电泳槽、5200 型化学发光凝胶成像仪(上海天能科技有限公司);HS-S7120-B型石蜡切片机(沈阳恒松科技有限公司);BMG SPECTRO star Nano 高通量微孔板紫外分光光度计(香港伯齐科技有限公司);透射电镜(HITACHI,HT7700,Japan)。
1.4 黄精水提物的制备
多花黄精粉末500 g浸入2 L蒸馏水中浸泡1 h,煮沸后煨40 min,纱布过滤。将药渣与1 L蒸馏水混合,煮沸后再煨40 min,再次纱布过滤。将2次获得的药液混合,混合滤液置于旋转蒸发器中60 ℃浓缩至500 mL,最终生药浓度为1 g/mL。
1.5 动物分组、造模及给药
40只SD 大鼠适应性喂养1 周后,按体质量随机分为正常对照组(Control 组)、模型组(Model 组)、黄精水提物低剂量组(HJL 组)和黄精水提物高剂量组(HJH组),每组10只。正常对照组大鼠自由进食基础饲料,其余组大鼠自由摄食高脂高糖饲料以建立认知功能损伤模型,共喂养12 周。造模结束后各组大鼠开始行灌胃治疗,每日上午HJL、HJH组大鼠分别给予1、1.5 g/kg黄精水提物灌胃,Control 组和Model 组大鼠给予生理盐水灌胃,共干预6周。
1.6 标本采集与处理
行为学检测结束后,所有大鼠禁食水过夜,次日给予10%水合氯醛腹腔注射麻醉,麻醉起效后置于冰上操作,用手术直剪刀沿肋弓水平至双侧腋中线后,向上剪开后返起胸壁打开胸腔,钝性剥离直至暴露心脏,心脏取血,于室温静置2 h 后,3 000 r/min 离心取上清,分装后于-80 ℃保存。左心室内灌注4 ℃预冷的PBS 缓冲液,眼科剪于右心耳处剪开一个小口,直至心脏流出无血色液体为止。断头取脑,剥离出完整脑组织,于左侧大脑半球分离海马组织,置于冻存管内,迅速液氮冷冻,随后转移至-80 ℃冰箱保存,用于Western Blot 分析。右侧大脑半球小心分离海马CA1 区,取约1 mm3组织块,置于2.5%戊二醛固定液中4 ℃固定,用于透射电镜分析。取无粪便充盈的结肠组织,用生理盐水冲洗干净,置于4%多聚甲醛固定液中,4 ℃冰箱内存放,待用。取结肠内3~4粒粪便颗粒,放入无菌EP管中,立即速冻并于-80 ℃冰箱中低温保存。
1.7 检测指标
1.7.1 行为学检测
采用Morris 水迷宫(MWM)检测大鼠学习记忆能力,评估其认知功能。MWM 使用黑色圆形水池(深度60 cm,直径150 cm),将平台固定于第二象限,水池中注入自来水,其水位高于平台2 cm,水温控制在22~24 ℃。将大鼠头朝池壁放入水中,随机选取入水点,检测时间60 s。记录大鼠找到水下平台时间,如果60 s内找到,则让动物在平台上停留10 s休息,若未找到平台,则引导动物到平台,停留10 s。每只动物每日训练3次,每次训练间隔15~20 min,连续4 d。视频跟踪系统记录动物位置、游泳距离及时间。最后一次训练结束后第2天,撤除平台,将动物由原先平台象限的对侧放入水中,记录动物在60 s内穿越原平台象限潜伏期、次数、总路径和平均速度等。以此作为检测动物空间学习、记忆能力指标。
1.7.2 体质量监测从造模开始直至大鼠灌胃结束,每周称重1 次,记录其体质量变化,以此调整药物灌胃剂量。
1.7.3 血清生化指标检测
采用己糖激酶法检测血清葡萄糖(GLU)含量,酶比色法检测血清总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)含量,比色法检测血清甘油三酯(TG)含量,采用全自动生化分析仪进行测定。
1.7.4 组织形态学观察
各组大鼠结肠经过固定、梯度乙醇脱水、透明、浸蜡、包埋后制作成蜡块。切片机制备5 μm结肠组织切片,进行苏木素-伊红(HE)染色,在光学显微镜下详细观察结肠组织病理变化。
大鼠海马组织经过1%锇酸/1.5%亚铁氰化钾后固定,PBS漂洗,梯度酒精-丙酮脱水,无水丙酮及环氧树脂618 包埋剂浸透,包埋,修块,超薄切片机切100 nm组织切片,醋酸铀、柠檬酸铅染色,于透射电镜下观察并摄片。
1.7.5 血清及粪便LPS测定
采用ELISA 法检测血清中及粪便中LPS 的浓度水平,严格按照试剂盒说明操作,最终于562 nm 处测量吸光度值,制备标准曲线,计算样品浓度。
1.7.6 粪便16s RNA测序
从每个粪便样本中提取DNA,之后PCR 扩增。针对细菌16s rRNA 的V3~V4 区设计引物,利用正向引物(5′-3′):CCTACGGGNGGCWGCAG(341 F)和反向引物(5′-3′):GACCTACHVGGGTATCTAATCC(806 F)扩增,继而通过Illumina PE250测序平台进行测序和数据处理,后续进行生物信息学分析。
1.7.7 蛋白免疫印迹法(Western Blot 法)检测大鼠海马TLR4、NF-κBp65、NLRP3、Caspase-1 蛋白的表达
取大鼠海马组织样本约0.2 g,用RIPA 裂解液、PMSF 及磷酸化蛋白酶抑制剂提取总蛋白。取蛋白质40 μg 进行SDS-PAGE 凝胶电泳,利用PVDF 膜转膜。经过BSA 封闭后,一抗β-actin(1∶1 000)、TLR4(1∶500)、P-NF- κBp65(1∶500)、NLRP3(1∶500)、Caspase-1(1∶500),4 ℃孵育过夜,经漂洗、二抗孵育后,ECL 发光显色,系统成像。采用Image J 进行蛋白条带灰度值定量分析。
1.8 数据处理
采用Graphpad Prism 8软件进行数据统计分析,数据以平均值± 标准误(Mean ± SEM)表示。组间差异采用One-way ANOVA 方差分析,两组间比较采用t检验。以P<0.05表示差异具有统计学意义。
2 结果
2.1 黄精水提物对高脂高糖饮食大鼠体质量的影响
造模前,各组大鼠体质量无明显差异。喂食高脂高糖饲料后,大鼠体质量逐渐增加,发展为肥胖大鼠。随喂养时间的延长,其体质量明显增加,肥胖情况更加突出(P<0.05 或P<0.01),见图1。给予6 周黄精水提物干预治疗后,在干预期内观察到,在不影响能量摄入的情况下,HJL、HJH 组大鼠体质量增幅低于Model 组大鼠,并呈剂量依赖性,提示黄精水提物可以有效抑制高脂高糖饮食所致的大鼠体质量增加,见图2。

图1 不同时间点各组大鼠体质量变化图

图2 各组大鼠体质量变化图
2.2 黄精水提物对高脂高糖饮食大鼠血糖、血脂水平的影响
与Control 组比较,Model 组大鼠血清中GLU 含量明显升高(P< 0.01),给予黄精水提物干预后,HJH组及HJL 组大鼠血清GLU 含量有所降低(P< 0.05 或P< 0.01),但未恢复至正常范围内。结果表明黄精水提物对高脂高糖饮食诱导大鼠葡萄糖稳态失衡具有一定调节作用。与Control 组相比,Model 组大鼠血清TC、TG、LDL-C 含量升高(P< 0.05 或P< 0.01),HDL-C 含量显著下降(P< 0.01),提示高脂高糖饮食可导致大鼠血脂紊乱。经黄精水提物干预后大鼠血清中TC 下降,HJH 组更为显著(P< 0.01)。与Model 组相比,HJH 组大鼠TG、LDL-C 水平明显降低(P< 0.05)。结果表明,黄精水提物可以通过下调甘油三酯及游离脂肪酸水平改善高脂高糖大鼠血脂代谢紊乱。见图3。

图3 各组大鼠血糖、血脂水平比较
2.3 黄精水提物对高脂高糖饮食大鼠认知功能损伤的影响
Mirros 水迷宫是用于评价动物空间学习记忆能力的行为学检测方法,可通过不同模式评价动物的参考记忆和工作记忆能力[17],并以此评估其认知功能。造模结束后对大鼠行Mirros水迷宫测试。定位航行测试中,与正常饮食组相比,高脂高糖饮食大鼠前4 d 训练中潜伏期明显延长(P<0.05或P<0.01);第5天水迷宫空间探索中,第一次穿越平台时间明显延长(P<0.01),穿越平台次数减少(P<0.05),见表1。提示高脂高糖饮食大鼠12 周时表现出参考记忆和工作记忆受损。经黄精水提物干预后再次进行评价,与Model组相比,HJH 组、HJL 组前4 d 潜伏期明显缩短(P<0.01,P< 0.05);HJH 组、HJL 组大鼠第一次穿越平台所在象限时间均明显缩短(P< 0.01),HJH 组大鼠穿越平台次数明显增加(P< 0.01),见表2。结果提示,黄精水提物具有改善高脂高糖饮食所致大鼠学习记忆能力减退、提高认知功能的作用。
表1 不同时间点高脂高糖大鼠认知功能评价比较(±s)

表1 不同时间点高脂高糖大鼠认知功能评价比较(±s)
注:与正常饮食组相比,#P<0.05,##P<0.01。
组别正常饮食组高脂高糖组穿越平台次数(次)3.17±1.72 1.00±0.63#n 10 30第1天(s)53.50±9.18 55.30±4.63##第2天(s)44.50±10.10 50.20±6.91第3天(s)33.80±4.79 45.10±9.68#第4天(s)23.20±9.08 40.30±7.18##第一次穿越平台时间(s)14.20±8.61 42.20±7.31##
表2 各组大鼠不同时间点认知功能情况比较(±s)

表2 各组大鼠不同时间点认知功能情况比较(±s)
注:与Control组相比,##P<0.01;与Model组相比,*P<0.05,**P<0.01。
组别Control组Model组HJL组HJH组穿越平台次数(次)4.16±1.16 0.83±0.75##2.00±0.89*2.83±1.17**n 10 10 10 10第1天(s)39.70±7.39 57.90±4.42##47.70±8.73*42.50±7.56**第2天(s)33.40±9.37 55.10±9.61##44.60±10.40 36.30±10.80**第3天(s)25.00±7.04 51.90±8.92##38.80±11.2*27.30±7.84**第4天(s)17.80±4.83 47.80±6.84##29.30±7.84**26.20±6.30**第一次穿越平台时间(s)10.50±3.39 33.20±5.91##16.10±4.35**15.60±4.84**
2.4 黄精水提物对高脂高糖饮食大鼠血清及粪便中LPS的影响
高脂高糖饮食引起的肠-脑轴病理改变与循环血液中LPS 水平的增加有关。LPS 是高度促炎因子,会加重肥胖期间体内的炎症状态,触发全身性炎症性疾病[18]。如图4 所示,与Control 组相比,Model 组大鼠血清、粪便中LPS 含量均显著升高(P<0.01)。与Model组相比,黄精水提物给药组LPS 含量显著降低(P<0.01),呈现剂量依赖性降低。推测高脂高糖饮食可能改变了大鼠肠道菌群多样性,并导致肠道黏膜屏障受损,肠道菌群代谢物释放大量LPS,通过受损的肠壁进入循环血液中,促使循环中LPS 的高水平表达。实验结果表明黄精水提物能够以剂量依赖的方式有效降低高脂高糖饮食大鼠肠道内和循环中的LPS水平。

图4 黄精水提物对高脂高糖大鼠粪便及血清中LPS含量的影响
2.5 黄精水提物对高脂高糖饮食大鼠肠道菌群的影响
通过Illumina PE 250 测序评价黄精对高脂高糖大鼠肠道菌群的影响。总共1 731 个OTUs 中,4 组样本共享119 个OTUs。Model 组与Control 组总共1 075 个OTUs,共享185个OTUs;HJH组与Control组共1 289个OTUs,共享325 个OTUs;HJL 组与Control 组共1 218个OTUs,共享有263个OTUs。提示HJH组与正常组大鼠肠道菌群物种相似度更高。见图5。

图5 各组大鼠肠道菌群OTUs交叉情况
肠道菌群的LEFSe分析可以提供样品组间具有统计学差异的生物标志物,见图6。通过LDA 值分布图显示,Control、Model、HJH、HJL 组中分别具有45、11、7、12 个显著差异的微生物物种分类群。其中,Model组中变形菌门Pseudochelatococcus、Helicobacter 属及拟杆菌门的Alloprevotella属是特异微生物群。

图6 各组大鼠肠道菌群LEFSe分析结果
在各组大鼠肠道菌群样本中共16 个门,其中核心微生物群主要集中在厚壁菌门(Firmicutes)、拟杆菌门(Bacterioidetes)、放线菌门(Actinobacteria)和变形菌门(Proteobacteria)中,见图7。Metastates分析提示Model组的拟杆菌门菌群数量增加,而厚壁菌门及放线菌门菌群数量减少,HLH、HJL 组增加了拟杆菌门菌群丰度。厚壁菌门/拟杆菌门(F/B)是微生物发酵的能量产出指标之一[19]。Control、Model、HJL、HJH 组中F/B 比值分别为10.9、2.6、11.7、12.1,提示黄精水提物可以有效降低高脂高糖饮食大鼠拟杆菌门丰度,逆转厚壁菌门/拟杆菌门比值,调节大鼠大肠菌群的平衡。

图7 各组大鼠肠道菌群门水平的相对丰度
2.6 黄精水提物对高脂高糖饮食大鼠肠道黏膜屏障作用的影响
HE染色结果显示,正常组大鼠黏膜层、黏膜下层、肌层、浆膜层完整,黏膜层腺体排列整齐,覆盖大量绒毛,未见炎细胞浸润及增生。Model组可见部分黏膜腺体管腔变小、萎缩,腺体间距增大,腺体底部与肌层距离增大;部分上皮细胞变性坏死,伴有大量炎细胞浸润。给予黄精水提物干预后,上述病理改变均有不同程度的改善,见图8。结果提示,高糖高脂饮食可造成大鼠结肠黏膜腺体损伤、炎性改变、肠道屏障功能受损;黄精水提物可以较好地改善高脂高糖饮食大鼠结肠黏膜腺体形态,减少炎细胞浸润,有助于恢复肠道屏障功能。也有相关研究证实,单纯高脂饮食动物的肠道屏障功能会受到损伤,这可能与炎症反应激活相关[20]。故本研究中黄精水提物对高脂高糖大鼠的肠道黏膜具有保护、修复作用。

图8 黄精水提物对高脂高糖大鼠结肠黏膜病理形态的影响(HE,×200)
2.7 黄精水提物对高脂高糖饮食大鼠海马组织超微结构的影响
Control 组大鼠可见神经细胞排列紧密,细胞膜及核膜界限清晰,细胞核清楚,胞质中线粒体无肿胀、无空泡,突触结构丰富。Model 组可见神经元排列紊乱,细胞膜及核膜界限不清,部分细胞核固缩,胞浆中线粒体肿胀,出现空泡,突触数目明显减少。HJH 组及HJL组可见神经细胞排列整齐,双膜界限基本清楚,细胞核基本清晰,胞浆中个别线粒体轻微肿胀,HJH组未见空泡样变性,突触结构尚可。见图9。从各组海马的病理形态学观察结果看出,长期高糖高脂饮食诱导的神经炎症损伤大鼠海马组织的神经细胞,黄精水提物能有效改善神经细胞病理损害。
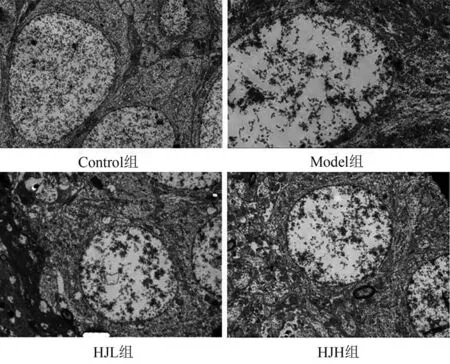
图9 各组大鼠海马组织超微结构情况
2.8 黄精水提物对高脂高糖饮食大鼠海马组织TLR4/NF-κB炎症信号通路相关蛋白的影响
为研究高脂高糖饮食大鼠肠道内毒素LPS诱导脑内促炎细胞因子表达的机制,通过Western Blot法检测了脑内NF-κB 信号通路相关蛋白的表达,见图10。与Control 组 相比,Model 组TLR4、NF-κBp65(Pp65)、NLRP3 蛋白表达水平均显著升高(P< 0.01)。与Model 组相比,HJH、HJL 组均可降低高脂高糖大鼠海马组织TLR4、P-p65、NLRP3 蛋白表达量(P<0.01)。各组大鼠海马组织中Caspase-1 蛋白表达水平比较差异无统计学意义。见图10。提示黄精水提物能够降低高脂高糖饮食大鼠海马组织中LPS诱发的TLR4/NF-κB炎症信号通路相关蛋白表达。

图10 黄精水提物对高脂高糖大鼠海马组织中TLR4、p-p65、NLRP3、Caspase-1蛋白表达的影响
3 讨论
随着现代生活水平的提高,高脂高糖饮食结构已经成为影响人类健康的隐形杀手。长期高能量膳食使机体热量摄入代谢失衡,造成脂肪堆积,诱发肥胖症以及糖、脂代谢类疾病[21]。从代谢-神经认知功能障碍的角度来看,肥胖本身和肥胖引起的代谢紊乱等因素的改变可以影响认知,在认知功能损伤的早期就起到关键的作用[22]。本实验中显示,高脂高糖饮食诱导的大鼠体质量、血糖、血脂相关指标升高,存在肥胖状态及糖、脂代谢异常,而黄精水提物对高脂高糖饮食所致大鼠代谢改变具有一定调节作用。
肠道微生态是近年来生命科学研究的热点。肠-脑轴是肠道与中枢神经系统之间对话机制的重要节点。机体肠道环境包括肠道组织细胞、附着于肠壁上的黏膜层和定植在肠腔内的肠道微生物群[23]。肠道微生物在宿主体内受到遗传和环境因素影响表现出个体差异性,除宿主遗传基因组的固定因素外,肠道菌群的结构组成和功能多样性往往处于动态变化。环境因素中,饮食在调节肠道菌群组成和功能方面起着关键作用[24]。有研究证实高脂肪饮食增加了拟杆菌门的种群数量,同时降低了厚壁菌门和放线菌门的种群数量[25]。这与笔者实验中高脂高糖模型大鼠肠道菌群检测结果相似。高能量饮食被认为是导致肠道微生态失调及肠壁屏障作用减弱的主要原因,一方面饮食诱导肠道某些革兰氏阴性菌的增殖,其代谢产物中释放的内毒素增加,引发肠壁局部炎症,导致肠壁通透性增加;另一方面会减少肠道内可以有效降低LPS水平、改善肠道屏障功能有益菌如双歧杆菌[26-27]。故高脂高糖饮食通过改变肠道微生物群和损害肠道屏障功能,导致LPS 泄漏,从而增加循环中的LPS 水平,使机体处于低度慢性炎症状态。在本研究中证实高脂高糖饮食大鼠肠道内容物中及循环血液中LPS升高。肠道菌群产生的内毒素等有害代谢产物会影响血脑屏障(BBB)的通透性,有毒物质进入脑内诱导小胶质细胞激活和神经元凋亡,形成神经炎症,导致记忆缺陷和认知功能损伤,这也是AD 等神经退行性疾病重要的致病因素[28]。本研究中,在12 周的高糖高脂饮食喂养下,大鼠开始出现空间记忆和学习障碍,表现为认知能力下降。实验证实黄精水提物可以抑制肠道炎症、改善肠黏膜而发挥屏障保护作用,并且调控肠道菌群,调节菌群多样性及其丰度,降低代谢性内毒素水平。
Toll 样受体4(Toll-like-receptor 4,TLR4)是一种脂多糖受体,是介导多种炎症通路的重要分子,其在脑内小胶质细胞、星形胶质细胞和巨噬细胞中表达,识别LPS 后通过激活NF-κB 信号通路参与炎症介质的释放[29]。NF-κB是一种多效性转录因子,它可以调控参与炎症反应的基因,并刺激多种细胞信号通路,导致炎症因子的产生增加。在人类第22、48 号染色体上存在NF-κB 结合位点,由5 个成员组成:NF-κB-1(p50)、NF-κB-2(p52)、Rel-A(p65)、Rel-B 和c-Rel。只有p65 和c-Rel 是有效的转录激活因子。经LPS 刺激后,NF-κB 信号通路通过IκBα 磷酸化而激活,导致p65 的核转位,进而启动炎症相关基因的转录和表达,诱发炎症反应[30]。故抑制NF-κB 介导的细胞和分子过程可能为神经炎症相关的神经疾病提供一个潜在的靶点。活化的NF-κB 进一步上调NLRP3的mRNA 转录水平,高水平的NLRP3 mRNA 是形成有效炎症小体的关键[31]。NLRP3 炎症小体包括含NLR 家族PYRIN 域蛋白3(NOD-,LRR-and pyrin domaincontaining 3,NLRP3)、凋亡相关斑点样蛋白(apoptosis associated speck-like protein,ASC)和胱冬肽酶-1(Caspase-1)[32]。NLRP3 炎症小体在神经炎症反应发生中发挥着关键介导作用。本研究采用的黄精水提物可干预高脂高糖饮食大鼠脑内上调的TLR4/NF-κB炎症信号通路及NLRP3 炎症小体相关蛋白的表达,从而阻断炎性信号通路的激活,抑制中枢神经系统炎症,改善认知功能损伤。
本研究中黄精水提物能够改善高脂高糖饮食所致大鼠认知损伤的作用机制可能与改变肠道菌群结构及多样性、保护肠道屏障功能、抑制LPS生成有关以及改善中枢神经系统炎症有关。但其机制仍不完善,值得进一步研究。
