糖脂清方对高糖诱导HT22细胞损伤的保护作用
2022-03-25石崯力王旭赵云邱玲艳徐奚如孙斯凡
石崯力,王旭,赵云,邱玲艳,徐奚如,孙斯凡
(南京中医药大学第一临床医学院,江苏 南京 210029)
糖尿病(diabetes mellitus,DM)是一种复杂、普遍的全球性慢性疾病,DM 患者中约有90%为2型糖尿病(T2DM)。糖尿病合并认知功能障碍(diabetic cognitive dysfunction,DCD)是由于T2DM 病情进展对患者中枢神经系统所造成的不同程度的损害,具体表现为学习和空间能力减退、注意力不集中、健忘,严重可导致不可逆性痴呆[1],发病率约为30%[2],具有病程长、难治愈、预后差的特点,对患者的生存和预后带来不同程度影响。海马是学习记忆的重要神经中枢,其结构、功能变化在DCD 的发生和发展中起到至关重要的作用。研究发现,海马区神经元异常凋亡会导致衰老大鼠出现不同程度的学习和记忆障碍[3]。在持续性高血糖环境下海马区星形胶质细胞可出现不同程度损伤,引起细胞功能和形态上的变化,细胞内活性氧累积、凋亡增加、神经炎性反应增强,导致神经毒性改变。此外,细胞自噬异常与细胞凋亡密切关联[4]。适度的自噬可以调节海马神经电活动从而抑制细胞凋亡。然而,过度自噬也会导致细胞程序性死亡[5],这与高糖诱导海马区细胞损伤致使内质网应激反应(endoplasmic reticulum stress,ERS)加重,诱发蛋白启动未折叠蛋白反应(unfolded protein response,UPR)密切相关[6]。基于上述研究,人们认为海马区域神经元凋亡和过度自噬可能与认知障碍有着潜在关联,通过某种方式抑制海马神经元的凋亡、氧化应激和过度自噬是改善学习和记忆缺陷的一种新策略。
“糖脂清”(TZQ)由黄精、鬼箭羽、枸杞子、泽兰、炒僵蚕5 味中药组成。方中黄精补气养阴、健脾益肾,鬼箭羽活血化瘀,枸杞子益气滋肾、补肝明目,泽兰活血祛瘀、利水消肿,炒僵蚕熄风止痉、祛风止痛、化痰散结,全方共奏补肾活血化瘀、理气化痰通络之效,是王旭教授根据多年临床经验与中医基础理论相结合创制的中医经验方,并获得国家专利(101829271A)。现代药理研究表明,黄精、鬼箭羽、枸杞子均具有改善糖脂代谢紊乱、提高免疫力、抗炎抗氧化和调节免疫的功效[7-9];泽兰在保肝、降低血脂、抗凝血和抗氧化等方面效果良好[10];僵蚕具有保护神经元、抗炎、抗惊厥和抗凝的作用[11]。前期研究表明[12-14],TZQ 不仅能显著降低糖尿病大鼠血糖水平,改善胰岛素抵抗,修复胰岛素信号通路以改善糖脂代谢水平,还可调节内质网相关应激因子和蛋白的表达,抑制海马区神经元凋亡,改善DCD 大鼠记忆能力,但具体效果和作用机制仍不明确。本研究将从体外实验层面验证TZQ 通过降低神经元凋亡、改善氧化应激水平和调控自噬层面对高糖诱导下HT22 细胞的具体作用机制,明确TZQ 治疗DCD 的疗效,为其可能成为改善DCD 有效且可行的候选药物提供理论支持。
1 实验材料
1.1 实验动物
18 只Wistar 大鼠,由青龙山动物养殖场提供,动物实验符合南京中医药大学伦理委员会标准,编号:012071001686。大鼠饲养于南京中医药大学动物实验动物中心的清洁动物饲养室,温度18~25 ℃,湿度40%~55%,12 h/12 h昼夜交替光照,噪声<60 dB。
1.2 细胞株
小鼠HT22 海马神经元细胞购于武汉普诺赛生命科技有限公司。
1.3 实验药物及试剂
TZQ组成:黄精、炒僵蚕、鬼箭羽、枸杞子、泽兰,全部中药饮片购于江苏省中医院中药房,符合2015年版《中华人民共和国药典》(一部)及相关项下规定。按照人与大鼠体表面积换算系数6.75 大鼠的等效剂量[15],将成人每日每公斤体重用药量的10 倍作为低剂量组,成人每日每公斤体重用药量的20 倍作为中剂量组,成人每日每公斤体重用药量的40 倍作为小鼠高剂量组,选用中药水煎剂,将黄精、炒僵蚕、鬼箭羽、枸杞子、泽兰浸泡30 min 后,煎煮成浓度为含生药量1.2 g/mL 的汤剂,4 ℃保存备用。给药前将药物复温至室温使用。取一定量的盐酸二甲双胍置于已灭菌的10 mL 离心管,以双蒸水作为溶剂配置成1 mg/mL 的二甲双胍母液,充分振荡混匀并使用0.22 μm 滤头过滤,4 ℃保存备用。
超氧化物歧化酶测定试剂盒(批号:A001-3)、丙二醛测试盒(批号:A003-1)、乳酸脱氢酶试剂盒(批号:A020-2)购自南京建成生物工程研究所;RIPA 裂解液(批号:P0013B)、脱脂奶粉(批号:P0216)、青霉素-链霉素溶液(批号:C0222)、辣根过氧化物酶标记山羊抗小鼠IgG(H+L)(批号:A0216)、辣根过氧化物酶标记山羊抗兔IgG(H+L)(批号:A0208)、Caspase-3 一抗(批号:AC030)、Bax 一抗(批号:AB026)、Bcl-2一抗(批号:AB112)、Hoechst 33342 染色液(批号:C1025)、PBS(批号:C0221A)购自碧云天生物技术有限公司;JNK 一抗(批号:66210-1-Ig)、Lamp2 一抗(批号:66301-1-Ig)、SIRT1(批号:60303-1-Ig)购自武汉三鹰生物科技有限公司;β-actin 一抗(批号:bs-0061R)购自Bioss 公司;盐酸二甲双胍(批号:419K025)、4%多聚甲醛(批号:20170323)购自Solarbio公司;DMEM 培养基(批号:8121441)、0.25%Trypsin-EDTA(批号:2186974)、胎牛血清(批号:SA210407)购 自Gibco 公 司;TritonX-100(批 号:MKBW1852V)购自Sigma 公司;Alexa 488 耦联亲和纯化山羊抗小鼠IgG(H + L)(批号:K1204)购自APE BIO公司。
1.4 主要仪器
恒温CO2培养箱(HERAcell 150i);凝胶成像系统(ImageQuant LAS 4 000mini);Western Blot 电泳槽(上海天能科技有限公司);多功能酶标仪(PE enspire);高速冷冻离心机(Eppendorf,Centrifuge 5 430R);台式恒温振荡器(中国上海精宏实验设备有限公司,THZ-312);生物荧光倒置显微镜(日本Olympus BX43);天平(德国赛多利斯E200)。
2 方法
2.1 含药血清的制备
将18 只Wistar 大鼠以大鼠维持饲料(碳水化合物60%、蛋白质22%、脂肪4.0%)饲养,自由进食、饮水。正式实验开始前先适应性饲养1周,按照随机数字表随机分为正常组、二甲双胍组、TZQ低剂量组、TZQ中剂量组、TZQ 高剂量组,二甲双胍组给药剂量为0.3 g/kg[16],按照“1.3”项下计算出TZQ 低、中、高剂量组给药剂量分别为4.5、9、18 g/kg,每日分2次给药,正常组给予等量生理盐水灌胃。灌胃第7 天下午于给药90 min 后取各组大鼠腹主动脉血10~15 mL,3 000 r/min 离心15 min,取上清液,56 ℃水浴箱中30 min灭活,0.22 μm过滤器除菌,后放置于-80 ℃冰箱保存备用。
2.2 HT22细胞培养
配置海马神经元细胞株HT22 使用含有10%胎牛血清、1%青霉素-链霉素的DMEM 培养基,水浴复苏冻存的HT22 细胞,置于37 ℃,正常培养条件下(气体参数设置为:21%O2、74%N2、5%CO2)的细胞培养箱中进行培养。待HT22 细胞密度达到80%左右,将细胞均匀铺板至6 孔板、12 孔板、96 孔板中进行后续实验。将对数生长期的HT22 细胞,小心倒掉上清培养基,用PBS 清洗2 次,每次时间为1 min,弃去PBS,加入1 mL的0.25% 胰酶,在细胞培养箱内进行消化30 s~1 min,用培养基终止消化,反复吹打、重悬,后转移至高速离心机以1 000 rpm/min离心3.5 min,离心完毕后弃上清,加入3 mL培养基进行传代和接种。
2.3 CCK-8 法检测不同浓度葡萄糖对HT22 细胞活力的影响
取对数生长期的HT22 细胞,经消化、吹打、离心后,以5 × 104/mL 的密度均匀接种于96 孔板中,用25、50、100、125、150、200、225、250、300 mmol/L 浓度葡萄糖干预细胞,分别干预24 h和48 h,并另外设置空白孔(不含有细胞仅含有培养基),每组细胞平行设置5个复孔。处理结束后每孔加10 μL的CCK-8试剂,37 ℃细胞培养箱孵育1~1.5 h,使用酶标仪于450 nm 波长处读取各组细胞光密度(OD)值。以浓度-生存曲线作出回归方程由此求出半数致死浓度(lethal concentration 50,LC50)。细胞活力计算公式如下:
细胞存活率(%)=(实验组OD均值-空白组OD均值)/(对照组OD均值-空白组OD均值)×100%
2.4 实验分组与给药
待细胞生长稳定,均匀接种在6 孔板中,每孔2 mL,待HT22 细胞生长稳定后进行分组,具体分为:空白组(Con)、模型组(DM)、二甲双胍含药血清组(Met)、低剂量含药血清组(TZQ-L)、中剂量含药血清组(TZQ-M)、高剂量含药血清组(TZQ-H),小心将6 孔板内的完培吸出,按照“2.3”项下筛选出的最适造模浓度的高糖培养液分别作用于各组造模细胞,Con 组加入等体积正常糖浓度培养液,干预时间为CCK-8实验所筛选出的时间,造模时间结束后吸出培养液,加入含有不同剂量含药血清的完全培养基干预24 h,待给药结束后置于高倍显微镜下,观察不同组别之间细胞形态变化,然后提取细胞上清和蛋白进行后续实验检测。
2.5 检测指标
2.5.1 各组细胞超氧化物歧化酶(SOD)活性及丙二醛(MDA)、乳酸脱氢酶(LDH)含量测定
待细胞生长稳定,均匀接种在12 孔板中,每孔1 mL,分组造模与给药步骤同前。待HT22 细胞造模、给药完毕后,吸取每组细胞上清,4 ℃环境下以2 000 r/min 速度离心10 min,使用SOD、MDA、LDH 试剂盒说明书操作加样、孵育,每组细胞测定孔均设置5 个复孔,并提前打开酶标仪,以空白孔为调零孔,450 nm 波长依次测量每孔OD 值,测定数值应快速完成。根据OD 值计算每组细胞SOD、MDA、LDH 含量水平,并与总蛋白含量进行归一化处理,比较各组细胞SOD、MDA、LDH水平。
2.5.2 免疫荧光染色和Hoechst 33342 染色法检测各组细胞Lamp2表达和细胞凋亡水平
待细胞生长稳定,均匀接种在24 孔板中,每孔1 mL,分组造模与给药步骤同前。用PBS洗涤3遍,4%多聚甲醛固定30 min,用0.1%Triton室温孵育10 min,后于Blocking Buffer 中室温封闭30 min~1 h,加入稀释过的一抗,4 ℃中反应过夜。37 ℃复温后用PBS 清洗3 遍,加入稀释后的二抗,于避光湿盒中室温孵育作用1 h,最后至正置荧光显微镜下观察Lamp2 表达情况。染色结束后弃去孔内液体,PBS 洗涤3 次,在室温条件下加入适量Hoechst 33342 染色液,再置于荧光显微镜下拍照观察。
2.5.3 Western Blot 法检测各组HT22 细胞Bax、Bcl-2、Caspase-3、SIRT1和JNK蛋白表达
每组细胞加入含PMSF 的RIPA 裂解液将组织彻底破碎裂解,12 000 r/min 离心15 min,吸取剩余上清,加入5 × protein loading buffer 100 ℃变性5 min。采用6%~12%SDS-PAGE 胶进行蛋白电泳。湿转法转移至0.45 μm PVDF 膜,5%脱脂奶粉封闭,根据抗体说明书稀释抗体,孵育Bax(1∶1 000)、Bcl-2(1∶1 000)、Caspase-3(1∶1 000)、SIRT1(1∶1 000)、JNK(1∶3 000)一抗,同时孵育β-actin(1∶5 000)抗体作为内参,孵育相应二抗(1∶1 000)。加ECL 化学发光底物显色,用化学发光成像系统进行显影,ImageJ 软件分析目的条带的净光密度值。
2.6 统计学方法
用GraphPad Prism 8 统计软件进行数据分析,计量资料以均数± 标准差(±s)表示,并进行正态分布检验。多组间的比较采用方差分析和重复检验,两组间比较采用独立样本t检验,样本不符合正态分布采用非参数检验,以P< 0.05 代表差异具有统计学意义。
3 结果
3.1 CCK-8检测结果
使用25~300 mmol/L的高糖梯度培养基分别作用于HT22 细胞24 h 和48 h 后,结果表明24 h 时,细胞存活率随葡萄糖浓度的增加开始下降,但此时下降程度较为缓慢,当葡萄糖浓度为50 mmol/L 和100 mmol/L时,与25 mmol/L浓度相比其存活率之间的差异无统计学意义(P>0.05),当葡萄糖浓度大于100 mmol/L 时,存活率较25 mmol/L 浓度相比差异具有统计学意义(P< 0.05)。48 h 时,细胞存活率随葡萄糖浓度的增加而显著降低(P< 0.01),葡萄糖浓度为225 mmol/L和250 mmol/L 时,细胞存活率分别下降至(56.33 ±3.22)%和(49.09 ± 3.13)%,差 异有统计学 意义(P< 0.01),其logIC50= 238.5 mmol/L。因此,在后续实验中,选择225 mmol/L的高糖培养基为构建HT22细胞损伤模型所用最佳浓度。见表1。
表1 不同糖浓度环境下处理的HT22细胞存活率(±s,%)

表1 不同糖浓度环境下处理的HT22细胞存活率(±s,%)
注:与25 mmol/L同一时间相比,*P<0.05,**P<0.01。
浓度(mmol/L)25 50 100 125 150 200 225 250 300 48 h 102.10±0.94 90.46±2.18**80.42±1.79**79.14±1.39**75.15±2.46**63.93±1.20**56.33±3.22**49.09±3.13**31.17±0.76**n5 5 5 5 5 5 5 5 5 24 h 100.00±3.00 94.10±3.03 90.44±1.60 85.74±2.85*85.75±3.93*79.31±2.67**76.86±3.90**68.92±4.64**33.42±0.90**
3.2 各组HT22细胞形态变化比较
在正常浓度下培养的HT22 细胞间隙小,排列紧密,突触数量多,密度大,网络发达。经48 h 高糖培养基干预后,DM 组HT22 细胞出现细胞间隙变宽,排列疏松,密度小,镜下细胞密度减弱,形态及生长受到抑制。经二甲双胍和不同浓度TZQ 含药血清干预后的神经细胞在形态、生长和排列分布方面都有一定程度的改善。见图1。
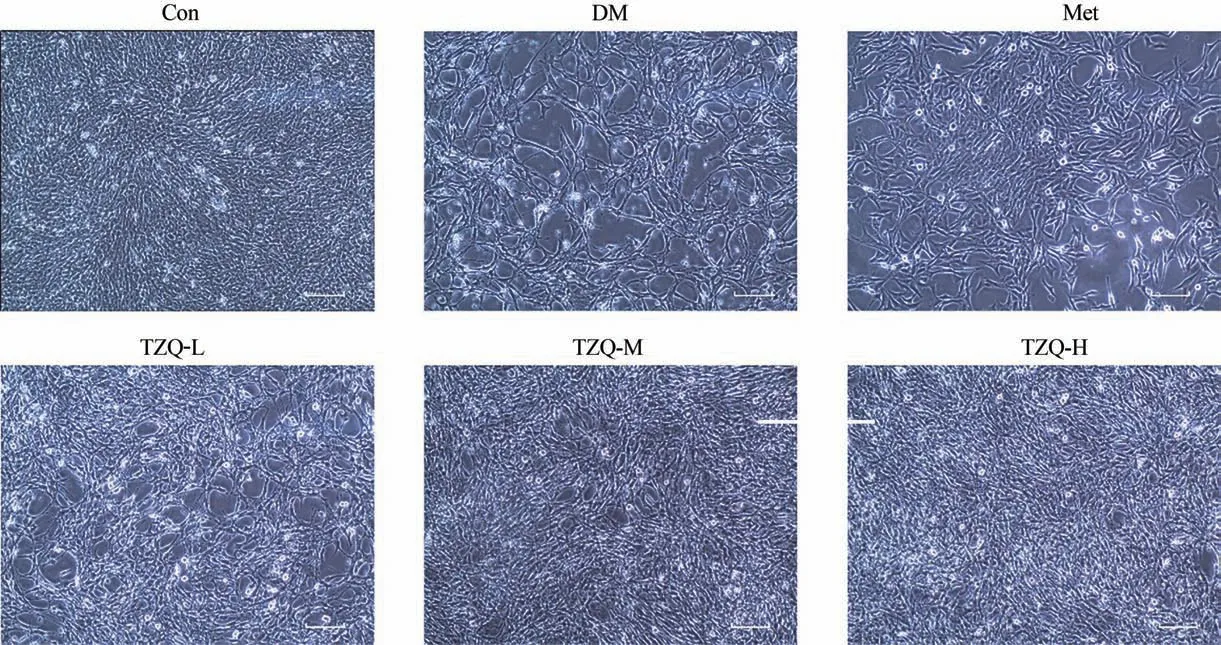
图1 各组HT22细胞形态变化(Bar=50 μm)
3.3 各组对高糖诱导HT22 细胞氧化应激损伤的作用
给药24 h 后测定各组HT22 的抗氧化活性,结果显示DM 组SOD 含量显著低于Con 组(P<0.01),MDA和LDH 含量显著高于Con 组(P<0.01)。经过药物干预后,Met组和各剂量TZQ含药血清组SOD与DM组相比明显升高(P< 0.01),MDA 和LDH 水平明显降低(P<0.01)。表明应用不同浓度的TZQ 进行干预对高糖诱导下HT22 细胞的氧化损伤可起到一定程度的保护作用。见表2。
表2 各组HT22细胞氧化应激损伤参数水平比较(±s)

表2 各组HT22细胞氧化应激损伤参数水平比较(±s)
注:与空白组比较,##P<0.01;与模型组比较,**P<0.01。
组别Con组DM组Met组TZQ-L组TZQ-M组TZQ-H组LDH(U/L)249.30±37.99 768.80±66.11##399.70±7.17**325.40±38.55**403.20±16.40**410.30±13.95**n 6 6 6 6 6 6 SOD(U/mgprot)63.16±7.11 6.95±2.24##13.49±1.00 41.43±9.64**46.53±6.04**50.06±4.46**MDA(nmol/mgprot)2.52±0.46 10.60±1.19##2.41±0.35**1.80±0.37**2.79±0.43**1.68±0.37**
3.4 各组HT22细胞Lamp2表达水平比较
通过细胞免疫荧光检测各组HT22 细胞Lamp2 表达情况。结果显示,与Con组比较,DM 组HT22细胞内溶酶体膜损伤,荧光强度降低;经过二甲双胍和TZQ中、高剂量含药血清干预后HT22 细胞溶酶体的破损得到一定程度的修复,Lamp2表达量增加,差异具有统计学意义(P< 0.05),而TZQ-L 组与DM 组相比Lamp2 表达量无统计学意义(P> 0.05)。见图2、表3。
表3 各组HT22细胞Lamp2荧光定量水平比较(±s)

表3 各组HT22细胞Lamp2荧光定量水平比较(±s)
注:与空白组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01。
组别Con组DM组Met组TZQ-L组TZQ-M组TZQ-H组Mean fluorescence per cell(Fold of Con)1.000±0.007 0.050±0.006##0.260±0.009**0.160±0.030 0.200±0.030*0.290±0.040**n3 3 3 3 3 3

图2 免疫荧光法检测各组HT22细胞Lamp2表达(Bar=50 μm)
3.5 各组HT22细胞凋亡水平比较
Con 组HT22 细胞核凋亡少,细胞膜完整,细胞质分布均匀,可见散在低蓝色分布;DM 组细胞膜受到破坏,膜通透性增加,细胞核凋亡增加,镜下可见高亮蓝色规则或不规则形状点;经二甲双胍和不同浓度TZQ 含药血清干预后,细胞核凋亡得到一定程度的改善,细胞趋于正常,亮蓝色荧光变暗变少。见图3。

图3 各组HT22细胞凋亡情况(Bar=50 μm)
3.6 各组HT22 细胞Bax、Bcl-2、Caspase-3、JNK 和SIRT1蛋白表达比较
与Con组相比,DM组Bax、Caspase-3、JNK、SIRT1蛋白表达水平显著增加(P< 0.05),Bcl-2 蛋白表达水平显著下降(P< 0.05),经二甲双胍和不同浓度TZQ 含药血清干预后,与DM 组相比,Met 组可显著下调SIRT1 蛋白的表达水平(P< 0.01),TZQ-L 组Bax表达量显著下调(P<0.05),TZQ-H 组Bcl-2蛋白表达量显著上调(P< 0.05),其余各组在调控蛋白表达方面与模型组相比差异无统计学意义。而在Caspase-3、JNK 和SIRT1 蛋白的调控上,各剂量含药血清组均能下调其表达水平,差异具有统计学意义(P<0.05)。表明二甲双胍和TZQ 含药血清的干预能在一定程度延缓高糖环境下HT22 神经细胞损伤,其机制可能与抑制神经元凋亡和自噬存在关联,见表4、图4。

图4 各组细胞Bax、Bcl-2、Caspase-3、JNK和SIRT1相关蛋白表达
表4 各组细胞Bax、Bcl-2、Caspase-3、JNK和SIRT1蛋白表达量比较(±s)

表4 各组细胞Bax、Bcl-2、Caspase-3、JNK和SIRT1蛋白表达量比较(±s)
注:与空白组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01。
SIRT1/actin 0.73±0.02 1.63±0.08##1.08±0.08**0.80±0.05**0.89±0.15*0.71±0.23*组别Con组DM组Met组TZQ-L组TZQ-M组TZQ-H组n3 3 3 3 3 3 Bax/actin 1.12±0.09 1.88±0.24#1.39±0.19 1.13±0.12*1.25±0.13 1.30±0.19 Bcl-2/actin 0.21±0.01 0.11±0.02#0.11±0.02 0.16±0.02 0.20±0.03 0.23±0.03*Caspase-3/actin 0.44±0.07 0.90±0.12#0.56±0.13 0.45±0.07*0.45±0.09*0.52±0.08*JNK/actin 0.22±0.02 0.57±0.07##0.37±0.02 0.33±0.03*0.29±0.06*0.21±0.03*
4 讨论
DCD 是以获得性认知行为缺陷为特征的糖尿病常见并发症之一。通过长期的临床实践发现中药组方在调节DCD 的临床疗效方面不亚于甚至优于西药治疗。前期相关研究认为[17],DCD 是多由痰湿、瘀血、浊毒等侵犯机体,以致肾气亏损,气血运行不足,髓海空虚,神机失用,从而发病,其病位在脑,与脾、肾密切相关。TZQ 配伍严谨,其中黄精、枸杞子性味甘平,健脾固肾、益气养阴;泽兰性辛温味苦,鬼箭羽性寒味苦,二者相互配伍同起活血化瘀之效;炒僵蚕性辛平味咸,善走经络、祛顽痰。全方切合脾肾亏虚、痰瘀互结的病机,共奏具有益气养血、豁痰化瘀、滋肾养肝之效,既治DCD 痰瘀互结之标,又疗脾肾亏虚之本。
DCD 的发生、发展与细胞异常凋亡、过度氧化应激和细胞自噬关系密切。在长期的高糖环境刺激下,机体内自由基成分如活性氧(ROS)出现过度堆积,氧化与抗氧化动态平衡被打破,炎性因子表达增加,造成神经细胞功能障碍和细胞凋亡[18]。细胞自噬是另一种存在于机体细胞的正常代谢过程,可帮助降解内质网中积聚的未折叠或错误折叠蛋白,降低ERS,维持内质网稳定性,保护细胞存活,在这个过程中需要内质网、高尔基体、溶酶体、线粒体和自噬小体等多种细胞器的配合参与[19-20]。然而,自噬在抑制糖尿病发生进展中起到何种作用仍然存在争议[21]。越来越多的证据表明,过度自噬对神经元有害[22]。氧化应激、细胞凋亡和细胞自噬之间相互关联,在DCD 的生成机制中占据着重要的作用。SOD、MDA 和LDH 的含量高低间接反应HT22细胞受自由基攻击和细胞膜损伤的严重程度,是评估氧化应激损伤的重要指标,它影响机体磷脂中不饱和脂肪酸含量以引起神经元脂质过氧化,从而诱发细胞凋亡[23]。本实验研究中,在确定最适造模浓度情况下观察各组HT22细胞氧化应激指标、Hoechst 33342染色结果显示,与Con 组相比较,高糖环境下HT22 细胞氧化应激损伤增加,细胞核凋亡增加,而在给予二甲双胍和不同浓度的TZQ 干预后可一定程度提高神经元的自我修复能力,恢复细胞功能。
Bax 和Bcl-2 是调节和控制细胞凋亡的一组基因。Caspase 家族蛋白是一种半胱氨酸蛋白酶,其引发的级联反应引起细胞形态学上的改变促使细胞凋亡[24]。Caspase-3 则是最下游的执行者,其活化受Bax、Bcl-2 调控[25]。Bcl-2 可以抑制CytC 的释放,维持Ca2+的动态平衡、拮抗促凋亡基因Bax 的表达,抑制细胞凋亡[26]。SIRT1 作为一种去乙酰化酶,广泛存在于全身各组织细胞中,可通过多种复杂形式参与细胞自噬[27],参与糖尿病、肿瘤、心血管等多种疾病治疗作用的双向过程,其调控自噬的方式存在正向和逆向调控。Western Blot 实验结果显示,HT22 细胞在高糖环境刺激下可激活SIRT1 相关自噬通路,该自噬可能与去乙酰化自噬相关基因的表达产物的增加、激活线粒体调控途径相关[28]。另一方面,JNK 作为应激活化蛋白激酶,该基因的激活可介导下游底物磷酸化进而诱导自噬发生[29],自噬长期上调会引起细胞质内容物的过度降解,最终出现凋亡[30]。此外,自噬体的成熟需要溶酶体相关蛋白的参与[31]。Lamp2是位于溶酶体上的一种膜蛋白,虽然Lamp2的转录、合成和溶酶体的靶向功能并不会随着年龄的增长而发生改变,但Lamp2 在溶酶体膜上的稳定性会随着年龄的增长而下降[32-33]。在本研究中,HT22 小鼠海马神经元相关自噬标志物SIRT1、JNK 表达显著增加,提示神经元细胞处在“积极”自噬流活化阶段,而Lamp2 表达水平却显著下降,由此本课题组推测,神经元虽然处在“积极”自噬环境,但溶酶体转膜功能受到阻碍,自噬体和溶酶体结合异常,神经元无法进行正常降解,由此诱导细胞出现凋亡,故而激活凋亡信号通路上Bax、Caspase-3 等凋亡蛋白表达。而TZQ 的干预可能是通过抑制自噬小体转运、促进溶酶体降解异常代谢物的方式,从而抑制Caspase 家族等炎症相关蛋白的激活,抑制神经元过度自噬和凋亡。
在本次研究中,笔者观察到中药复方TZQ 对高糖诱导的HT22 神经细胞损伤能起到一定保护作用,这种保护作用是通过下调Bax、Caspase-3、MDA、LDH炎症、氧化应激相关因子和JNK、SIRT1 自噬相关因子的表达水平,上调SOD、Bcl-2、Lamp2 的表达水平来实现的。TZQ 可通过多重机制产生对神经元的保护作用,其有望成为治疗糖尿病患者合并认知功能障碍的候选药物。
