黄芩苷通过上调miR-126基因抑制乳腺癌细胞增殖①
2022-03-23吴双华谢璨灿唐新桥株洲市中心医院株洲412000
王 婷 吴双华 谢璨灿 唐新桥 罗 勇(株洲市中心医院,株洲 412000)
乳腺癌现已成为全球女性最常见恶性肿瘤之一,已经严重威胁到女性的身心健康。且其发病率与病死率在逐年上升,患者也呈年轻化发展的趋势[1-5]。研究表明,乳腺癌的治疗手段除了传统的手术、放疗、化疗及内分泌治疗等方法外,免疫治疗与基因治疗也开始崭露头角[4-6]。其中,放、化疗等对肿瘤细胞有杀伤力的同时,也会使正常细胞或组织损伤,进一步伤害到患者的机体功能,具有强烈的副作用[7]。与此同时,其高昂的治疗经费,也会对患者和社会造成巨大的经济负担。因此,寻求一种有效、价廉、低毒的治疗药物已亟不可待。
黄芩苷(Baicalin)是黄芩(Scutellaria baicalensis Georgi)根中的一种黄酮类化合物,具有抗炎、抗病毒、抗氧化等药理作用,又以其毒性低、价格便宜、资源丰富等特点在一系列抗肿瘤药物中脱颖而出。研究表明,黄芩苷在抗肿瘤活性上有重要作用。其具有诱导肿瘤细胞凋亡、分化、干扰信号传导和抑制肿瘤侵袭转移的能力,从而抑制肺癌、肝癌、结肠癌及乳腺癌等恶性肿瘤的发展[1-5,8-10]。
乳腺癌治疗不彻底,究其原因,主要在其极不可控地增殖、侵袭和转移[11]。由此,防治乳腺癌细胞的恶性增殖、侵袭和转移是提高乳腺癌治疗效果的关键点。已有报道表明,黄芩苷可通过调节miRNA诱导乳腺癌细胞的凋亡[2-4]。
microRNA(miRNA)是一类内生的、长度约为20~24 个核苷酸的小RNA,在细胞内有多种调节作用。同一miRNA 可有多个靶基因,反之,同一基因也可由几个miRNA 一起调控。如此,这样可形成一个复杂的网络,精细地调控机体的部分生命活动。miRNA 具有组织特异性、稳定性等优点。随着技术手段的多样化,越来越多的miRNA 被用来作为癌症诊断的标志物[11-12]。
通过前期研究,本课题组发现黄芩苷可通过调节miRNA 来影响乳腺癌的发展[3]。同时,通过一系列实验验证筛选,本课题组发现上调miR-126 可以影响凋亡相关基因的表达,抑制乳腺癌细胞的凋亡[4]。已有研究证明miR-126 参与胃癌、口腔鳞癌、直肠癌和oxLDL 诱导血管平滑肌细胞的增殖和迁移[13-17]。近年来,多项研究也表明,miR-126 在乳腺癌的发展中起着重要作用[18-20]。
基于以上分析,本研究旨在通过分析miR-126对乳腺癌细胞(MCF-7)与正常乳腺细胞(MCF10A)的影响及miR-126过表达质粒转染和黄芩苷药物处理后,体外观测黄芩苷和miR-126 对MCF-7 细胞的影响,为黄芩苷治疗乳腺癌的研究提供一个科学依据。
1 材料与方法
1.1 材料 乳腺癌细胞(MCF-7)株、正常乳腺细胞(MCF10A)株购自中乔新舟。黄芩苷购自源叶生物(质量分数98%)。质粒miR-126 mimic 购自Honor-Gene。一抗TGF-β(21898-1-AP)、血管内皮生长因子VEGF(19003-1-AP)、二抗anti-Rabbit(SA00001-2)均购自Proteintech。
1.2 方法
1.2.1 CCK-8 细胞加药培养后,更换完全培养基90µl。每孔被加入CCK-8 溶液10µl。37℃、5%CO2培养箱中孵育4 h。酶标仪测定在450 nm 处的吸光度。实验结果以OD值表征细胞活性大小。
1.2.2 MTT 法 MTT 法检测细胞的生存率。取对数生长期的细胞,消化计数。以1×104个/孔密度接种于96 孔板内,每孔100µl。各组均设4个复孔,培养至分组相应的时间后,每孔加入10 µl 5 mg/ml MTT。37℃、5%CO2继续孵育4 h 后取出96 孔板。弃去含MTT 的培养基后,每孔加入150 µl DMSO。室温缓慢摇晃10 min后于Bio-Tek酶标仪分析490 nm处吸光度(OD)值。
1.2.3 Transwell Transwell 检测细胞侵袭。制备Transwell小室,冰上操作,Matrigel胶与无血清培养基按1∶2 稀释。置37℃培养箱内60 min 使胶凝固。水化基底膜,制备细胞悬液,调整细胞密度约为1×105个/ml。接种细胞:各吸取100 µl 加入到小室上室内,下室加入含10%FBS 的完全培养基,培养48 h。染色:弃去小室内培养液,用PBS 洗2 遍。用湿棉签擦尽上室面的Matrigel 和细胞,4%多聚甲醛固定30 min,PBS洗2遍,用0.5%结晶紫染色5 min,用清水洗3遍以上。细胞拍照:倒置显微镜下观察,选取小室3个视野拍照。
Transwell 检测细胞迁移。制备细胞悬液:培养的细胞用0.25%胰酶消化液消化,用无血清基础培养基制成细胞悬液,调整细胞密度约为1×105个/ml。接种细胞:各吸取100µl加入到小室上室内,下室加入含10%FBS 的完全培养基,培养48 h。染色:弃去小室内培养液,用PBS 洗2 遍。用湿棉签擦尽上室面的细胞。4%多聚甲醛固定30 min,PBS 洗2 遍。用0.5%结晶紫染色5 min,用清水洗3 遍以上。细胞拍照:倒置显微镜下观察,每组选3 个视野进行拍照。
1.2.4 流式细胞术(FCM)FCM 检测细胞凋亡率。已培养好的细胞用不含EDTA 的胰酶消化收集,PBS 清洗,收集1×105~2×105个细胞。加500 µl的Binding Buffer悬浮细胞。再依次加5µl Annexin VAPC、5 µl Propidium Iodide 混匀。室温避光反应5~15 min。流式仪检测,激发波长Ex=488 nm,发射波长Em=530 nm。
1.2.5 Western blot 提取细胞蛋白,上样,室温电泳(恒压78 V,约2.5 h)。冰水浴,转膜(恒流300 mA,TGF-β 约60 min,VEGF 约60 min)。5%脱脂牛奶封闭2 h,4℃过夜。室温下,一、二抗分别孵育1.5 h、1 h,每次孵育后用1×PBST 洗3 次,每次15 min。添加ECL工作液,暗室显影曝光。
1.2.6 qRT-PCR 在NCBI 上搜索目的基因序列,采用Primer5 软件设计引物。上海生工合成引物,H-miR-126-3p(5'-3'):F-TCGTACCGTGAGTAATAATGCG,R-GCTGTCAACGATACGCTACGTAA,长 度75 bp;H-TGF-β(5'-3'):F-AGCAACAATTCCTGGCGATACCTC,R-CAATTTCCCCTCCACGGCTCA,长度121 bp;H-VEGF(5'-3'):F-TGCTCTACTTCCCCAAATCACT,R-ACTCACTTTGCCCCTGTCG,长度154 bp。提取细胞总RNA,反转录,采用qRT-PCR(30 µl 体系,预变性95℃10 min,变性95℃15 s,退火延伸60℃30 s)。
1.2.7 免疫荧光技术(IF)取出爬片,用4%多聚甲醛固定30 min。加0.3%曲拉通,37℃、30 min 通透,清洗,5%BSA 37℃封闭60 min。一抗(TGF-β、VEGF)4℃孵育过夜。二抗CoraLite488-conjugated Affinipure Goat Anti-Rabbit IgG(SA00013-2),37℃孵育90 min。DAPI工作液37℃染核10 min,缓冲甘油封片。荧光显微镜观察。
1.3 统计学处理 用SPSS22.0 统计数据,Graphpad Prism8.0 处理统计图。结果比较采用t检验、单因素方差分析。
2 结果
2.1 不同浓度黄芩苷对MCF-7 细胞的影响及其药物浓度筛选 为探究黄芩苷在乳腺癌中的合适用药浓度,对MCF-7 细胞进行不同浓度的黄芩苷(0、25、50、75、100µg/ml)加药处理。细胞培养24 h 后,运用CCK-8 法检测MCF-7 的细胞活性,结果显示黄芩苷在0~50µg/ml的浓度范围内,MCF-7的细胞活性呈下降趋势,其中用50µg/ml 黄芩苷处理后的细胞活性与75µg/ml、100µg/ml的接近,见图1A。对此,接下来分别选择以下3个浓度梯度的黄芩苷(0、50、100 µg/ml)做进一步处理,运用qRT-PCR、Western blot 及IF 检测TGF-β、VEGF 在细胞内的相对表达。其中TGF-β、VEGF 为恶性肿瘤的重要指标。qRTPCR、Western blot 及IF 结果表明,50 µg/ml 黄芩苷组相较0 µg/ml 黄芩苷组TGF-β 和VEGF 的表达显著性降低,50µg/ml和100µg/ml 黄芩苷组则无明显差异,见图1B~E。由此可得出,在此次实验中,50µg/ml为黄芩苷最适用药浓度。
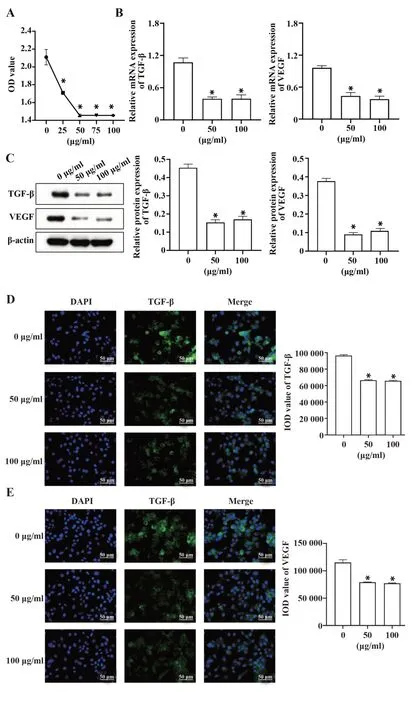
图1 不同浓度黄芩苷对MCF-7 细胞的影响及其药物浓度筛选(×200)Fig.1 Effects of different concentrations of baicalin on MCF-7 cells and screening of baicalin drug concentration(×200)
同时,以上实验结果表明,黄芩苷对MCF-7 细胞的细胞活性有一定的抑制作用。且黄芩苷可在基因及蛋白水平上抑制TGF-β、VEGF 的表达。因此,本课题组推测,黄芩苷影响MCF-7 细胞的活性很可能是通过调节TGF-β、VEGF的表达实现。
2.2 miR-126 在MCF-7、MCF10A 细胞内的表达为验证miR-126 的表达,在MCF-7、MCF10A 这两种细胞内分别对miR-126、VEGF 的表达情况进行了检测。qRT-PCR实验结果表明在MCF-7细胞内miR-126的表达显著低于MCF10A,见图2A。同时Western blot检测VEGF 的相对表达量,VEGF 在MCF10A 内低表达,MCF-7 内显著高表达,见图2B、C。miR-126 与VEGF 在乳腺癌细胞中的表达呈负相关。因此推测,在MCF10A 细胞中,miR-126 高表达,减少VEGF的积累。而在MCF-7 细胞体内,miR-126 低表达,对VEGF的抑制作用降低,促进血管生成以及乳腺癌的发展。
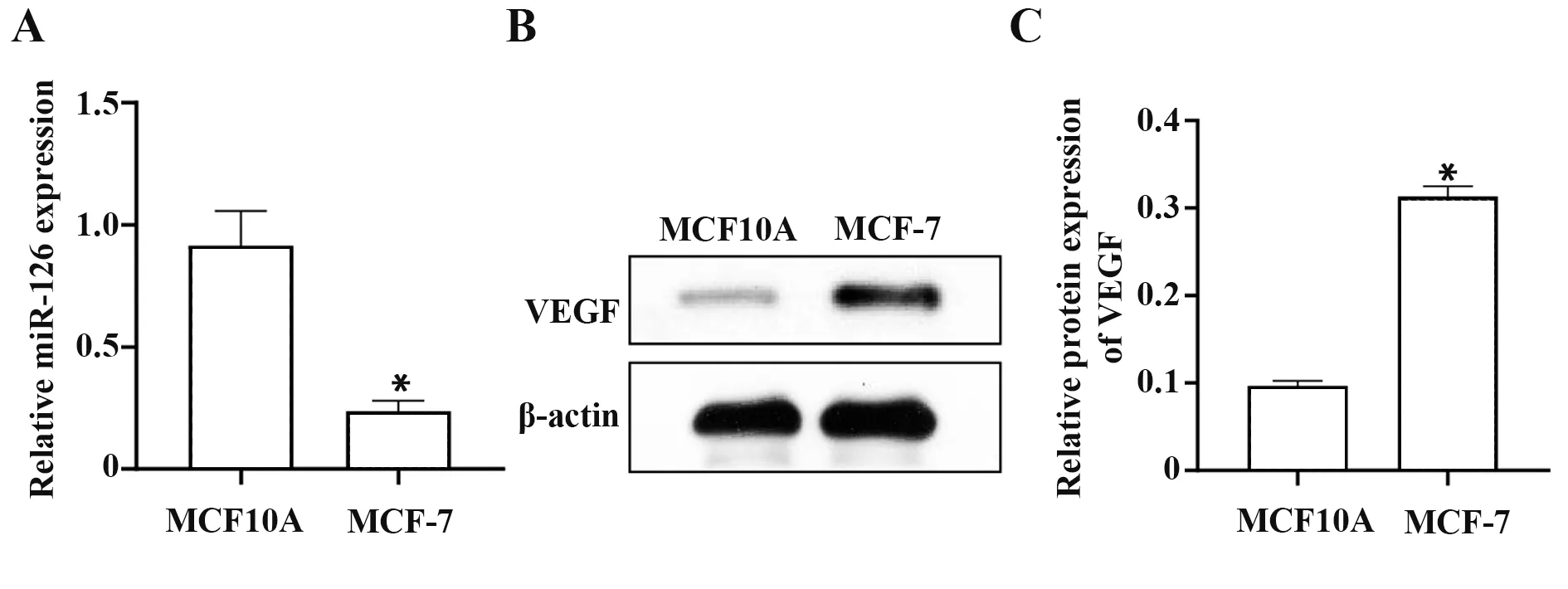
图2 miR-126在MCF-7、MCF10A细胞内的表达Fig.2 Expression of miR-126 in MCF-7 and MCF10A cells
2.3 过表达miR-126 对MCF-7、MCF10A 细胞的影响 为进一步探究miR-126对MCF-7的影响。在以上实验基础上,分别在正常乳腺细胞MCF10A 和乳腺癌细胞MCF-7内转染miR-126过表达质粒。运用qRT-PCR 验证miR-126 的转染效率,见图3A。对MCF10A、MCF-7 细胞分别建立空白组(control)、空载组(NC-mimic)及过表达miR-126 组(miR-126 mimic)。利用MTT、Transwell 及FCM 等实验技术手段检测其对细胞增殖、侵袭迁移及凋亡等方面的影响。结果表明,MCF10A 的3 个组之间,生存率无明显差异。MCF-7 的miR-126 mimic 组细胞生存率明显低于control 组和NC-mimic 组,其中control 组和NC-mimic 组之间无明显差异,MCF10A 组的细胞活性总体低于MCF-7 组,见图3B;运用Transwell 检测MCF-7 细胞的侵袭、迁移能力,miR-126 mimic 组与control 组、NC-mimic 组相比,其细胞侵袭率、迁移率都显著性降低,见图3C、D;用FCM 测MCF10A 和MCF-7 两种细胞的凋亡率,miR-126 mimic 组在MCF-7 中细胞凋亡率较control 组和NC-mimic 组明显增强,而MCF10A中3组无明显变化,见图3E。就整体实验结果而言,在MCF10A 细胞中过表达miR-126,对其状态无明显影响。不同的是,在对MCF-7细胞进行过表达miR-126 处理后,不仅MCF-7 细胞的细胞活性受到抑制,细胞的侵袭率、迁移率都有所降低。而与此相反的是MCF-7 细胞的凋亡率呈上升趋势。这进一步证明了miR-126在乳腺癌细胞发展中有重要的调节作用。
2.4 黄芩苷调节miR-126 影响MCF-7 细胞的增殖 经上述实验,筛选出黄芩苷的最佳用药浓度为50 µg/ml。将MCF-7 细胞分为空白组(control 组)、空载组(NC-mimic 组)、过表达miR-126(miR-126 mimic 组)、空载+50 µg/ml 黄芩苷(Baicalin+NC 组)和过表达miR-126+50 µg/ml 的黄芩苷组(Baicalin+miR-126组)。MTT的结果表明,在上述5个组别中,Baicalin+miR-126组的细胞活力最低,miR-126 mimic组和Baicalin+NC 组较control组都具有显著性差异,而miR-126 mimic组和Baicalin+NC 组间无显著性差异,见图4A。这表明黄芩苷和miR-126 对MCF-7 细胞的增殖有抑制作用。同时,qRT-PCR 检测结果显示,Baicalin+NC 组与control组相比较,miR-126的相对表达量显著升高,且Baicalin+miR-126 组也显著高于miR-126 mimic 组,见图4B。这表明Baicalin 可在MCF-7细胞中调节miR-126的表达。为进一步说明黄芩苷及miR-126 在乳腺癌细胞中的调节作用,运用qRT-PCR、Western blot 检测指标TGF-β 和VEGF 分别在基因、蛋白水平上的相对表达,见图4C、D。结果显示,在TGF-β、VEGF基因及蛋白水平上,Baicalin+miR-126 组较其他4 组均显著低表达。miR-126 mimic 组与baicalin+NC 组相较control 组为低表达,而两组间无明显差异。用FCM 检测MCF-7细胞的凋亡情况,见图4E。结果表明miR-126 mimic组、Baicalin+NC 组相较于control 组,MCF-7 细胞凋亡情况呈上升趋势。与此同时,Baicalin+miR-126组与其他组相比较,MCF-7 细胞的凋亡率显著性升高。就上述实验结果而言,发现Baicalin+miR-126组较其他几组在抑制细胞活性、降低TGF-β 和VEGF 的表达以及促进细胞凋亡中具有显著性差异。由此,推测黄芩苷可与miR-126 协同作用于MCF-7 细胞,降低MCF-7 细胞的增殖。FCM 的实验结果从侧面验证了黄芩苷可协同miR-126 上调MCF-7细胞的凋亡率,抑制其增殖。结果表明,发现黄芩苷可抑制MCF-7 细胞的增殖,其一部分机制可能是通过上调miR-126。
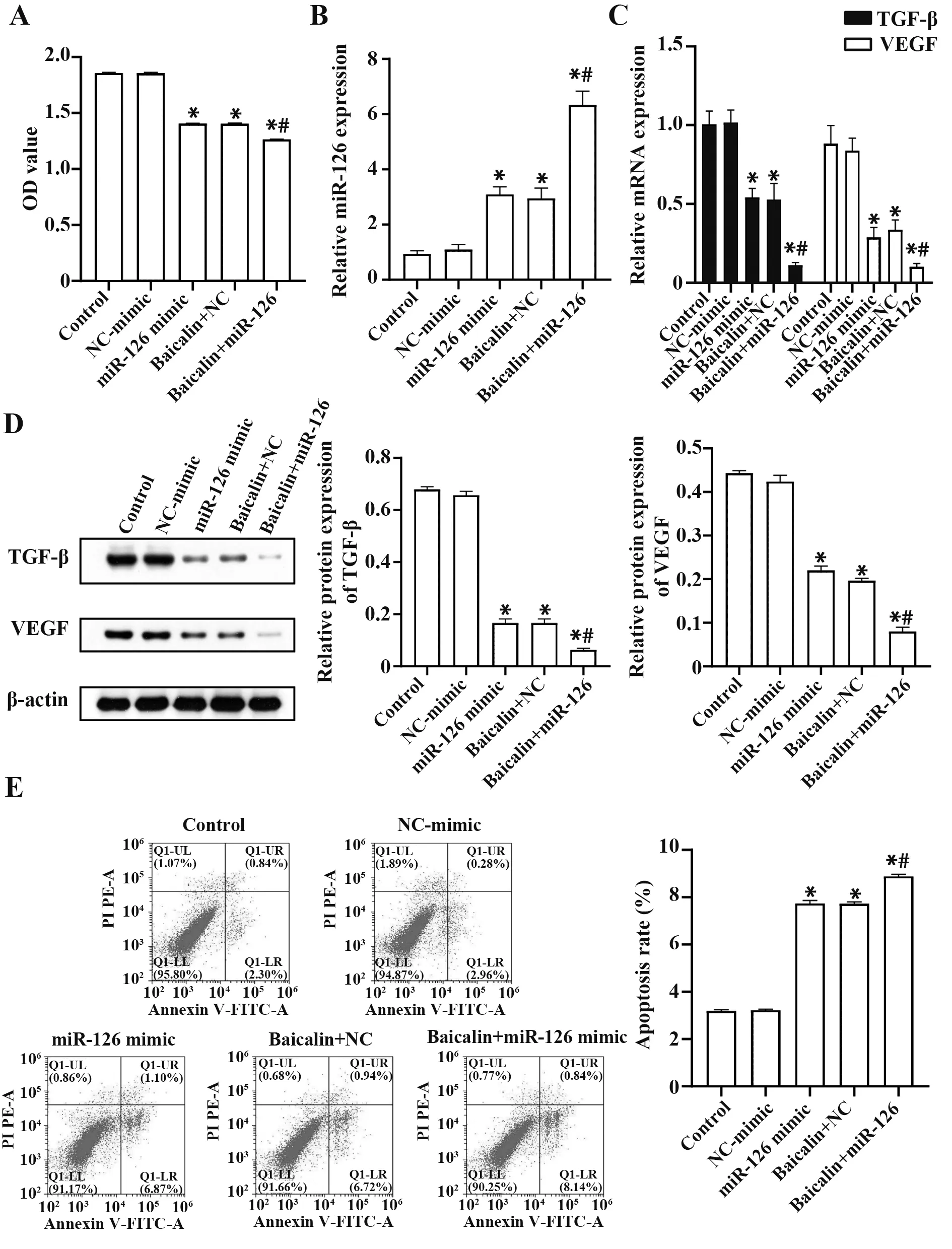
图4 黄芩苷调节miR-126影响MCF-7细胞增殖Fig.4 Baicalin regulates miR-126 to effect proliferation of MCF-7 cells
3 讨论
黄芩苷是一种黄酮类化合物,具有多种药理活性。据报道,黄芩苷可通过调节信号通路来缓解炎症和抑制肿瘤的作用。文献表明,黄芩苷可通过AKT 调节Nrf2、NF-κB 和FoxO1 可缓解慢性胃炎和改善神经炎症,发挥神经保护的作用[21-23]。DAI等[24]在研究由饮食引发的肥胖和肝脂肪变性中也发现,黄芩苷能通过激活CPT1,达到治疗的效果。
多项研究表明,黄芩苷可作为治疗乳腺癌的一种潜在高效的天然药物。ZHOU 等[25]研究表明,黄芩苷可以通过调节β-catenin 信号逆转EMT,从而抑制具有高度侵袭性的乳腺癌细胞的转移。GAO 等[26]研究表明,黄芩苷可以通过抑制IκB 激酶的激活和NF-κB的活化,从而抑制乳腺癌的发展。最近,有研究报道黄芩苷在骨性乳腺癌中也有治疗作用,黄芩苷通过诱导细胞凋亡抑制乳腺癌细胞的转移性生长来发挥对骨性乳腺癌的骨保护和抗肿瘤作用[27]。
另外,有相关文献报道,黄芩苷可以通过靶向miRNA调节下游基因表达来治疗癌症。DUAN等[28]在研究黄芩苷对乳腺癌的治疗时,表明黄芩苷可以通过调节miR-338-3p 和MORC4 来抑制乳腺癌细胞的活力,促进癌细胞的凋亡。这为研究黄芩苷的治疗机制提供了新的思路。同时,前期研究中也表明,黄芩苷可通过上调miR-126促进乳腺癌的凋亡。
现有的技术手段下,miR-126 虽然在不同类型的癌症中所承担的角色还存在一定的争议[11,13]。公认的是miR-126在肿瘤细胞的增殖和转移中扮演重要的角色。miR-126 可以通过复杂的调节网络靶向调控基因的表达,改变肿瘤的生长环境,参与癌细胞的增殖与转移。在胃癌、肺癌、直肠癌及口腔癌等恶性肿瘤中miR-126 明显低表达,它与癌细胞的高增殖活性、转移能力以及肿瘤间质血管增殖旺盛等现象密切相关[11,13-17]。同时,有研究者发现,miR-126 也可作为慢性粒细胞性白血病的一个新的治疗靶标。从EC 转运到LSC,miR-126 可以促进CML、LSC 的静态及白血病的移植[29-31]。在食管癌中,miR-126通过抑制VEGF的表达来调控食管癌细胞的增殖[32]。与此相似的是,在不饱和脂肪酸对大肠癌细胞的作用研究中,miR-126通过抑制VEGF的蛋白表达,进而影响大肠癌的发展[33]。以上文献表明,miR-126 通过调节VEGF 的表达,从而抑制血管生成和癌细胞增殖。这与研究结果一致,miR-126抑制了VEGF的表达。MONACO等[34]在研究恶性间皮瘤的报道中同样表明,miR-126 抑制了细胞生长和血管生成。LI 等[35]在关于改善动脉粥样硬化的报道中,上调miR-126 可降低VEGF 表达及抑制细胞活力、迁移。以上实验均从侧面验证了本次实验结果的准确性。
另外,发现对比单一处理,两种处理(黄芩苷与miR-126 过表达)同时进行时,MCF-7 细胞的活性及凋亡率都具有显著性差异。对此,推测黄芩苷影响MCF-7 细胞,其部分机制可能是通过上调miR-126。且两者可协同作用于MCF-7细胞抑制增殖。
综上所述,黄芩苷可以抑制乳腺癌细胞的增殖,其部分机制可能是通过上调miR-126基因,降低VEGF 的表达,这将为乳腺癌的治疗研究提供一个科学依据。
