miR-579-3p/DEFA3调控脓毒血症的炎症反应及靶向关系验证
2022-03-23刘德智高尚兰新乡市中心医院新乡医学院第四临床学院重症医学科二区新乡453003
杨 燕 刘德智 付 云 高尚兰(新乡市中心医院,新乡医学院第四临床学院重症医学科二区,新乡 453003)
脓毒血症、脓毒血症休克综合征是当今医学的难点问题。每年约有3 000 万新发病例,600 万人病死,该病的治疗选择非常有限[1-2]。microRNA(miRNA)可以更好地诊断脓毒血症,并有助于诊断、治疗措施[3]。miR-579-3p 虽在脓毒血症中出现异常,但其具体的功能及机制尚未十分清楚[4]。编码人中性粒细胞肽1-3(human neutrophilic peptide 1-3,HNP1-3)的α 防御素1-3(alpha-defensin 1-3,DEFA1/DEFA3)基因在脓毒血症中出现基因异常上调,并且与脓毒血症患者的病情恶化和生存有关[5-6]。本研究旨在探讨miR-579-3p、DEFA3 在脓毒血症中的功能及相互作用关系。
1 材料与方法
1.1 材料 100只6周龄雌性C57BL/6小鼠,体质量(13±2)g,购自南京大学模式动物研究所;过表达miR-579-3p 转基因小鼠、敲减DEFA1/DEFA3 转基因小鼠均购自赛业(广州)生物科技有限公司;血浆miRNA 提取试剂盒购自北京百奥莱博生物公司;血浆蛋白提取试剂盒购自上海康朗生物科技有限公司;小鼠TNF-α检测试剂盒、IL-8检测试剂盒购自南京森贝伽生物公司;IL-6检测试剂盒购自武汉赛培生物科技有限公司;半胱氨酸天冬氨酸酶1(Caspase-1)活性检测试剂盒购自Biovision;末端标记法(TUNEL)染色试剂盒购自北京博尔迈生物技术有限公司;双荧光素酶报告基因检测试剂盒购自上海碧云天生物公司。
1.2 方法
1.2.1 脓毒血症小鼠模型的建立 参照赵喆等[7]在研究中使用的盲肠结扎法建立脓毒血症小鼠模型。
1.2.2 实验分组 实验共分为5组,每组20只小鼠,分别为Blank组、Control组、Model组、miR-579-3p组、si-DEFA3组。各组的处理方法为:Blank组不做任何处理,正常饲养;Control组做同样的操作,不结扎盲肠;miR-579-3p 组为将过表达miR-579-3p 的转基因小鼠进行盲肠结扎操作,si-DEFA3 组为将敲减DEFA3的转基因小鼠进行盲肠结扎操作。
1.2.3 ELISA 实验检测小鼠血清中TNF-α、IL-8 和IL-6 的水平 眼眶静脉采血法采集小鼠的血液,2 000 g 离心15 min 收集血清。用小鼠TNF-α 检测试剂盒、小鼠IL-8检测试剂盒、小鼠IL-6检测试剂盒分别检测血清中TNF-α、IL-8和IL-6的含量。
1.2.4 流式细胞术检测内皮细胞焦亡 按照张鑫红等[8]的方法分离和培养Blank组、Control组、Model组、miR-579-3p组、si-DEFA3组小鼠的肺血管内皮细胞。具体步骤为:在无菌条件下剪取肺组织接种到细胞培养皿,不加培养基,待组织块贴壁后加入DMEM 完全培养基。48 h 后肺血管内皮细胞开始生长,72 h 后,取出组织块,1 d 更换1 次培养液,至第8 天。以后开始正常培养2 d 更换1 次培养液。用Caspase-1 活性检测试剂盒和TUNEL 染色试剂盒检测Caspase-1阳性和PI阳性的细胞,流式细胞术检测双阳性的细胞。将双重染色细胞的百分比作为焦亡细胞的百分比。
1.2.5 qRT-PCR 检测小鼠血浆中miR-579-3p 的表达 将小鼠血浆用血浆miRNA 提取试剂盒提取miRNA,并将其逆转录成cDNA,-80℃保存备用。用qRT-PCR 检测cDNA 中miR-579-3p 的表达,结果以U6 为内参,2-ΔΔCt法计算相对表达。所用引物为:miR-579-3p(5'-3'),正向引物CGTGCCGTTCATTTGGTATAAAC,反向引物CGTGCCGTTCATTTGGTATAAAC;U6(5'-3'),正向引物CTCGCTTCGGCAGCACA,反向引物AACGCTTCACGAATTTGCGT。
1.2.6 Western blot检测小鼠血浆中DEFA3蛋白表达 将小鼠血浆用血浆蛋白提取试剂盒提取总蛋白,进行BCA 定量后,沸水煮沸10 min 变性处理。取上清液用于蛋白电泳检测,将凝胶上的蛋白用转膜仪转移至PVDF 膜上。将膜2%脱脂奶粉封闭后,一抗(1∶1 000)4℃孵育过夜。取出膜,在室温下二抗(1∶500)孵育2 h。最后用ECL电化学发光试剂盒对膜进行显影曝光,再用Quantity One 4.62 软件分析条带的灰度。
1.2.7 生物信息学分析 通过生物信息在线预测网站Starbase(http://starbase.sysu.edu.cn)预测miR-579-3p的潜在靶基因。
1.2.8 双荧光素酶报告基因检测实验验证miR-579-3p 与DEFA3 的结合 首先构建野生型(DEFA3 WT)和突变型(DEFA3 MUT)的DEFA 3'UTR 载体。操作时需要把纯化的质粒克隆至psiCHECK2 载体,成功构建荧光载体psiCHECK2-DEFA3 WT 和psiCHECK2-DEFA3 MUT。选用培养48 h 的293T 细胞,用2倍量的脂质体法将荧光载体质粒与miR-NC、miR-579-3p、anti-miR-NC、anti-miR-579-3p 共转染至该细胞。最后按照双荧光素酶报告基因检测试剂盒操作手册要求操作,结果分析中,荧光活性的变化以海肾荧光素酶活性与萤光虫荧光素酶活性的比值表示。
1.3 统计学分析 使用医学统计专用软件PEMS3.2 进行所有数据的统计分析,医学绘图软件Graph-Pad Prism 7 对数据进行相关图片绘制。计量资料用表示,多组间数据比较采用单因素方差分析SNK-q检验,两组比较采用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 脓毒血症小鼠模型的炎症因子表达 ELISA实验检测小鼠血清中炎症因子TNF-α、IL-8 和IL-6的含量,流式细胞术检测肺血管内皮细胞的焦亡。结果如表1所示,与对照组相比,模型组小鼠血清中TNF-α、IL-8、IL-6的含量均明显上调,内皮细胞焦亡率明显升高(P<0.05)。
表1 脓毒血症小鼠模型中炎症因子的表达(,n=20)Tab.1 Expressions of inflammatory factors in sepsis mouse model(,n=20)

表1 脓毒血症小鼠模型中炎症因子的表达(,n=20)Tab.1 Expressions of inflammatory factors in sepsis mouse model(,n=20)
Note:Compared with control group,1)P<0.05.
2.2 miR-579-3p、DEFA3 在脓毒血症小鼠血浆中的表达 结果如图1 和表2 所示,与对照组相比,模型组小鼠血浆中miR-579-3p 的mRNA 表达显著升高,DEFA3蛋白表达显著升高(P<0.05)。

图1 DEFA3的蛋白表达Fig.1 Protein expression of DEFA3
表2 脓毒血症小鼠血浆中miR-579-3p、DEFA3 的表达(,n=20)Tab.2 Expressions of miR-579-3p and DEFA3 in plasma of sepsis mice(,n=20)
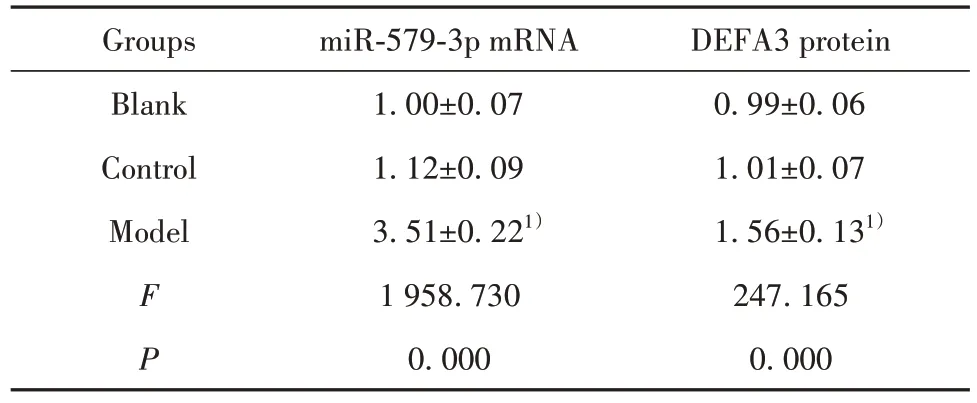
表2 脓毒血症小鼠血浆中miR-579-3p、DEFA3 的表达(,n=20)Tab.2 Expressions of miR-579-3p and DEFA3 in plasma of sepsis mice(,n=20)
Note:Compared with control group,1)P<0.05.
2.3 过表达miR-579-3p 的转基因脓毒血症小鼠血清炎症因子表达和内皮细胞焦亡 结果如表3 所示,与模型组相比,miR-579-3p 组小鼠血清中miR-579-3p mRNA 表达显著升高,TNF-α、IL-8、IL-6 的含量均明显降低,内皮细胞焦亡率明显降低(P<0.05)。
表3 过表达miR-579-3p的转基因脓毒血症小鼠血清炎症因子表达和内皮细胞焦亡(,n=20)Tab.3 Overexpression of serum inflammatory factors and endothelial pyroptosis in transgenic sepsis mice with miR-579-3p(,n=20)

表3 过表达miR-579-3p的转基因脓毒血症小鼠血清炎症因子表达和内皮细胞焦亡(,n=20)Tab.3 Overexpression of serum inflammatory factors and endothelial pyroptosis in transgenic sepsis mice with miR-579-3p(,n=20)
Note:Compared with model group,1)P<0.05.
2.4 敲减DEFA3的转基因脓毒血症小鼠血清炎症因子表达和内皮细胞焦亡 结果如图2 和表4 所示,与模型组相比,si-DEFA3 组小鼠血浆中DEFA3蛋白表达显著降低,血清中TNF-α、IL-8、IL-6的含量均明显降低,内皮细胞焦亡率明显降低(P<0.05)。
表4 敲减DEFA3的转基因脓毒血症小鼠血清炎症因子表达和内皮细胞焦亡(,n=20)Tab.4 Reduced serum inflammatory factors and endothelial pyroptosis in DEFA3 transgenic sepsis mice(,n=20)
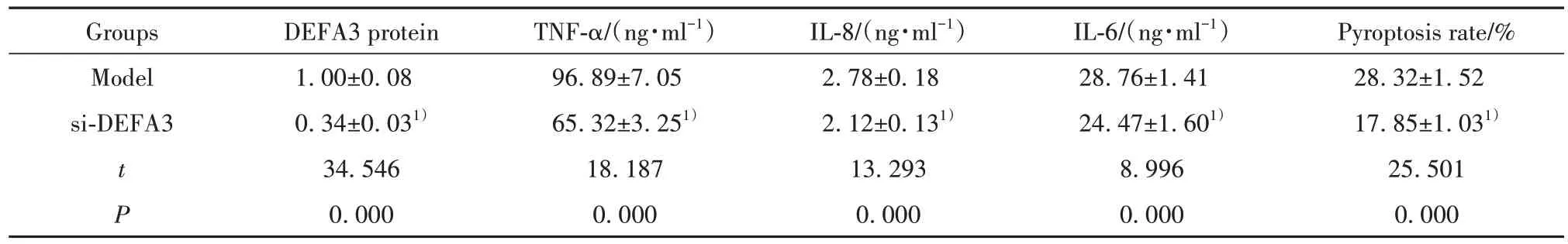
表4 敲减DEFA3的转基因脓毒血症小鼠血清炎症因子表达和内皮细胞焦亡(,n=20)Tab.4 Reduced serum inflammatory factors and endothelial pyroptosis in DEFA3 transgenic sepsis mice(,n=20)
Note:Compared with model group,1)P<0.05.

图2 敲减DEFA3 的转基因脓毒血症小鼠的DEFA3 蛋白表达Fig.2 Protein expression of DEFA3 in DEFA3 transgenic sepsis mice
2.5 miR-579-3p 靶向DEFA3 通过在线预测网站Starbase(http://starbase.sysu.edu.cn)预测到miR-579-3p与DEFA3之间存在靶向结合位点(图3)。与miR-NC 组相比,miR-579-3p 组DEFA3 WT 的293T细胞荧光活性显著降低,与anti-miR-NC 组相比,anti-miR-579-3p 组DEFA3 WT 的293T 细胞荧光活性显著升高。见表5。
表5 miR-579-3p结合DEFA3(,n=20)Tab.5 miR-579-3p binding to DEFA3(,n=20)
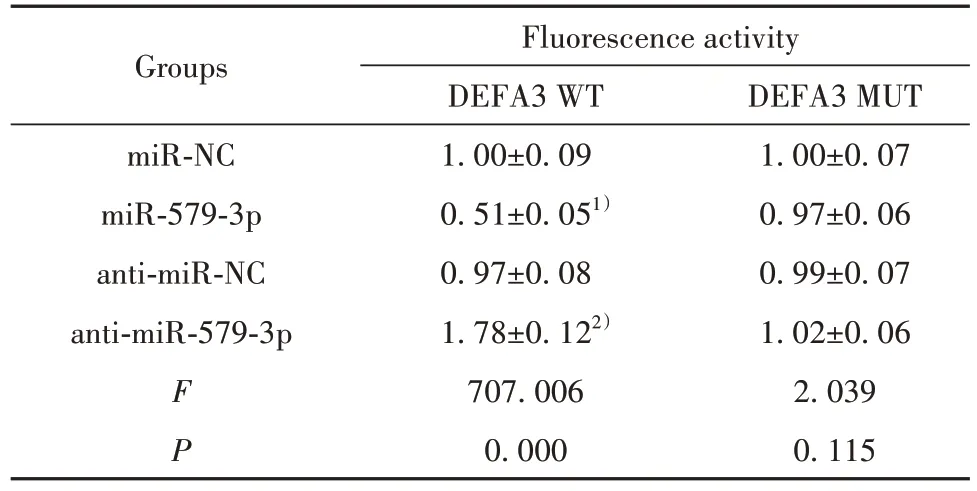
表5 miR-579-3p结合DEFA3(,n=20)Tab.5 miR-579-3p binding to DEFA3(,n=20)
Note:Compared with miR-NC group,1)P<0.05;compared with antimiR-NC group,2)P<0.05.
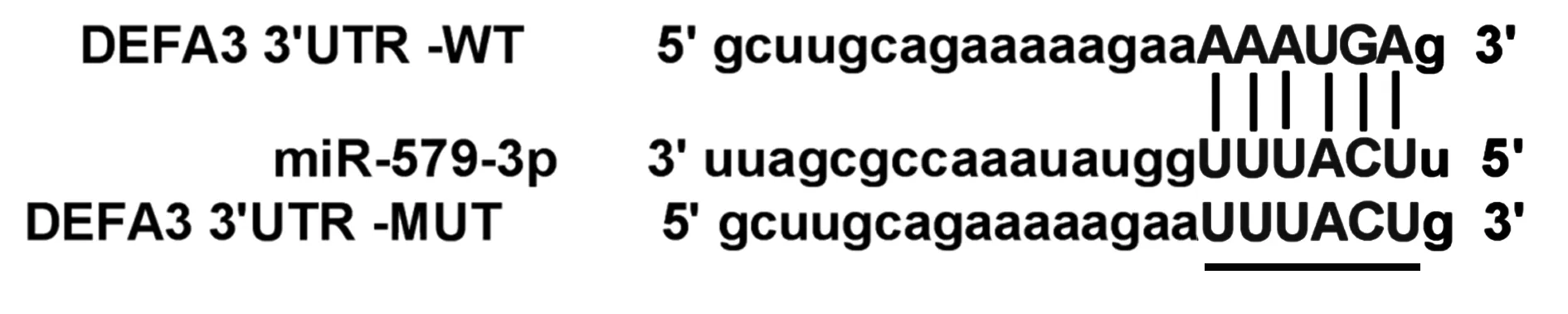
图3 miR-579-3p直接调控DEFA3表达Fig.3 miR-579-3p directly regulates expression of DEFA3
3 讨论
脓毒血症的初始阶段涉及促炎细胞因子的过度分泌,这会导致严重的机体损伤[9]。microRNA 在脓毒血症过程中可以调节炎症细胞因子的产生,也可调节脓毒血症中的血管屏障和内皮功能[10]。EI 等[11]研究发现,在脓毒血症小鼠中miR-579 的表达异常升高,并且在脂多糖诱导的耐受细胞中表达也发生明显升高,miR-579 可靶向TNF-α,这说明该miRNA 在脓毒血症中具有积极的治疗作用。杨培雄等[12]发现,TNF-α 在脓毒血症老年患者血清中表达异常升高,并且与患者病情的严重程度呈正相关。猜测miR-579-3p 在脓毒血症中具有积极的治疗作用。为了验证此猜测,本研究建立了脓毒血症小鼠模型和过表达miR-579-3p 的转基因脓毒血症小鼠模型,检测其中miR-579-3p 表达,发现miR-579-3p 在脓毒血症模型小鼠血浆中表达异常升高,而在过表达miR-579-3p 转基因脓毒血症小鼠血浆中的表达水平更高,这说明miR-579-3p 在脓毒血症小鼠中的表达异常升高;在脓毒血症小鼠血清中炎症因子TNF-α、IL-8、IL-6的表达水平均升高,内皮细胞的焦亡率也发生明显升高,而在过表达miR-579-3p的转基因脓毒血症小鼠中TNF-α、IL-8、IL-6 的表达降低,内皮细胞的焦亡率也显著降低,这说明miR-579-3p 在脓毒血症小鼠中具有积极治疗作用。进一步通过生物信息学和双荧光素酶报告基因检测实验,发现miR-579-3p可靶向调控DEFA3。
脓毒血症期间各种体液(血液、支气管肺泡灌洗液和痰液)中HNP1-3 的水平大大增加,并且编码HNP1-3 基因的DEFA1/DEFA3 存在大量变异,明显影响脓毒血症患者的临床表型,且DEFA1/DEFA3基因升高的中国汉族患者更容易发生严重的脓毒血症[13-14]。CHEN等[15]在研究中报道,具有较高表达DEFA1/DEFA3基因的小鼠比具有较低表达DEFA1/DEFA3 的小鼠或野生型小鼠具有更严重的败血症相关的器官损伤和高病死率。从机制上讲,嗜中性粒细胞肽1 通过嘌呤受体(P2X7)介导的典型半胱氨酸天冬氨酸酶1活化以炎症小体依赖性方式诱导内皮细胞焦亡。CHEN等[14]研究发现,DEFA1/DEFA3是参与严重脓毒血症宿主免疫应答的重要基因组分。DEFA1/DEFA3 表达升高与严重脓毒血症风险显著相关。本研究检测了脓毒血症模型小鼠、敲减DEFA1/DEFA3 转基因脓毒血症小鼠血浆中DEFA3基因的表达,发现DEFA3在脓毒血症小鼠中表达异常升高,而在敲减DEFA1/DEFA3 转基因脓毒血症小鼠中表达降低,并且敲减DEFA1/DEFA3 后,小鼠血清中炎症因子TNF-α、IL-8、IL-6的表达降低,内皮细胞焦亡率显著降低,这说明敲减DEFA1/DEFA3基因对脓毒血症患者的治疗具有重要指导价值。miR-579-3p 和DEFA3 在脓毒血症小鼠模型中的表达均为异常上调,但是二者在脓毒血症中发挥的作用却不同。miR-579-3p 发挥抑制脓毒血症患者的炎症反应,而DEFA3则发生相反的作用。
综上所述,miR-579-3p 在脓毒血症小鼠中具有抗炎、抗焦亡的作用,其机制与靶向DEFA3 基因相关,本研究为脓毒血症的治疗提供新方向。
