难治性高血压合并睡眠呼吸暂停综合征患者血液细胞参数变化△
2022-03-22陈洁琼
劳 钰,陈洁琼,靳 文
(广东省第二人民医院心血管内三科,广州 510000)
难治性高血压(resistant hypertension,RH)是多种致病因素单独或协同引起的,以在改善生活方式基础上合理使用足量的包括利尿剂在内的3种及以上降压药物等方式积极治疗后血压仍不达标为主要特征的一类高血压[1]。RH 的危害在于长期血压控制不良诱发心、脑、肾等靶器官损害,导致主要不良心血管事件早发、高发,严重损害了患者的生活质量,加重了患者的经济负担。睡眠呼吸暂停综合征(sleep apnea syndrome,SAS)是指因在睡眠中反复发生的完全或不完全气道阻塞引起的以频繁低通气、呼吸暂停、间歇性缺氧或复氧和高碳酸血症、短暂觉醒为主要特征的临床综合征[2]。已有研究证实SAS 能够诱发交感神经兴奋、肾素-血管紧张素-醛固酮系统激活、血管内皮损伤及血管重建等多种途径促进RH 的发生[2-3]。此外,免疫炎症反应参与促进SAS 和高血压的发生、发展是近来临床研究的热点问题。作为固有免疫的重要组成部分,固有免疫细胞中性粒细胞、淋巴细胞等通过模式识别受体识别病原相关分子模式(pathogen associated molecular patterns,PAMPs)和(或)危险相关分子模式(damage associated molecular patterns,DAMPs),产生炎性细胞因子,介导炎症并驱动组织损伤和器官功能障碍[4]。固有免疫细胞及其介导的炎症反应可能在SAS促RH中起桥梁作用。本研究观察比较了SAS 合并RH 与未合并RH 两组患者的外周血细胞参数、C 反应蛋白、心脏参数等差异,以分析固有免疫细胞是否参与了SAS促RH的发生和发展。
1 资料和方法
1.1 一般资料
选择自2018 年1 月至2019 年12 月就诊于广东省第二人民医院心血管内三科的SAS 和(或)合并RH 患者共90 例。纳入标准:(1)非同日、大于3 次测得血压≥140/90 mmHg(1 mmHg=0.133 kPa),且最高收缩压≥180 mmHg 或最高舒张压≥110 mmHg;(2)接受夜间睡眠监测并符合SAS 诊断标准。排除标准:(1)年龄>80 岁和<18 岁;(2)明确诊断慢性肾功能衰竭需长期血液透析者,或入院后经相关检查明确诊断肾动脉狭窄、原发性醛固酮增多症、嗜铬细胞瘤等继发性高血压;(3)症状性高血压;(4)患有急性感染性疾病、恶性肿瘤、严重脏器功能衰竭、妊娠等。
RH 诊断标准:在改善生活方式基础上应用了可耐受的足够剂量且合理的3 种降压药物(包括一种利尿剂)至少治疗4 周以上血压仍未达标,或服用≥4 种降压药物才能使血压达标[1]。患者出院4 周后跟踪随访若达到以上标准,排除用药依从性、测量血压正确性、白大衣高血压等因素后,考虑血压较难控制,纳入RH 组。
SAS 诊断标准:每天晚上大约7 h 的睡眠中,反复多次出现呼吸暂停以及低通气达到30 次或以上,或者接受夜间睡眠监测测得呼吸暂停低通气指数≥5.0次/h[5]。患者住院期间行夜间睡眠监测若呼吸暂停低通气指数达以上标准纳入SAS组。
1.2 资料收集及观察指标
入组的患者均安排行超声心动图检查及夜间睡眠监测。记录患者一般基线临床资料:性别、年龄、身高、体质量、体质量指数、入院血压情况、出院用药情况。记录实验室及临床检查指标:血白细胞计数、中性粒细胞计数、淋巴细胞计数、血小板计数、血红蛋白、C 反应蛋白、左心房内径、左心室收缩末内径、左心室舒张末内径、升主动脉腔径、室间隔厚度、左心室后壁厚度、左心室射血分数、A 峰与E 峰流速比值(E/A ratio,E/A)、呼吸暂停低通气指数、夜间最低血氧饱和度。
1.3 睡眠呼吸功能监测结果与分组
根据是否合并RH 分为SAS 合并RH 组、SAS组,依据最低血氧饱和度分为正常组(夜间最低血氧饱和度>90%)、轻度缺氧组(85%<夜间最低血氧饱和度≤90%为、中度缺氧组(80%<夜间最低血氧饱和度≤85%)和重度缺氧组(夜间最低血氧饱和度≤80%)。
1.4 统计学分析
应用SPSS 22.0 软件进行统计学分析。计量资料以()表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析。计数资料以[n(%)]表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 SAS 组与SAS 合并RH 组患者基线资料比较
本研究共入选SAS 患者90 例,其中SAS 组患者55 例、SAS 合并RH 组患者35 例。入选患者一般临床基线资料见表1。基线资料中两组患者的体质量、体质量指数、入院收缩压水平、呼吸暂停低通气指数、夜间最低血氧饱和度、药物使用情况、脑梗死发生率、左心室射血分数、E/A 等比较,差异有统计学意义(P<0.05)。
表1 SAS 组与SAS 合并RH 组患者临床基线资料比较[n(%),]
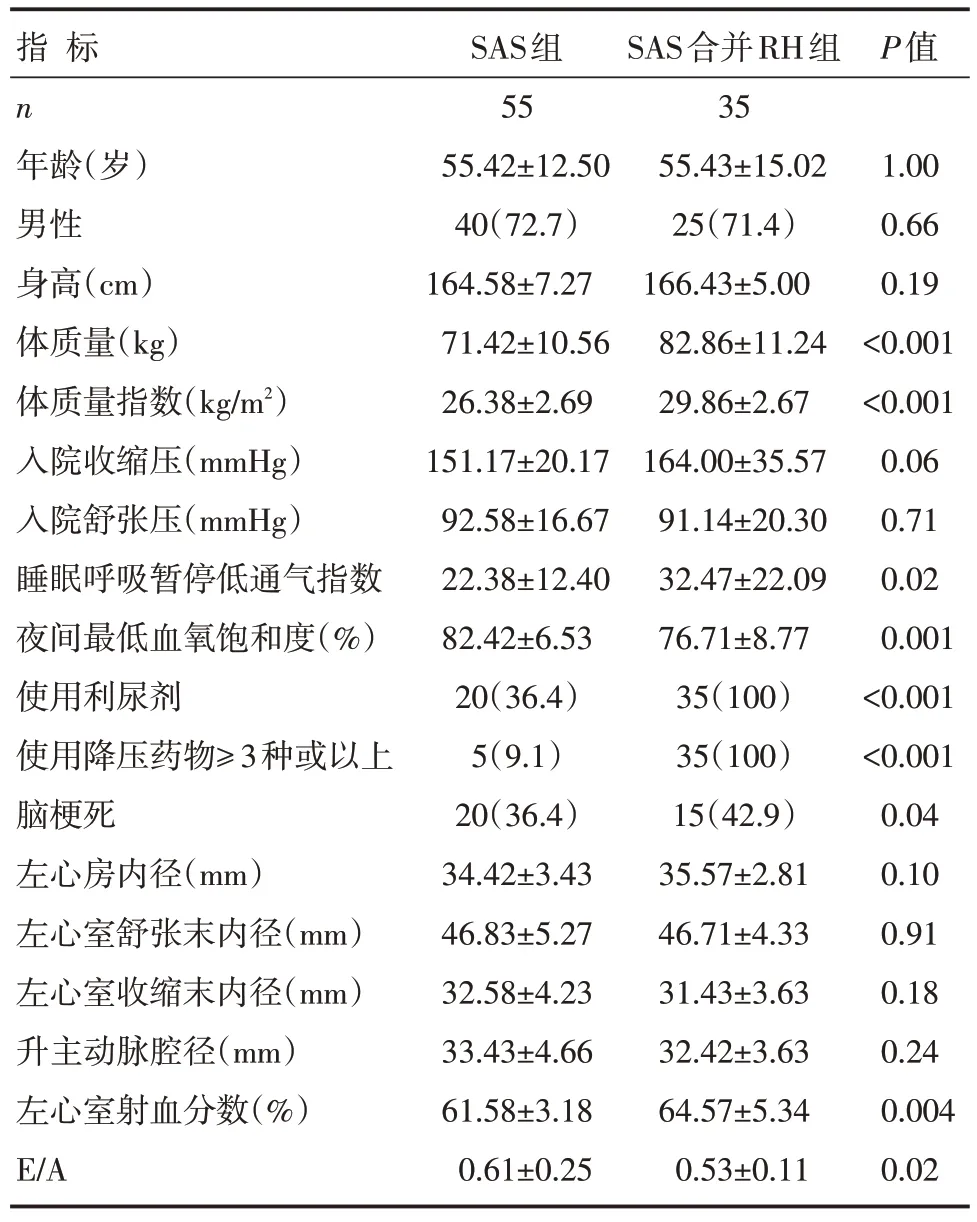
表1 SAS 组与SAS 合并RH 组患者临床基线资料比较[n(%),]
2.2 SAS 组与SAS 合并RH 组不同缺氧严重程度患者比例比较
SAS 合并RH 组与SAS 组不同缺氧严重程度患者比例比较,差异有统计学意义(P<0.05):SAS合并RH 组的重度缺氧患者比例显著高于SAS 组,中度缺氧患者比例显著低于SAS 组,见表2。
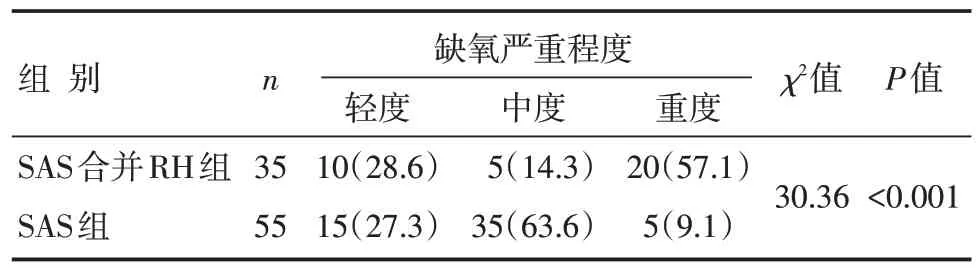
表2 SAS 组与SAS 合并RH 组不同缺氧严重程度患者比例比较 [n(%)]
2.3 SAS 组与SAS 合并RH 组患者血细胞参数、C 反应蛋白以及左心室结构参数的比较
SAS 合并RH 组与SAS 组患者的血细胞参数、C 反应蛋白以及左心室结构参数比较显示:SAS 合并RH 组患者的白细胞、中性粒细胞、淋巴细胞、中性粒细胞与淋巴细胞比值、血小板、C 反应蛋白、左心室后壁厚度、室间隔厚度明显高于SAS组,差异有统计学意义(P<0.05),见表3。
表3 SAS合并RH组与SAS组患者的血细胞参数、中性粒细胞与淋巴细胞比值、C反应蛋白、左心室结构参数的比较 []
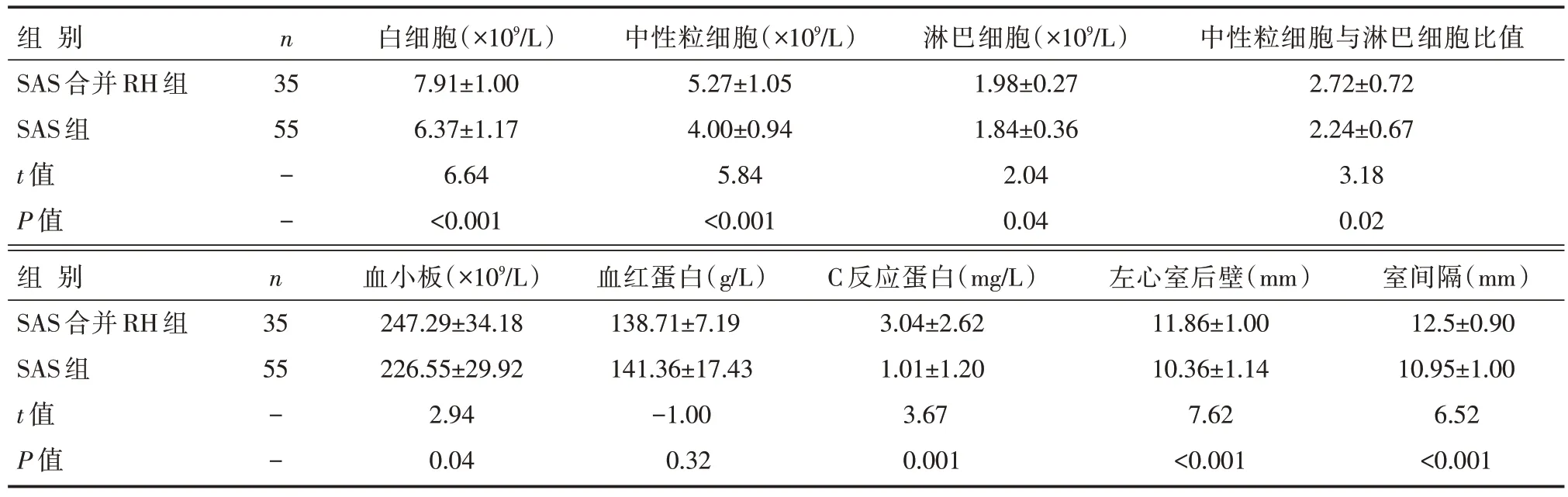
表3 SAS合并RH组与SAS组患者的血细胞参数、中性粒细胞与淋巴细胞比值、C反应蛋白、左心室结构参数的比较 []
2.4 不同缺氧程度组患者血细胞参数、C 反应蛋白以及左心室结构参数的比较
不同缺氧程度组患者的白细胞、中性粒细胞、淋巴细胞、血红蛋白、C 反应蛋白、左心室后壁厚度、室间隔厚度比较,差异有统计学意义(P<0.05),见表4。
表4 不同缺氧程度组患者的血细胞参数、中性粒细胞与淋巴细胞比值、C 反应蛋白、左心室结构参数比较[]
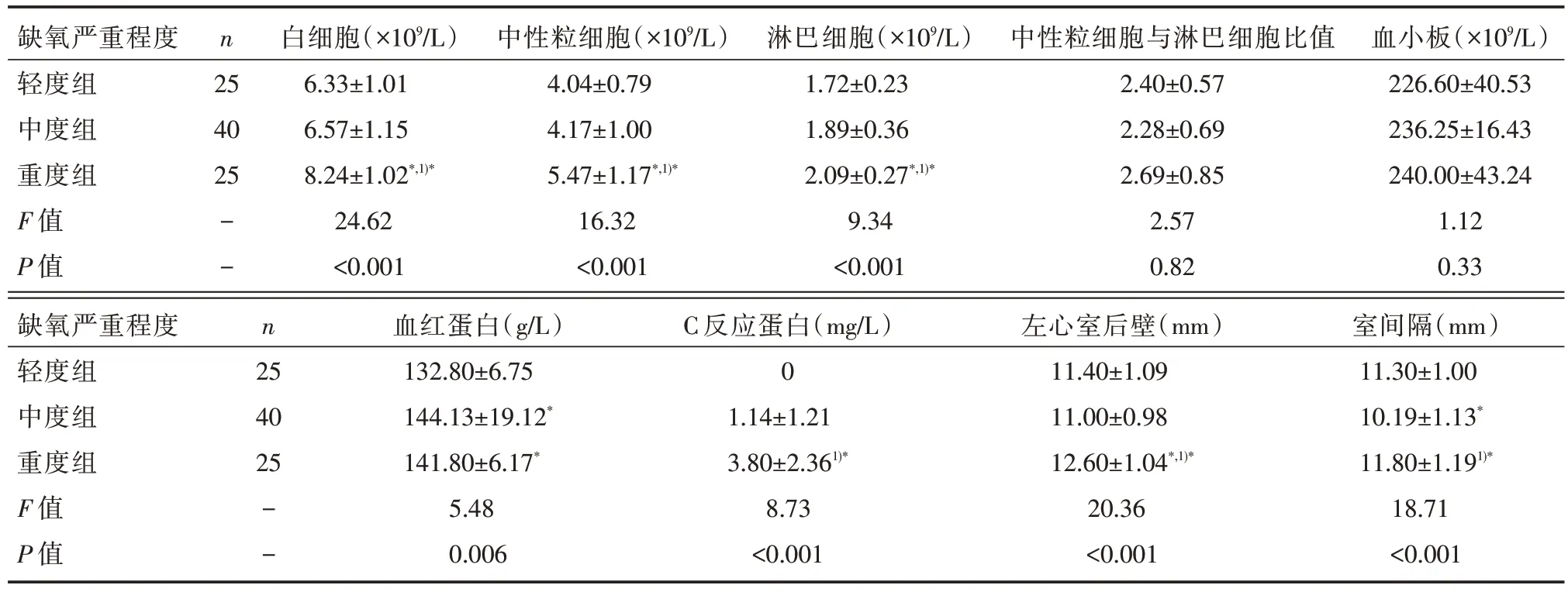
表4 不同缺氧程度组患者的血细胞参数、中性粒细胞与淋巴细胞比值、C 反应蛋白、左心室结构参数比较[]
注:与轻度组比较,*P<0.05;与中度组比较,1)*P<0.05
3 讨论
本研究结果显示,相对于单纯SAS 患者,合并RH 的SAS 患者夜间缺氧严重程度加剧,白细胞、中性粒细胞、淋巴细胞、中性粒细胞与淋巴细胞比值、血小板、C 反应蛋白、左心室后壁厚度和室间隔厚度升高;提示固有免疫细胞及其介导的炎症反应可能参与了SAS 促进RH 的形成。
本研究发现相对于SAS,合并RH 的SAS 患者用药种类多,脑梗死发生率高,心脏舒张功能下降,夜间重度缺氧患者比例增高,且室间隔、左心室后壁增厚明显增强。SAS 降低降压药物的治疗效果,增加高血压相关靶器官损害的发病生率,其如何参与高血压等心血管疾病的发生和进展一直是临床和基础研究的热点问题[6]。本研究结果提示SAS 患者夜间缺氧的严重程度是SAS 促进RH及其并发症发生的重要因素。
本研究发现相对于SAS 患者,合并RH 的SAS患者循环白细胞、中性粒细胞、淋巴细胞等固有免疫细胞数和全身炎症标记中性粒细胞与淋巴细胞比值及C 反应蛋白等表达升高。白细胞、中性粒细胞、淋巴细胞等固有免疫细胞数在合并RH 的SAS 患者中计数升高,提示升高的炎症状态与RH的发病风险可能存在相关,如中性粒细胞可通过介导微炎症参与高血压的发生,中性粒细胞的活性升高与血压升高相关[7-8],提示固有免疫细胞及其介导的炎症参与调控了血压升高和高血压的发生和(或)维持[9]。在多个临床研究中将中性粒细胞与淋巴细胞比值作全身炎症标记,流行病学研究也进一步证实中性粒细胞与淋巴细胞比值可以作为高血压的预测因素[10]。
本研究进一步证实相对于SAS 患者,合并RH的SAS 患者的缺氧程度加重、中性粒细胞和淋巴细胞计数以及C 反应蛋白、中性粒细胞与淋巴细胞比值升高。基础研究证实间歇性缺氧激活中性粒细胞等固有免疫细胞产生并释放,促使C 反应蛋白等促炎症因子、活性氧、黏附分子至循环或周围组织,导致血管平滑肌细胞的增殖、血管张力增高,激活肾素-血管紧张素-醛固酮系统,影响下丘脑对激素分泌、血钠排泄的控制,打破交感神经、副交感神经的平衡,在高血压的发生、发展中发挥重要的作用[11-12]。因此,本研究的结果进一步提示SAS 患者缺氧是引起固有免疫细胞活化和促进RH 形成的重要原因。
此外,本研究发现相对于SAS 患者,合并有RH 的SAS 患者外周血小板计数增多,原因可能在于间歇性低氧血症引起肿瘤环死因子-α、白细胞介素-6 炎症因子分泌增多,巨核细胞活化,血小板产生增多[13-15]。活化的血小板又可分泌5-羟色胺、血小板细胞因子和血栓素等多种促炎物质,引起血管炎性反应和血管重建,导致血压升高[15-16]。
综上所述,本研究发现合并RH 的SAS 患者缺氧严重程度加剧、外周血固有免疫细胞增多、活化,提示缺氧引起的固有免疫细胞活化在SAS 促RH 形成中扮演重要角色。在今后研究中,将对SAS 环境下缺氧介导的固有免疫细胞活化及其诱发RH 形成和维持的具体机制进行深入探讨。
