甲真菌病患者甲微生物群分析
2022-03-02胡坚张舒煜张文革闫紫恒李厚敏
胡坚 张舒煜,2 张文革 闫紫恒 李厚敏
(1. 北京大学人民医院皮肤科,北京 100044;2. 厦门大学附属第一医院皮肤科,厦门 361003)
健康皮肤的表面存在着常驻微生物群,在抵御外来微生物入侵、激活固有免疫、维持皮肤微生态平衡等方面起着重要作用[1]。随着第二代测序技术的发展与广泛应用,对常驻微生物群的构成及其与免疫系统相互作用的了解逐渐深入[2]。以往的研究证实足癣患者与健康人的足部皮肤具有不同的微生物群,可能与足癣的发病具有密切联系[3-4]。甲真菌病常与足癣伴发,病程长且治疗困难,病甲作为身体其他部位真菌感染的潜在来源,严重影响患者的生活质量[5]。虽然依靠培养的方法,也能发现某些甲真菌病病甲中存在多种真菌的混合感染或真菌合并细菌的多重感染,但目前仍缺乏对甲真菌病微生物群的了解,深入分析和比较微生物群的构成,研究共生真菌、细菌与致病真菌的相互作用,能够为更好地理解甲真菌病的发病机制、为发现治疗甲真菌病的潜在靶点提供思路。
1 材料与方法
1.1 研究对象
收集来源于2019年9月至2019年12月期间,就诊于北京大学人民医院皮肤科、诊断为甲真菌病的患者(入选标准为:①具有典型的临床表现;②真菌镜检阳性;③就诊前3个月内未口服抗真菌、抗细菌药,1个月内未外用抗真菌药、抗细菌药)。
1.2 真菌镜检、培养及形态学鉴定
直接镜检 75%的酒精消毒,无菌钝刀刮取病变明显部位的甲屑,荧光染色后制片,显微镜下观察菌丝的形态。
真菌培养及鉴定 将真菌镜检阳性的甲屑多点接种于含氯霉素(50 mg/L)的沙堡弱培养基,置于28℃培养箱培养2~4周,观察菌落生长情况,若4周后仍无菌落生长则为阴性。培养阳性的致病菌进行分离纯化,形态学及ITS区序列鉴定。
1.3 致病菌微生态分析
分组及取材 共收集47例患者及7例健康志愿者的甲屑。47例患者病甲甲屑为病例组,取其中29例仅单侧受累患者的对侧健甲甲屑为自身对照组,健康志愿者的正常甲屑为健康对照组。75%酒精消毒,用无菌生理盐水润湿棉签,擦拭指(趾)甲表面,再用钝刀片或指甲剪刮取/剪下甲屑,最后用同一棉签再次擦拭甲面。收集棉签与刮刀采集的全部甲屑于1.5 mL无菌EP管内,并于-80℃冻存。
分子生物学鉴定 提取甲屑DNA,对细菌16S rDNA V3-V4区、真菌ITS1及ITS4进行扩增。使用TruSeq©DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建,并通过Q-PCR定量。利用Uparse软件(V7.0.1,http://www.drive5.com/uparse/)进行聚类,对OTUs序列进行物种注释,用Mothur法与Silva132(http://www.arb-silva.de/)的SSU rRNA数据库进行物种注释分析。使用MUSCLE软件(V3.8.31,http://www.drive5.com/muscle/)进行快速多序列比对。使用QIIME软件(V1.9.1)和R软件(V2.15.3),进行α多样性、β多样性、Simper分析及Spearman相关性分析。α多样性通过Observed Species指数和Shannon指数进行分析,β多样性通过Unweighted Unifrac距离来进行PCoA分析。
1.4 统计学方法
采用SPSS16.0统计学软件进行数据处理和分析。菌属及菌种分布的比较采用χ2检验。α多样性Observed Species和Shannon指数的组间差异性分析采用t检验或Wilcoxon检验,P<0.05为差异有统计学意义。
2 结 果
2.1 甲真菌病患者的临床和真菌学结果
最终纳入47例甲真菌病患者,其中男性22例,女性25例;年龄分布18~79岁,平均48.0岁(见表1)。按工作的强度和性质对职业进行分类,纯文职工作者13例(27.66%),少量体力劳动工作者28例(59.57%),体力劳动为主工作者6例(12.77%)。病程1个月~50年,平均62.6个月。累及趾甲者36例,指甲者5例,指/趾甲均有感染者6例。受累最多的为拇趾甲(37例),其次是足第五趾甲(15例)。临床表现分类示远端侧位甲下型28例,全甲损毁型14例,浅表白斑型2例,近端甲下型1例,甲板内型2例。

表1 47例甲真菌病患者的性别及年龄段分布Tab.1 Gener and age distribution of 47 patients with onychomycosis 例(%)
47例甲屑标本全部镜检阳性,培养阳性22例(46.81%)。共分离出致病真菌25株:包括皮肤癣菌15株(60.0%),其中红色毛癣菌12株(48.0%)、趾间毛癣菌3株(12.0%);酵母菌2株(8.0%):白念珠菌1株(4.0%)、毛孢子菌属1株(4.0%);非皮肤癣菌性霉菌8株(32.0%):青霉属3株(12.0%)、枝孢霉属3株(12.0%)、曲霉属1株(4.0%)、球毛壳菌1株。混合感染3例(6.38%),分别为红色毛癣菌合并毛孢子菌属、青霉属合并枝孢霉属、青霉属合并曲霉属感染。
2.2 测序得到的真菌和细菌的相对丰度
病例组真菌DNA扩增合格14例、细菌DNA扩增合格13例、真菌和细菌DNA扩增同时合格13例;自身对照组真菌DNA扩增合格2例、细菌DNA扩增合格19例、真菌和细菌DNA扩增同时合格1例;健康对照组真菌DNA扩增合格0例、细菌DNA扩增合格5例。
在种水平上,共发现291个真菌菌种。病例组和自身对照组均以红色毛癣菌为主(比例分别为66.49% 、43.40%)。病例组的菌种其次为白念珠菌(5.36%)、近平滑念珠菌(1.35%)。自身对照组的菌种其次为三叶草浪梗霉(13.21%)、互隔交链孢霉(1.99%)。差异均具有统计学意义(P<0.05,见图1)。
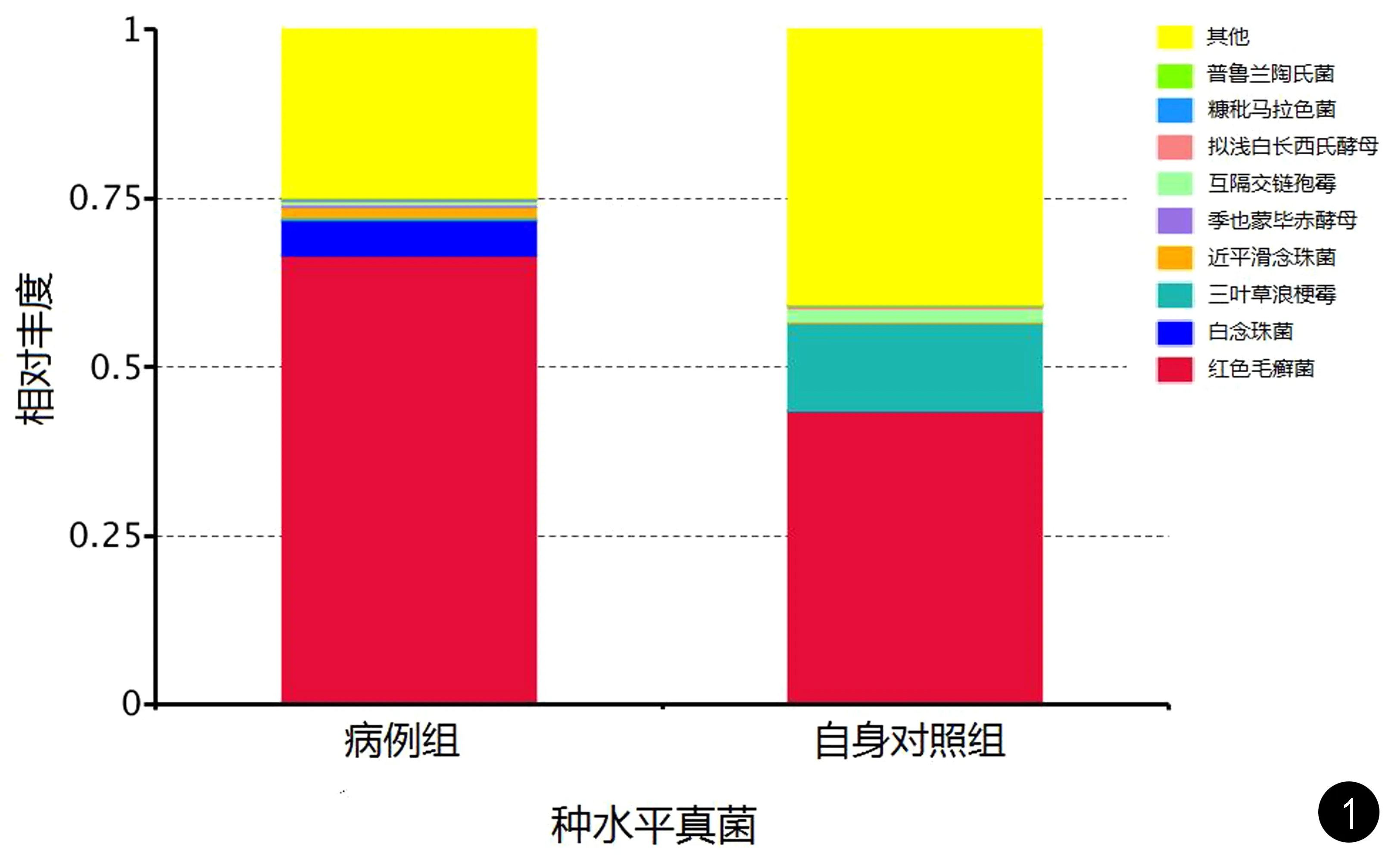
图1 甲癣患者病甲及对侧健甲真菌菌种丰度Fig.1 Abundance of fungal community in diseased nails and healthy nails of patients with onychomycosis
在种水平上,共发现422个细菌菌种。病例组、自身对照组、健康对照组均以结核硬脂酸棒状杆菌为主(比例分别为7.01%、 9.20% 、6.19%),差异无统计学意义。病例组菌种相对丰度第2位为口腔放线菌(2.45%),第3位为污泥罗氏菌(2.28%)。自身对照组菌种相对丰度第2位为污泥罗氏菌(4.54%),第3位为杰氏棒状杆菌(2.70%)。健康对照组菌种相对丰度第2位为混棒状杆菌(2.27%)。污泥罗氏菌在健康对照组检出比例很小,显著低于病例组和自身对照组;杰氏棒状杆菌和混棒状杆菌在病例组中检出比例很小,显著低于自身对照组和健康对照组;以上差异均具有统计学意义(P<0.05,见图2)。
2.3 α多样性分析
Observed species指数代表了每个样本中观察到的菌种数目,其数值越高,说明菌种丰富度越高。Shannon指数用来描述菌种丰富度和均匀度,Shannon指数值越高,表明菌群的α多样性越高。病例组的真菌菌群的Observed species显著高于自身对照组(P<0.01),因此病例组的真菌菌群丰富度高于自身对照组。而细菌菌群在健康对照组的丰富度最高,之后依次为自身对照组、病例组。病例组真菌菌群的Shannon指数中位数稍低于自身对照组,但其箱型图的离散程度高于自身对照组,说明病例组与自身对照组的多样性差异不大。细菌菌群的Shannon指数箱形图对比发现,自身对照组的中位数最高,说明自身对照组细菌菌群的多样性较高(见图3)。
2.4 β多样性分析
β多样性的比较发现,真菌菌群在病例组和对照组间的聚集不明显,而细菌菌群在病例组、自身对照组和健康对照组间的聚集较明显,自身对照组的细菌菌群与病例组和健康对照组均有部分重叠(见图4)。
2.5 Simper分析
真菌属水平上差异贡献最大的菌属依次为毛癣菌属、念珠菌属、浪梗霉属、毕赤酵母菌属等;细菌属水平上差异贡献最大的菌属依次为葡萄球菌属、罗氏菌属、棒状杆菌属等。
2.6 Spearman相关性分析
在病甲的微生物群中,葡萄球菌属与毛癣菌属呈显著正相关。罗氏菌属与马拉色菌属和Naganishia菌属呈显著正相关。棒状杆菌属与拟锁瑚菌属呈显著正相关,而与马拉色菌属等其他真菌呈负相关。放线菌属与真菌的关系较为密切,其与念珠菌属、马拉色菌属、Naganishia菌属、红酵母属呈显著正相关,而与毛癣菌属显著负相关(见图5)。
3 讨 论
本研究共分离、培养并鉴定致病真菌25株,其中皮肤癣菌占60.0%。尽管皮肤癣菌仍是甲真菌病最重要的致病菌,但与地区甲真菌病病原菌流行病学调查资料一致,其总体占比呈下降趋势[6-8];酵母菌和非皮肤癣菌性霉菌的感染比例呈上升趋势,可能与免疫功能受损人群的增加有关[9]。本研究通过真菌培养分离出毛孢子菌1株,以及球毛壳菌1株,两者均为少见的甲真菌病致病菌;此外发现混合感染3例,提示了甲真菌病致病菌的构成存在复杂性,当治疗效果不佳时需根据病原菌菌种选择合适的抗真菌药。
趾间皮肤汗腺发达但缺乏皮脂腺,由于密闭不透气致温暖潮湿,利于真菌及细菌的生长。足部出汗较多的人更易发生足癣及趾甲的甲真菌病,由于长期搔抓和接触,还可引起手癣及指甲的甲真菌病。对趾间型足癣患者及健康人趾间皮肤的微生物群研究发现趾间皮肤的细菌菌群主要为葡萄球菌属、棒状杆菌属,并且趾间型足癣患者的链球菌属丰度增加[4]。本研究揭示了甲真菌病的细菌菌群的构成。通过Simper分析发现,病甲中对细菌菌群差异贡献最大的菌属依次为葡萄球菌属、罗氏菌属、棒状杆菌属等,与趾间皮肤的细菌菌群分布具有很大的相似性。
通过测序结果的α多样性比较发现,甲真菌病患者病甲的真菌菌群的丰富度高于对侧健康甲,但两者的多样性差异不明显,推测甲真菌病患者的病甲和健康甲由于密切接触具有相似的真菌菌群。而甲真菌病患者的健甲由于皮肤感染也更易被致病真菌定植,发生成为病甲的可能性增大。另一方面,甲真菌病患者健甲细菌菌群的多样性高于病甲及健康人甲,这与β多样性比较所发现的自身对照组的样本点与病例组和健康对照组均有部分重叠具有一致性[3-4]。
β多样性比较发现,真菌菌群在病例组和对照组间的聚集不明显,推测与自身对照组样本量过少有关,代表性不足;细菌菌群在病例组、自身对照组和健康对照组间的聚集较明显,自身对照组的样本点较为分散,与病例组和健康对照组均有部分重叠,提示自身对照组的细菌菌群分布有可能会由健甲向病甲转变,首先失去健甲正常的细菌菌群分布,继而转变为病甲。
Spearman相关性分析表明,真菌和细菌菌群间可能存在相互联系。以往研究认为,真菌可以通过多种方式与细菌相互作用,包括通过分泌信号分子、改变局部微环境和形成生物膜等[10];微生物群之间相互合作或对抗,有利于菌群保持平衡,而在某些内因或外因的作用下,某些菌群的变化可能会导致甲内菌群失衡,从而促进感染发生。通过上述研究结果,我们推测甲真菌病的发展可能依赖于多种微生物的协同作用,但其具体的作用方式还需要进一步的研究。
第二代测序技术的发展及广泛应用为我们打开了全新的视野,既往认知中的无菌组织如乳腺组织被发现存在着微生物群[11],且测序对于微生物群检测的敏感性远高于培养,鉴定结果能够精确到菌种,弥补了培养鉴定的不足[12]。不同种属的微生物之间如何相互拮抗、保持平衡;这些微生物如何与宿主的免疫系统相互作用,与人体健康和疾病息息相关。目前对于浅部真菌感染性疾病的微生物群研究尚处于早期阶段,微生物群分布的信息将为我们解决感染发生机制、新的治疗方法提供新思路。
