烟曲霉的细胞外囊泡蛋白质及RNA分析
2022-03-02陈晨贺彬婵朱益敏赵蓓蕾陈菲徐小勇
陈晨 贺彬婵 朱益敏 赵蓓蕾 陈菲 徐小勇
[1.东部战区总医院呼吸与危重症医学科,南京 210002;2.南京中医药大学第二附属医院江苏省第二中医院呼吸与危重症医学科,南京 210017;3.南京中医院大学附属南京医院(南京市第二医院)结核四科,南京 211131]
远距离的细胞间通讯日益受到重视,这种通讯的重要载体就是细胞分泌的细胞外囊泡(extracellular vesicles, EVs)[1-2]。EVs是细胞合成、分泌的一类由双层脂质膜包裹的尺寸在纳米至微米范围内的囊泡状小体。它选择性携带细胞的信息,外排分泌到细胞外环境中,进而与靶细胞结合,主要执行信息和物质传递的信使功能。作为重要的致病原,真菌包括烟曲霉同样也能分泌EVs[3-5]。明确EVs的成分是掌握曲霉致病机制的重要环节,为此我们通过分子生物学方法结合生物信息学对EVs中重要成分进行分析。
1 材料与方法
1.1 曲霉的生长
标准烟曲霉株AF273接种于沙堡弱培养基,37℃培养箱中孵育5 d。无血清RPMI-1640细胞培养基洗下,16层无菌纱布过滤,悬液含孢子107/mL,置于37℃,48 h后镜下有明显菌丝形成。
1.2 分离出细胞外囊泡(EVs)
吸取曲霉培养的上清,然后4℃下4 000 g离心15 min,去除沉淀的曲霉,留上清,然后15 000 g,15 min去除破碎细胞片。剩余上清,0.45 μm的滤器过滤。然后4℃,100 000 g离心1 h,上清去除,然后5倍重悬(0.1 mol/L TBS),4℃,100 000 g离心1 h,留取沉淀。
1.3 纳米颗粒跟踪分析(nanoparticle tracking analysis,NTA)
采用马尔文纳米颗粒跟踪分析仪(Nanosight NS300),软件选择NTA 3.0分析软件,分析溶液中EVs的大小分布。
1.4 电镜检测(electronic microscopy)
EVs戊二醛固定,PBS清洗3次,加入0.5 mL 2%锇酸溶液4℃固定2 h。PBS清洗后乙醇1 mL梯度脱水。用1 mL丙酮置换2次。将样品放入盛有纯包埋剂的包埋板中。将包埋板置于65℃条件下聚合48 h。醋酸双氧铀染色10 min后清洗;醋酸铅染色10 min后清洗。电镜观察。
1.5 EV组分析
样品从-80 ℃取出,分别加入4倍体积裂解缓冲液,超声裂解。去除细胞碎片后利用BCA试剂盒进行蛋白浓度测定。胰酶酶解的肽段除盐后真空冷冻干燥。TEAB溶解肽段,根据TMT试剂盒操作说明标记肽段。肽段用高pH反向HPLC分级,色谱柱为Agilent 300Extend C18。肽段经由超高效液相系统分离后被注入NSI离子源中进行电离然后进Q Exactive HF-X质谱进行分析。二级质谱数据使用Maxquant (v1.5.2.8)进行检索。
2 结 果
2.1 电镜观察EVs
我们通过离心法提取烟曲霉的EVs,电镜检测,可见明显的双层脂质结构(见图1)。

图1 电镜下烟曲霉的EVs形态Fig.1 EVs morphology of Aspergillus fumigatus under electron microscope
2.2 NTA
通过NTA发现,烟曲霉的EVs大小主要集中在130 nm左右(见图2)。
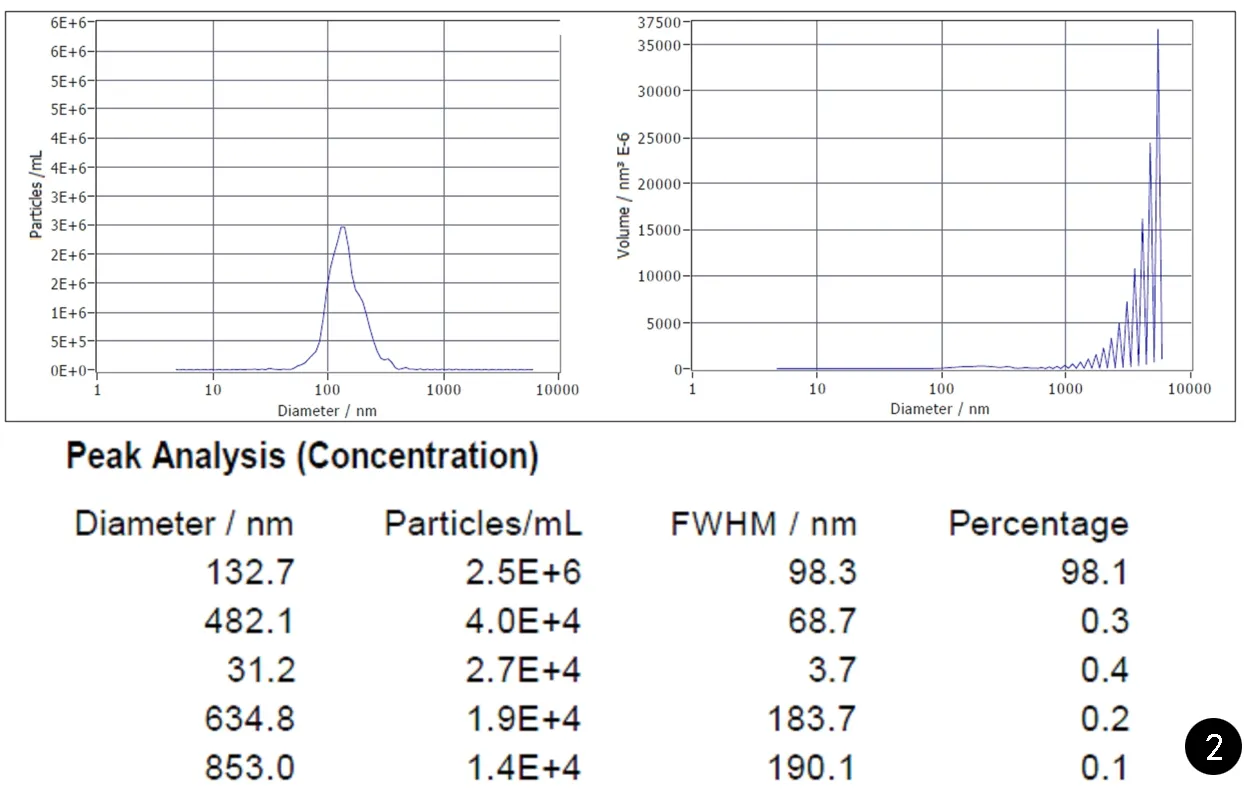
图2 NTA分析烟曲霉的EVs大小分布Fig.2 EVs size distribution of Aspergillus fumigatus analyzed by NTA
2.3 蛋白质组学分析
通过质谱,以烟曲霉的基因组序列(AF1163),进行对比。利用http://www.aspgd.org/中GO分析和Pubmed对序列进行描述和推测其功能。PSORT(https://www.psort.org/)对序列进行定位分析。通过蛋白软件分析,EVs蛋白中非稳定蛋白为9种(15%),其余为稳定蛋白,而PI>7的为6种蛋白,因此在体内大部分蛋白带有负电荷。
蛋白定位分析 EVs中大部分是胞浆蛋白,其余比较多的是细胞外分泌蛋白,但仍有25%的蛋白不能定位,需要进一步实验(见图3)。
穿膜蛋白和GPI锚定蛋白分析 通过TMPred和GPI预测,有5种蛋白存在双层脂质膜上(见表2)。

表2 存在于双层脂质膜上的5种蛋白
2.4 RNA组学分析
RNA分布 检测到RNA中主要是rRNA和tRNA分别占59.7%和29.4%,而miRNA占0.25%(见图4)。
miRNA的分布情况 烟曲霉EVs里miRNA的长度分布在17~29 nt,主要在19~24 nt(见图5)。
miRNA可能影响的一些通路 由于烟曲霉EVs可以被细胞吞噬而进入人体细胞内,而影响的宿主细胞的生理过程,特别是miRNA存在特殊结构可不易被宿主细胞内RNA酶降解而发挥一定作用。同时烟曲霉的miRNA数据库尚未建立,因此我们参照人的miRNA数据库分析烟曲霉EVs中miRNA可能参与的一些通路(见图6)。我们可以发现EVs-miRNA主要可能影响代谢通路,其他如mTOR、肌动蛋白相关细胞骨架、Ras、MAPK、PI3K-Akt等信号通路也有一定比例参与。

图6 EVs中miRNA可能参与的信号通路分析图
3 讨 论
临床上患者肠道菌群的改变可伴随肺部炎症或哮喘出现。局限性的慢性曲霉病患者出现大片肺浸润和喘息症状,这并非病原体的播散,而是微生物分泌的生物活性物质对机体的刺激,而这种远程通讯的重要载体就是细胞分泌的EVs。20世纪60年代就证实病原微生物可以分泌EVs,早期被认为是微生物的代谢废物,但越来越多的研究表明Evs在病原体感染过程中起着极为重要的作用,病原体分泌的EVs可诱导宿主细胞坏死、凋亡,诱发炎症反应,可以成为微生物毒力的载体,而有时候EVs可刺激宿主免疫反应[1,6],协助宿主清除微生物。大肠杆菌分泌的EVs入血可出现宿主出现脓毒症。正常肠道菌群分泌的EVs可调节宿主的免疫功能,脆弱拟杆菌的EVs通过宿主的TOLL样受体2(TOLL like receptor 2,TLR2),刺激Foxp3表达,增加CD4细胞中IL-10分泌[7],减少免疫性肠炎、哮喘等发生。真菌的EVs研究始于2007年,越来越多的研究表明其承载的大分子在感染中起着关键的调节作用,格特隐球菌强毒力株分泌的EVs能刺激巨噬细胞内正常非毒力株的快速增殖,而毒力的主要承担物质是RNA和蛋白[8]。而作为人类重要致病原的曲霉其研究尚处起步阶段,2019年Souza[4]证实了烟曲霉也能分泌EVs,并做了初步的蛋白组学的分析,曲霉分泌的EVs可被巨噬细胞识别和吞噬,并且可增强巨噬细胞黏附、吞噬杀灭曲霉孢子的能力,但其炎症涉及的通路并未明确。

真菌与动物细胞重要的不同就是存在坚硬的细胞壁,这层细胞壁可能会阻断一些物质的分泌,包括囊泡的分泌。最近的研究表明新生隐球菌和白念珠菌的细胞壁并非坚硬密闭的一层结构,而是能允许其60~80 nm的EVs分泌[9],干扰细胞壁合成后EVs大小分布无明显改变。我们的实验发现烟曲霉也能分泌EVs,其直径大小主要分布在130 nm左右,证实了曲霉的细胞壁也不能阻止分泌EVs,但我们之前的实验都是在烟曲霉菌丝状态,而对于细胞壁成分结构更为坚实的孢子状态尚未有研究。真菌分泌EVs的途径尚存在很大空白,蛋白质分析EVs中大部分是胞浆内蛋白,这样提示真菌的EVs分泌类似其他细胞的外泌体分泌途径,从胞浆内起始。通过RNA的分析也证实了这一点,烟曲霉EVs中大部分RNA为rRNA和tRNA也提示EVs起源于真菌的胞浆,从具体含量可推测烟曲霉分泌细胞内成分并非致病机制的主动行为,或许分泌EVs只是生物体的固有本能机制或者细胞间信号和物质交流的重要机制。
通过生物信息学分析,有可能对EVs中关键信号分子进行推测。烟曲霉EVs存在数十种的蛋白质,其中包括Hsp90和Hsp70高度同源蛋白。这种同源蛋白与NOD受体-Casp9存在一定相互作用,Hsp90与NOD的CARD域结合抑制NOD降解而利于炎性信号的传递[10],Hsp也可通过TLR2途径影响宿主免疫[11]。而NOD在抗曲霉免疫中也有重要作用[12],而NOD通过多种蛋白可以和NLRP3存在相互作用。EVs中miRNA分析,最主要的是对代谢途径的影响,而具体的作用还待进一步的研究。另外,还有很多miRNA可能涉及mTOR、肌动蛋白相关细胞骨架、Ras、MAPK、PI3K-Akt等信号通路,这些信号通路都可能对炎症反应起重要作用。本研究尚有很多提升地方,比如需进一步检测EVs中多糖成分,这类物质可能更会刺激宿主细胞产生炎症反应。
总之,我们证实了烟曲霉也能分泌EVs,其中位直径在130 nm,含有较多种蛋白,以烟曲霉胞浆蛋白为主,RNA以rRNA和tRNA为主,而其中miRNA可能涉及多种信号通路。
