例析氧化还原反应滴定法常见类型及其应用
2022-02-22王春
王 春
(北京教育学院)
编者按
2020年1月13日,《教育部关于在部分高校开展基础学科招生改革试点工作的意见》决定自2020年起,在部分高校开展基础学科招生改革试点(也称强基计划),旨在选拔培养有志于服务国家重大战略需求且综合素质优秀或基础学科拔尖的学生.为了使全国高中优秀学生高效备战每年高校开展的强基计划招生考试,本刊特刊发强基计划系列备考文章,以飨广大读者.
氧化还原滴定是以氧化剂或还原剂为滴定剂,直接滴定一些具有还原性或氧化性的物质,或者间接滴定一些本身并没有还原性或氧化性,但能与某些还原剂或氧化剂反应的物质.该种方法的应用在近年来高校自主招生考试和高考试题中出现频率较高,本文现就常见的氧化还原滴定方法基本类型进行介绍,并结合典型例题分析该种方法的具体应用.
1 高锰酸钾法
1.1 基本原理
1)在强酸性溶液中
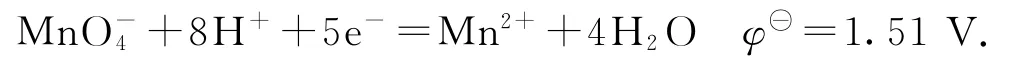
2)在中性或弱酸(碱)性溶液中

3)在强碱性溶液中

1.2 基本特点
高锰酸钾法在各种介质条件下均能应用,因其在酸性介质中有更强的氧化性,一般在强酸性条件下使用.但在碱性条件下氧化有机物的反应速率较快,故滴定有机物常在碱性介质中进行.高锰酸钾法的优点是氧化能力强,可应用于直接、间接、返滴定等多种滴定分析,可对无机物、有机物进行滴定,应用很广,且无须另加指示剂,本身为自身指示剂.
1.3 基本应用
1)直接法测定还原性物质
例如,KMnO4测定FeSO4·7H2O含量,滴定反应方程式为

2)间接法测定氧化性物质
例如,在测定MnO2的含量时,先用过量的与MnO2反应,然后用KMnO4标准溶液返滴定剩余的.具体反应方程式为

例1(强基模拟题)天然石灰石是工业生产中重要的原材料之一,它的主要成分是CaCO3,一般以CaO的质量分数表示钙含量,常采用高锰酸钾法测定.步骤如下:
Ⅰ.称取ag研细的石灰石样品于250mL烧杯中,加过量稀盐酸溶解,水浴加热10min;
Ⅱ.稍冷后逐滴加入氨水至溶液pH≈4,再缓慢加入适量(NH4)2C2O4溶液,继续水浴加热30min;
Ⅲ.冷却至室温后过滤出沉淀,用另外配制的稀(NH4)2C2O4溶液洗涤沉淀3次,再用蒸馏水洗涤至洗涤液中无法检出Cl-;
Ⅳ.加入适量热的稀硫酸至沉淀中,获得的溶液用cmol·L-1KMnO4标准溶液滴定至终点;
Ⅴ.平行测定3次,消耗KMnO4溶液的体积平均为VmL.
则样品中以CaO质量分数表示的钙含量为_________(列出表达式).
解析
滴定时草酸溶液与酸性高锰酸钾反应,H2C2O4被 氧 化 为CO2,KMnO4被 还 原 为Mn2+,发生反应的离子方程式为5H2C2O4+2MnO-4+6H+=2Mn2++10CO2↑+8H2O.
由 关 系 式:5CaO~5CaC2O4~5H2C2O4~2KMnO4,可知样品中
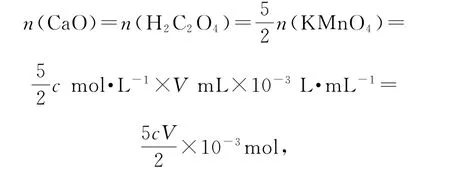
则以CaO质量分数表示的钙含量为

例2(强基模拟题)工业膜电解法制得的焦亚硫酸钠(Na2S2O5)会含有杂质(杂质不与高锰酸钾反应),取某Na2S2O5产品10.0g配成100mL溶液,取10.00mL加入20.00mL0.3000mol·L-1酸性高锰酸钾溶 液,充 分反应后,用0.250 0 mol·L-1的Na2SO3标准液滴定至终点,消耗Na2SO3溶液20.00 mL.已知:

则Na2S2O5样品的纯度为_____.
解析


Na2S2O5样品的纯度为

2 重铬酸钾法
2.1 基本原理
K2Cr2O7是一种常用的氧化剂,一般在酸性条件下滴定,还原产物为Cr3+(绿色),其反应方程式为

2.2 基本特点
K2Cr2O7具有化学性质稳定,副反应少等优点,易制成高纯度试剂,其标准溶液可直接配制.另外,K2Cr2O7不会氧化氯离子而产生误差,可以在盐酸介质中进行滴定.
2.3 基本应用
重铬酸钾法常用于测定水样中的化学需氧量(COD).测定方法为:在强酸性溶液中,准确加入过量的重铬酸钾标准溶液加热回流,将水样中还原性物质(主要是有机物)氧化,过量的重铬酸钾以试亚铁灵作指示剂,用Fe(NH4)2(SO4)2标准溶液回滴,根据所消耗的重铬酸钾标准溶液量计算水样化学需氧量.
例3(强基模拟题)化学需氧量(简称COD)表示在强酸性条件下重铬酸钾氧化1L污水中有机物所需的氧化剂的量,并换算成以O2为氧化剂时,1L水样所消耗O2的质量(mg·L-1).现有水样20.00 mL测其COD.用1.176gK2Cr2O7(摩尔质量为294 g·mol-1)固体配制成100mL溶液,取10.00mL,并加入适量酸和催化剂,加入水样后充分反应.多余的K2Cr2O7用0.1000mol·L-1Fe(NH4)2(SO4)2溶液进行滴定,结果如表1所示.
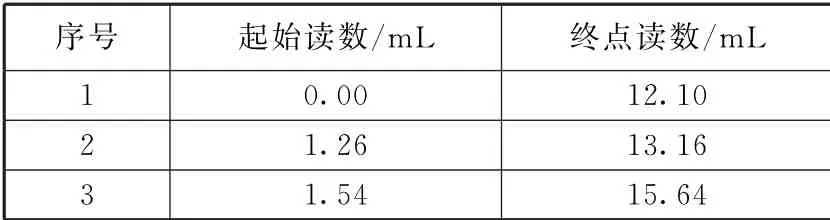
表1
已 知:Cr2O27-+6Fe2++14H+=2Cr3++6Fe3++7H2O,K2Cr2O7和有机物反应时也被还原为Cr3+.则该湖水的COD为_________mg·L-1.
解析
依题意知,3次实验消耗Fe(NH4)2(SO4)2溶液体积分别为:12.10、11.90、13.10 mL,第3组数据误差较大,舍弃,则平均消耗标准液体积为
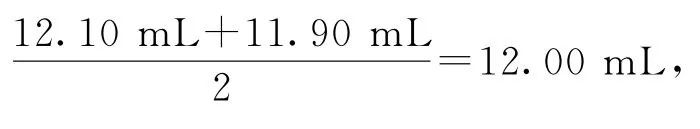
10.00mLK2Cr2O7溶液中n(K2Cr2O7)=0.01L×0.040 00 mol·L-1=4×10-4mol,所 用Fe(NH4)2(SO4)2溶液中n(Fe2+)=12×10-3L×0.1mol·L-1=1.2×10-3mol.
根据已知反应可知剩余的K2Cr2O7的物质的量为所以水样消耗的n(K2Cr2O7)=4×10-4mol-2×10-4mol=2×10-4mol,根据电子转移可知,水样需要氧气的物质的量为
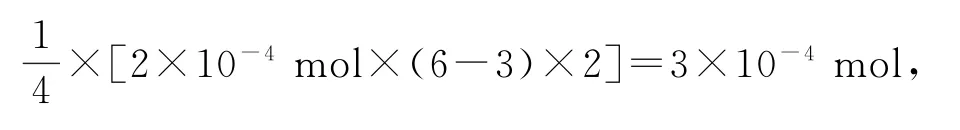
氧 气 的 质 量 为3×10-4mol×32 g·mol-1=96×10-4g=9.6 mg,故该湖水的COD为480mg·L-1.
3 碘量法
碘量法是以I2的氧化性和I-的还原性为基础的一种氧化还原方法,可分为直接碘量法和间接碘量法.
3.1 直接碘量法
直接碘量法又称为碘滴定法.它是利用碘作标准溶液直接滴定一些还原性物质(如Sn2+、As2O3、S2-、)的方法.该种方法滴定应在酸性或中性介质中进行,因为在碱性条件下I2易歧化:

由于I2的氧化性不强,能被其氧化的物质不多,所以直接碘量法应用有限.
3.2 间接碘量法
间接碘量法是利用I-的还原性间接测定氧化物质含量的方法.测定时先将氧化性物质,与过量的KI反应析出I2,然后可用Na2S2O3标准溶液滴定析出的I2,通过Na2S2O3消耗量,计算氧化剂的含量.该法由于是用Na2S2O3标准溶液滴定析出的I2,所以又称滴定碘法.在中性或弱酸性溶液中进行的滴定反应为
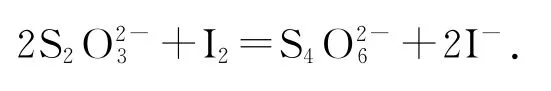
例4(强基模拟题)自来水用ClO2处理后,有少量ClO2残留在水中,可用碘量法做如下检测:①取0.50L水样,加入一定量的碘化钾,用氢氧化钠溶液调至中性,再加入淀粉溶液,溶液变蓝.②向①所得溶液中滴加5.00×10-4mol·L-1的Na2S2O3溶液至恰好反应,消耗Na2S2O3溶液20.00mL.该水样中ClO2的浓度是_________mg·L-1.(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
解析
依据题意及2ClO2+2KI=2KClO2+I2、2Na2S2O3+I2=Na2S4O6+2NaI,得 关 系式:2ClO2~I2~2Na2S2O3.已知实验中消耗5.00×10-4mol·L-1Na2S2O3溶液20.00 mL,n(ClO2)=5.00×10-4mol·L-1×20.00×10-3L=1.000×10-5mol,0.50L水样中ClO2的浓度是

例5 (强基模拟题)某研究性学习小组为测定NaClO2·3H2O样品的纯度,采用“间接碘量法”进行测定(杂质与I-不发生反应),测定过程如下:取样品1.4450g配制成250mL溶液,从中取出25.00mL,加入足量KI固体和适量稀H2SO4,充分反应后再加入0.1mol·L-1Na2S2O3标准溶液,Na2S2O3标准溶液与上述反应生成的I2刚好完全反应时消耗的体积为34.6mL.已知+4I-+4H+=2H2O+2I2+Cl-,I2+=+2I-.则 该 样 品 中NaClO2·3H2O的纯度为________%.
解析
根据题意建立关系式:ClO-2~2I2~4S2O2-3,样品中NaClO2·3H2O的质量为

链接练习
1.某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体试样的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀CuI.用0.1000 mg·L-1Na2S2O3标准溶液滴定,达到滴定终点时,消耗Na2S2O3标准溶液20.00mL.已知:I2+2S2O23-=S4O26-+2I-.该试样中CuCl2·2H2O的质量分数为_________.
2.利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行.已知:2CrO24-+2H+=Cr2O27-+H2O,Ba2++CrO24-=BaCrO4↓.
步骤Ⅰ:移取xmL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用bmol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V0mL.
步骤Ⅱ:移取ymLBaCl2溶液于锥形瓶中,加入xmL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用bmol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL.
则实验所测定BaCl2溶液的浓度为________mol·L-1.
链接练习参考答案
