杜仲提取物多次给药后在正常大鼠和SHR 模型体内的药动学比较研究
2022-02-21青李梦婷李梅鲍红松黄勇郑林李月婷陈颖巩仔鹏
张 青李梦婷李 梅鲍红松黄 勇郑 林李月婷陈颖巩仔鹏*
(1.贵州医科大学贵州省药物制剂重点实验室民族药与中药开发应用教育部工程研究中心药学院, 贵阳 550004;2.中国中医科学院中药研究所,北京 100700)
杜仲为被子门杜仲科(Eucommiaceae)杜仲属(Eucommia)植物杜仲(Eucommia ulmoidesOlive.)的干燥树皮,其在我国已拥有悠久的用药历史。 据报道,杜仲的主要活性成分包括木脂素类、环烯醚萜类、苯丙素类和黄酮类,并且木脂素类中的松脂醇二葡萄糖苷,环烯醚萜类中的京尼平苷酸、京尼平苷和桃叶珊瑚苷,苯丙素类中的绿原酸等成分都具有较好的血管舒张作用[1-2]。 各成分降压机制主要与维持NO 系统的平衡,进而保护内皮细胞功能、拮抗Ca2+通道、抑制肾素-血管紧张素-醛固酮以及作用血管平滑肌等有关[3]。 目前关于杜仲活性成分的药代动力学研究依然很欠缺,本研究基于其降压活性成分经多次给药后在正常和自发性高血压大鼠(spontaneously hypertensive rats, SHRs)模型体内的蓄积情况进行考察,以期为杜仲药材的临床长期合理安全使用提供一定的参考依据。
药物的组织分布常用于评价药物的靶向性和判断药物在体内蓄积的有无以及程度,其主要受到药物性质和机体状况两个因素的影响[4],这些因素将导致药物的组织分布差异,最终影响到药物疗效。 对于需多次长期用药的慢性疾病,药物的蓄积和毒副作用等安全性问题不容小觑,因此药物蓄积的研究显得至关重要。
课题组前期通过调研发现杜仲潜在的降压活性成分主要包括松脂醇二葡萄糖苷(PDG)、松脂醇单葡萄糖苷(PG)、京尼平苷酸(GA)、原儿茶酸(PCA)、绿原酸(CA)、新绿原酸(NCA)、隐绿原酸(CCA)等。 因此本实验选用Wistar 大鼠与SHR 模型,通过多次灌胃给予杜仲提取物后研究上述7 种降压活性成分在生理和自发性高血压病理状态下大鼠体内的药动学行为,通过比较京尼平苷酸等7个代表成分在正常大鼠和SHR 模型体内的药动学和蓄积差异,初步探究自发性高血压对杜仲提取物药动学和蓄积情况的影响,以期为指导杜仲在临床上对于治疗原发性高血压长期合理安全用药的方案设计提供一定的参考依据。
1 材料和方法
1.1 实验动物
SPF 级健康 Wistar 大鼠与 SHR 模型各 6 只,雄性,周龄7~9 周,体重(275±25)g,由北京维通利华实验动物技术有限公司提供[SCXK(京)2016-0006],饲养于贵州医科大学实验动物中心[SYXK(黔)2018-001]。 实验经贵州医科大学实验动物伦理委员会批准(1702077),遵循3R 原则。
饲养条件:购入的大鼠进入动物房后,按每笼6只分装饲养管理,以标准饲料喂养并每天更换新鲜纯净水。 动物房光照充足,通风良好,室温18℃~25℃,相对湿度50%~70%,动物饲养室按常规要求定期消毒。
1.2 主要试剂与仪器
杜仲药材购于贵阳市药材公司,由贵州医科大学药学院药用植物与生药学教研室刘春花副教授鉴定为杜仲科植物杜仲Eucommia ulmoidesOliv.的干燥树皮。 松脂醇二葡萄糖苷(PDG)、京尼平苷酸(GA)、绿原酸(CA)、原儿茶酸(PCA)、葛根素对照品(中国食品药品检定研究院,批号分别为111537-201204、 111828-201403、 110753-201415、 110809-201205、 110752-201514, 纯 度 分 别 ≥ 90.9%、 ≥94.6%、≥96.2%、≥99.9%、≥95.5%);新绿原酸(NCA)、隐绿原酸(CCA)对照品(四川维克奇生物科技有限公司,批号分别为160318、160304,纯度均≥98%);松脂醇单葡萄糖苷(PG)对照品(上海源叶生物科技有限公司,批号P09J7F8760,纯度≥98%);甲醇(天津市科密欧化学试剂有限公司,色谱纯);乙腈(德国Merck 公司,色谱纯);甲酸(北京迪科马科技有限公司,批号为6040672);实验用水为屈臣氏纯净水。
UPLC Xevo TQ-S 型超高效液相三重四级杆质谱联用仪(ACQUITY UPLC I-Class 系统,MassLynx质谱工作站,美国沃特世公司);低温高速离心机(Allegra X-30 R,美国贝克曼公司);大鼠无创血压计(美国);超声波清洗器(KQ-300DE,昆山市超声仪器有限公司);氮气吹干仪装置(MTN-2800D,天津奥特塞恩斯仪器有限公司);多管涡旋振荡器(VX-III,北京踏锦科技有限公司);万分之一电子天平(EL204,上海METTLER TOLEDO 公司),玻璃匀浆器(上海垒固仪器有限公司)。
1.3 方法
1.3.1 大鼠血压的测定
实验前对所购买的SHR 模型进行血压测定,选取合格的大鼠进行本部分的实验(大鼠的3 次收缩压值的平均值≥150 mmHg 为合格标准)。 测压方法:测压前将随机选取的SHR 模型置于37℃预热箱中10 min,之后用MRBP 无创血压计测定大鼠尾动脉收缩压(SBP),记录大鼠安静状态下较稳定的3次结果,取其平均值,即得。
1.3.2 多次给药的药代动力学和蓄积实验研究
健康Wistar 大鼠和合格SHR 模型各6 只,每天灌胃给予杜仲提取物溶液1 次,给药剂量为5.4 g/kg,连续灌胃7 d,第6 天晚上分别进行颈静脉插管手术,待大鼠恢复12 h 以上后,对其灌胃给予最后1 次杜仲提取物溶液,给药剂量为5.4 g/kg,于给药前和给药后 5 min、15 min、30 min、45 min、1 h、1.5 h、2 h、4 h、6 h、8 h、10 h、12 h、和24 h 从颈静脉插管处采血约250 μL 放入肝素化的EP 管中,同时补充250 μL 肝素溶液(1 mg/mL)。 将获得的全血离心(4500 r/min,5 min),取血浆 100 μL 于-80℃冰箱中保存以备分析。 于末次采血后迅速取出心、肝、脾、肺、肾、脑、胃、小肠、肌肉及睾丸组织,置于冰生理盐水中清洗干净,并用滤纸将其沾干。 对各组织进行称重、装袋后置于冰箱(-80℃)保存备用。 采用UPLC-MS/MS 方法测定7 个代表成分在大鼠主要脏器中的含量以及在血浆中的药动学参数,并就此分析模型组和正常组之间的差异。 组织和血浆的前处理以及测定方法详见课题组前期发表论文[5-6]。
1.4 统计学方法
采用WinNonLin 6.4(Phoenix,美国Pharsight 公司)数据处理软件中的非房室模型(NCA)分析方法拟合各药动学参数,AUC、MRT 等参数选用统计矩方法进行计算。 采用SPSS 17.0 统计软件进行数据分析,实验结果用平均数±标准差(ˉx±s)表示,用独立样本t检验进行组间比较,P<0.05 认为差异有统计学意义。
2 结果
2.1 多次给药的药代动力学实验结果
正常大鼠和SHR 模型多次灌胃给予杜仲提取物后各时间点血药浓度,平均血药浓度-时间曲线见图1。 采用 WinNonLin 6.4 软件计算药动学参数,并对药物在大鼠体内的动力学过程进行非房室模型拟合,相关药动学参数见表1 ~表4。 对杜仲提取物中GA 等7 种成分在SHR 模型和正常大鼠血浆中的药动学参数包括生物半衰期(T1/2)、血药浓度达峰时间(Tmax)、达峰浓度(Cmax)、药时曲线下面积(AUC)、表观分布容积(Vd/F)、清除率(CL/F)以及平均滞留时间(MRT)进行考察。 结果表明,GA 在 SHR 模型组中的 T1/2、Vd/F、CL/F、MRT0-∞明 显 高 于 正 常 组,而 Tmax、AUC0-t以 及AUC0-∞显著低于正常组;PCA 在 SHR 模型组中的T1/2和Vd/F 相较于正常组显著增高;与正常组相比,CA 的 T1/2、Vd/F 和 MRT0-∞在 SHR 模型组中表现更高,而AUC0-t则明显降低;在SHR 模型组中,PDG 的 T1/2、Vd/F 和 MRT0-∞显著低于正常组;PG在SHR 模型组中的T1/2明显低于正常组;CCA 和NCA 在两组中的各药动学参数无明显差异。 在0~24 h 内,自发性高血压病理状态降低了GA 的入血浓度,其余 6 种成分中 CA、PCA、PDG、PG 在SHR 模型中的C-t 曲线变化趋势与正常组相比基本一致,而NCA 和CCA 在两组之间的C-t 曲线则有所差异。 GA 在SHR 组内整体的药动学参数与正常组相比差异最为明显。
表1 多次灌胃给药后PDG 和GA 在正常及模型大鼠体内的PK 参数(,n=6)Table 1 Pharmacokinetic parameters of PDG and GA in normal and SHR model after multiple intragastrically administered Eucommia ulmoides extract
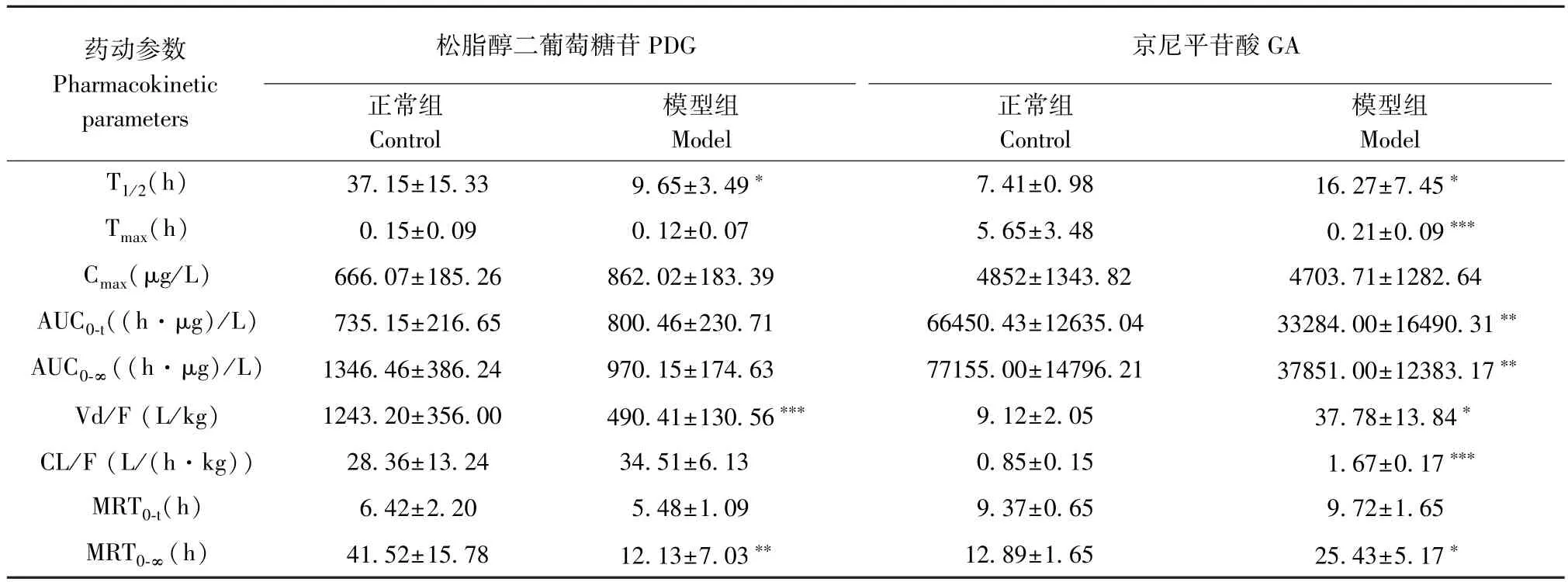
表1 多次灌胃给药后PDG 和GA 在正常及模型大鼠体内的PK 参数(,n=6)Table 1 Pharmacokinetic parameters of PDG and GA in normal and SHR model after multiple intragastrically administered Eucommia ulmoides extract
注:与正常组相比,*P<0.05,**P<0.01,***P<0.001。Note. Compared with the control group,*P<0.05,**P<0.01,***P<0.001.
药动参数Pharmacokinetic parameters京尼平苷酸GA正常组Control松脂醇二葡萄糖苷PDG模型组Model正常组Control模型组Model T1/2(h) 37.15±15.33 9.65±3.49* 7.41±0.98 16.27±7.45*Tmax(h) 0.15±0.09 0.12±0.07 5.65±3.48 0.21±0.09***Cmax(μg/L) 666.07±185.26 862.02±183.39 4852±1343.82 4703.71±1282.64 AUC0-t((h·μg)/L) 735.15±216.65 800.46±230.71 66450.43±12635.04 33284.00±16490.31**AUC0-∞((h·μg)/L) 1346.46±386.24 970.15±174.63 77155.00±14796.21 37851.00±12383.17**Vd/F (L/kg) 1243.20±356.00 490.41±130.56*** 9.12±2.05 37.78±13.84*CL/F (L/(h·kg)) 28.36±13.24 34.51±6.13 0.85±0.15 1.67±0.17***MRT0-t(h) 6.42±2.20 5.48±1.09 9.37±0.65 9.72±1.65 MRT0-∞(h) 41.52±15.78 12.13±7.03** 12.89±1.65 25.43±5.17*
表2 多次灌胃给药后PG 和PCA 在正常及模型大鼠体内的PK 参数(,n=6)Table 2 Pharmacokinetic parameters of PG and PCA in normal and SHR model after multiple intragastrically administered Eucommia ulmoides extract
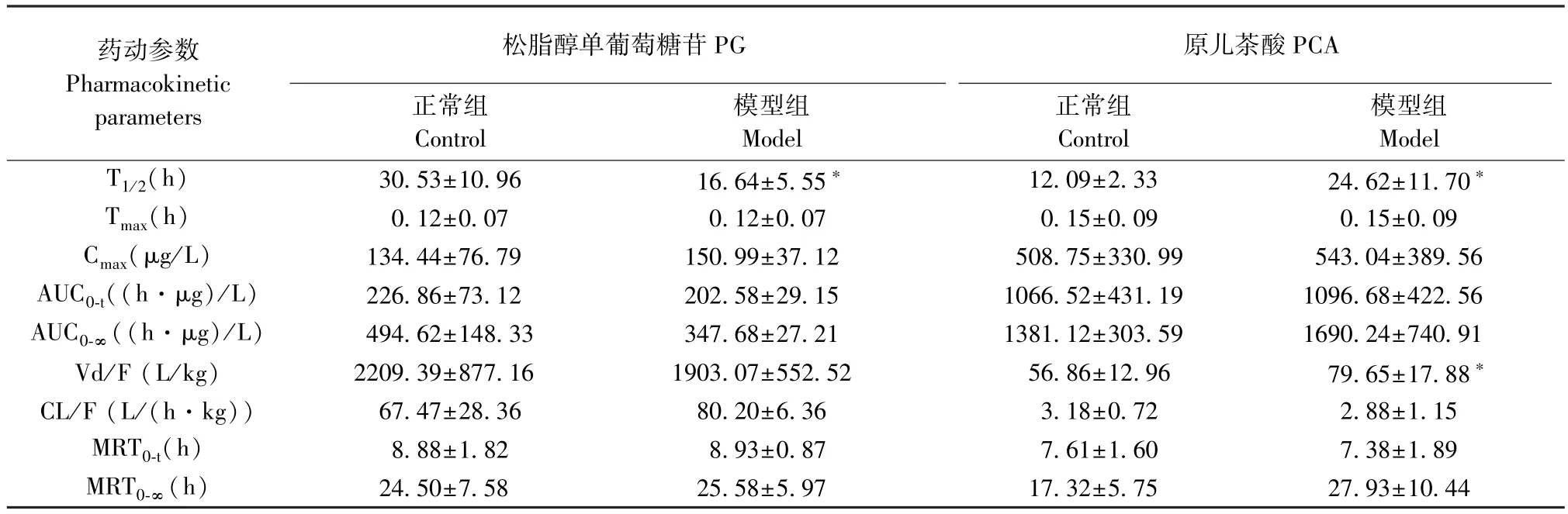
表2 多次灌胃给药后PG 和PCA 在正常及模型大鼠体内的PK 参数(,n=6)Table 2 Pharmacokinetic parameters of PG and PCA in normal and SHR model after multiple intragastrically administered Eucommia ulmoides extract
注:与正常组相比,*P<0.05。Note. Compared with the control group,*P<0.05.
药动参数Pharmacokinetic parameters原儿茶酸PCA正常组Control松脂醇单葡萄糖苷PG模型组Model正常组Control模型组Model T1/2(h) 30.53±10.96 16.64±5.55* 12.09±2.33 24.62±11.70*Tmax(h) 0.12±0.07 0.12±0.07 0.15±0.09 0.15±0.09 Cmax(μg/L) 134.44±76.79 150.99±37.12 508.75±330.99 543.04±389.56 AUC0-t((h·μg)/L) 226.86±73.12 202.58±29.15 1066.52±431.19 1096.68±422.56 AUC0-∞((h·μg)/L) 494.62±148.33 347.68±27.21 1381.12±303.59 1690.24±740.91 Vd/F (L/kg) 2209.39±877.16 1903.07±552.52 56.86±12.96 79.65±17.88*CL/F (L/(h·kg)) 67.47±28.36 80.20±6.36 3.18±0.72 2.88±1.15 MRT0-t(h) 8.88±1.82 8.93±0.87 7.61±1.60 7.38±1.89 MRT0-∞(h) 24.50±7.58 25.58±5.97 17.32±5.75 27.93±10.44
表3 多次灌胃给药后CA 和CCA 在正常及模型大鼠体内的PK 参数(,n=6)Table 3 Pharmacokinetic parameters of CA and CCA in normal and SHR model after multiple intragastrically administered Eucommia ulmoides extract

表3 多次灌胃给药后CA 和CCA 在正常及模型大鼠体内的PK 参数(,n=6)Table 3 Pharmacokinetic parameters of CA and CCA in normal and SHR model after multiple intragastrically administered Eucommia ulmoides extract
注:与正常组相比,*P<0.05。Note. Compared with the control group,*P<0.05.
药动参数Pharmacokinetic parameters隐绿原酸CCA正常组Control绿原酸CA模型组Model正常组Control模型组Model T1/2(h) 12.33±3.23 23.80±16.42* 55.78±18.71 36.42±15.18 Tmax(h) 0.17±0.09 0.12±0.08 0.17±0.09 0.12±0.07 Cmax (μg/L) 850.88±291.03 638.01±125.39 239.05±104.91 244.82±96.69 AUC0-t((h·μg)/L) 1206.93±381.46 772.37±90.93* 512.45±118.75 480.14±98.37 AUC0-∞((h·μg)/L) 1742.18±373.00 1634.97±464.82 1694.51±515.95 1295.87±375.05 Vd/F (L/kg) 62.54±23.61 112.84±24.57* 201.81±84.95 157.50±80.29 CL/F (L/(h·kg)) 3.42±0.51 3.81±1.03 3.04±1.32 4.40±1.93 MRT0-t(h) 7.84±2.05 7.64±0.34 9.28±1.36 9.73±1.76 MRT0-∞(h) 18.82±7.25 34.15±10.53* 78.29±21.39 54.35±15.03
表4 多次灌胃给药后NCA 在正常及模型大鼠体内的PK 参数(,n=6)Table 4 Pharmacokinetic parameters of NCA in normal and SHR model after multiple intragastrically administered Eucommia ulmoides extract

表4 多次灌胃给药后NCA 在正常及模型大鼠体内的PK 参数(,n=6)Table 4 Pharmacokinetic parameters of NCA in normal and SHR model after multiple intragastrically administered Eucommia ulmoides extract
药动参数Pharmacokinetic parameters新绿原酸NCA正常组Control模型组Model T1/2(h) 50.47±18.16 38.40±10.96 Tmax(h) 0.12±0.08 0.12±0.07 Cmax(μg/L) 155.71±40.10 119.52±54.30 AUC0-t((h·μ g)/L) 483.00±31.38 448.82±42.28 AUC0-∞((h·μg)/L) 1645.22±377.43 1377.90±622.31 Vd/F (L/kg) 99.13±16.07 86.01±20.80 CL/F (L/(h·kg)) 1.47±0.43 1.89±0.66 MRT0-t(h) 10.12±0.85 10.68±0.96 MRT0-∞(h) 71.78±24.35 57.74±15.65
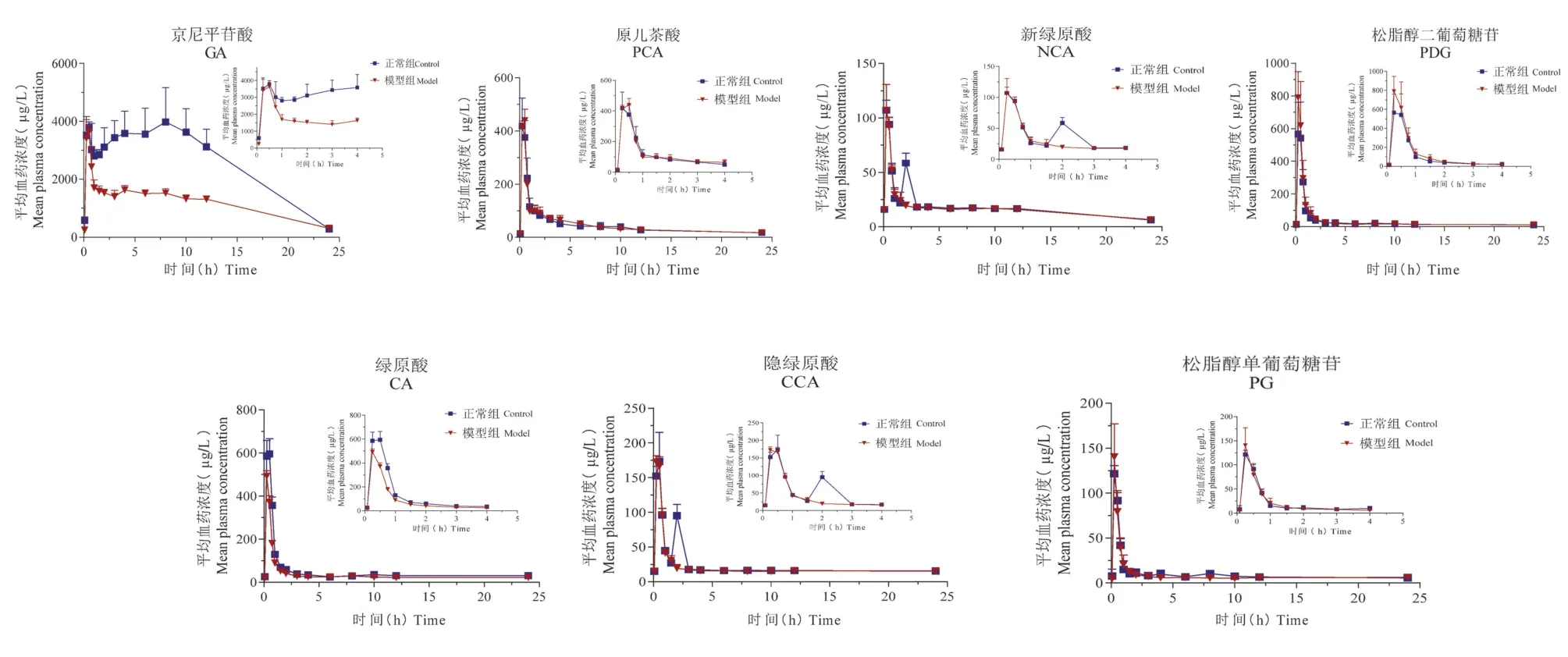
图1 大鼠多次灌胃给予杜仲提取物后GA、PG、CA、PCA、PDG、NCA、CCA 的C-t 药时曲线(,n=6)Figure 1 Concentration-time profiles of GA,PG,CA,PCA,PDG,NCA,CCA in normal and SHR model after multiple intragastrically administered Eucommia ulmoides extract
2.2 杜仲提取物多次给药后其7 个活性成分在正常大鼠和SHR 模型体内的蓄积实验结果
大鼠灌胃给予杜仲提取物溶液24 h 后,GA 等7种被测成分在正常大鼠和SHR 体内各组织中的含量见表5~表7。
表5 多次给予杜仲提取物后CA、NCA、CCA 在正常大鼠和SHR 模型体内各组织的含量(,n=6)Table 5 Content of CA, NCA, CCA in rat different tissues homogenate of normal and SHR model at 24 h after multiple intragastrically administered Eucommia ulmoides extract

表5 多次给予杜仲提取物后CA、NCA、CCA 在正常大鼠和SHR 模型体内各组织的含量(,n=6)Table 5 Content of CA, NCA, CCA in rat different tissues homogenate of normal and SHR model at 24 h after multiple intragastrically administered Eucommia ulmoides extract
注:与正常组相比,*P<0.05,**P<0.01。Note. Compared with the control group,*P<0.05,**P<0.01.
组织Tissue新绿原酸NCA 绿原酸CA 隐绿原酸CCA正常Control SHR 模型Model正常Control SHR 模型Model正常Control SHR 模型Model心 Heart 10.24±2.20 8.94±2.10 4.20±1.85 3.78±0.57 39.90±10.88 43.43±12.23肝 Liver 8.29±2.48 7.87±1.98 3.28±0.64 3.38±0.90 42.56±13.54 29.41±1.92脾 Spleen 2.07±0.46 1.83±0.42 1.51±0.17 1.48±0.10 1.96±0.52 1.29±0.39肺 Lung 2.76±0.88 3.47±0.94 3.65±0.19 4.08±0.75 4.79±0.27 4.90±0.40肾 Kidney 1.86±0.47 2.81±0.43* 1.18±0.36 0.79±0.10* 1.71±0.54 1.82±0.41胃 Stomach 8.04±1.67 9.52±2.52 12.78±0.83 12.98±1.43 5.12±1.16 5.05±0.28脑 Brain 2.18±0.66 0.92±0.20* 0.93±0.27 0.63±0.20 1.35±0.27 1.55±0.34肠 Intestine 5.74±0.96 10.14±3.30 3.04±0.88 5.83±1.07** 8.57±2.73 7.67±0.99肌肉 Muscle 1.49±0.44 1.13±0.23 1.04±0.13 0.97±0.08 0.83±0.10 1.00±0.12睾丸 Testis 1.44±0.30 1.30±0.20 1.03±0.07 0.91±0.06* 0.92±0.14 1.09±0.24
表6 多次给予杜仲提取物后PCA、GA 在正常大鼠和SHR 模型体内各组织中的含量(,n=6)Table 6 Content of PCA, GA in rat different tissues homogenate of normal and SHR model at 24 h after multiple intragastrically administered Eucommia ulmoides extract
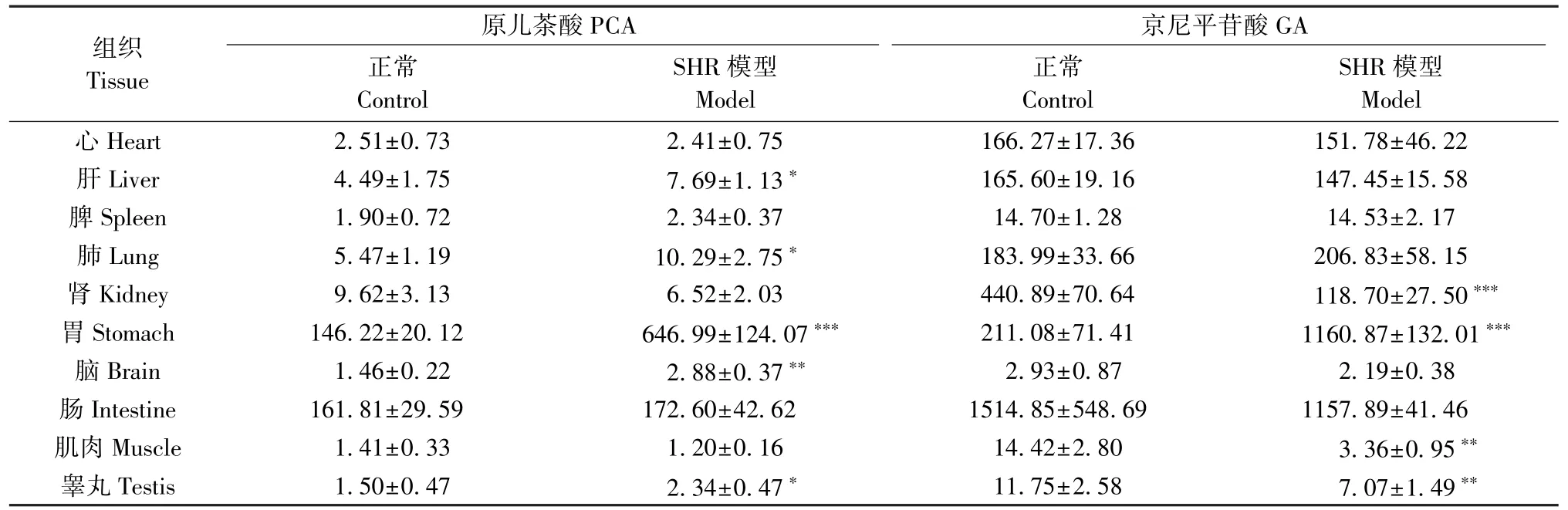
表6 多次给予杜仲提取物后PCA、GA 在正常大鼠和SHR 模型体内各组织中的含量(,n=6)Table 6 Content of PCA, GA in rat different tissues homogenate of normal and SHR model at 24 h after multiple intragastrically administered Eucommia ulmoides extract
注:与正常组相比,*P<0.05,**P<0.01,***P<0.001。Note. Compared with the control group,*P<0.05,**P<0.01,***P<0.001.
组织Tissue京尼平苷酸GA正常Control原儿茶酸PCA SHR 模型Model正常Control SHR 模型Model心 Heart 2.51±0.73 2.41±0.75 166.27±17.36 151.78±46.22肝 Liver 4.49±1.75 7.69±1.13* 165.60±19.16 147.45±15.58脾 Spleen 1.90±0.72 2.34±0.37 14.70±1.28 14.53±2.17肺 Lung 5.47±1.19 10.29±2.75* 183.99±33.66 206.83±58.15肾 Kidney 9.62±3.13 6.52±2.03 440.89±70.64 118.70±27.50***胃 Stomach 146.22±20.12 646.99±124.07*** 211.08±71.41 1160.87±132.01***脑 Brain 1.46±0.22 2.88±0.37** 2.93±0.87 2.19±0.38肠 Intestine 161.81±29.59 172.60±42.62 1514.85±548.69 1157.89±41.46肌肉 Muscle 1.41±0.33 1.20±0.16 14.42±2.80 3.36±0.95**睾丸 Testis 1.50±0.47 2.34±0.47* 11.75±2.58 7.07±1.49**
表7 多次给予杜仲提取物后PG、PDG 在正常大鼠和SHR 模型体内各组织中的含量(,n=6)Table 7 Content of PG,PDG in rat different tissues homogenate of normal and SHR model at 24 h after multiple intragastrically administered Eucommia ulmoides extract

表7 多次给予杜仲提取物后PG、PDG 在正常大鼠和SHR 模型体内各组织中的含量(,n=6)Table 7 Content of PG,PDG in rat different tissues homogenate of normal and SHR model at 24 h after multiple intragastrically administered Eucommia ulmoides extract
注:ND:未检测到。 与正常组相比,*P<0.05,**P<0.01,***P<0.001。Note. ND,Not detected. Compared with the control group,*P<0.05,**P<0.01,***P<0.001.
组织Tissue松脂醇单葡萄糖苷PG 松脂醇二葡萄糖苷PDG正常Control SHR 模型Model正常Control SHR 模型Model心 Heart 2.39±0.61 5.46±1.65** 104.92±10.54 114.57±31.93肝 Liver ND ND 116.46±7.39 111.61±4.23脾 Spleen 1.42±0.33 2.86±0.74** 6.06±2.48 9.81±2.97肺 Lung 13.32±3.13 38.17±8.83* 90.60±7.85 98.05±14.39肾 Kidney 0.16±0.02 0.17±0.04 ND ND胃 Stomach 228.00±72.67 1459.74±218.79*** 238.37±70.94 3023.48±702.49**脑 Brain ND ND 3.16±0.97 3.83±0.66肠 Intestine 103.15±23.23 51.37±3.90** 1430.19±499.56 138.50±17.19**肌肉 Muscle 2.41±0.45 4.31±0.59** 4.79±0.76 3.11±0.95睾丸 Testis 1.82±0.57 1.04±0.24* 1.58±0.41 1.91±0.38
7 种活性成分在正常大鼠体内各组织器官中的含量排列顺序为(1)PCA:肠>胃>肾>肺>肝>心>脾>睾丸>脑>肌肉。 (2)GA:肠>肾>胃>肺>心>肝>脾>肌肉>睾丸>脑。(3)PG:胃>肠>肺>肌肉>心>睾丸>脾>肾。 (4)PDG:肠>胃>肝>心>肺>脾>肌肉>脑>睾丸。 (5)CA:心>肝>胃>肠>肺>脑>脾>肾>肌肉>睾丸。 (6)NCA:胃>心>肺>肝>肠>脾>肾>肌肉>睾丸>脑。 (7)CCA:肝>心>肠>胃>肺>脾>脑>肾>睾>肌肉。
7 种活性成分在SHR 模型体内各组织器官中的含量排列顺序为(1)PCA:胃>肠>肺>肝>肾>脑>心>脾>睾>肌肉。 (2)GA:胃>肠>肺>心>肝>肾>脾>睾>肌肉>脑。 (3)PG:胃>肠>肺>心>肌肉>脾>睾丸>肾。 (4)PDG:胃>肠>心>肝>肺>脾>脑>肌肉>睾丸。 (5)CA:肠>胃>心>肝>肺>肾>脾>睾丸>肌肉>脑。 (6)NCA:胃>肠>肺>心>肝>脾>肌肉>睾丸>肾>脑。 (7)CCA:心>肝>肠>胃>肺>肾>脑>脾>睾>肌肉。
3 讨论
药物一般作用于疾病患者,而机体的疾病状态对药物的药代动力学有着不同程度的影响,这对于临床用药是否安全有效而言至关重要[7]。 对于口服给药,药物首先从给药部位吸收进入血液循环,随血流分布到全身各个组织器官、体液和细胞,这种药物在血液和组织之间的转运现象称为分布[8]。了解药物的体内分布特征对于保证安全用药和新药开发意义重大。 而通过研究病理生理状态下不同成分在不同组织器官之间的蓄积差异情况可以作为合理安全用药的参考。
在药动学实验研究中,杜仲提取物中的NCA 和CCA 两种成分的药动学参数未见明显的组间差异。PDG 在 SHR 模型组中的 T1/2、MRT0-∞、Vd/F 分别较正常组显著降低;除了 Cmax、MRT0-t外,GA 在 SHR 模型组中的 T1/2、Vd/F、CL/F、MRT0-∞与正常组相比明显上升,而其 Tmax、AUC0-t、AUC0-∞则表现相反;PG在SHR 模型组中T1/2与正常组相比下降显著;相比正常组,PCA 在SHR 模型组中的 T1/2和 Vd/F 增加明显;与 AUC0-t相反,CA 的 T1/2、Vd/F、MRT0-∞在SHR 模型组中相比正常组显著升高(均P<0.05)。以上结果提示病理状态下的机体会影响杜仲中PDG、GA、PG、PCA 和 CA 在体内消除的快慢以及吸收的速度和程度。
在组织蓄积实验中,结果显示,杜仲提取物中的7 种活性成分主要分布在胃、肠、心、肝、肺。 相较于其它4 种成分,CA、NCA、CCA 在各个器官中的含量整体很低,推测3 种成分消除较快,无累积现象。CCA 的组织含量在SHR 模型组中与正常组相比无明显差异。 PCA 在 SHR 体内肝、肺、胃、脑、睾丸中的含量均高于正常组,提示自发性高血压病理状态会增加其体内蓄积;GA 在SHR 模型体内肾、肌肉、睾丸中的含量均小于正常组,而在胃中的含量显著高于正常组,同时其在正常组中24 h 肾中的含量仍然很高,推测GA 在肾中可能发生累积,而SHR 并无此特征;PG 在SHR 模型体内的心、脾、肺、胃和肌肉中含量均大于正常组,而在肠和睾丸内含量小于正常组;与肠内含量相反,PDG 在SHR 模型体内胃中含量明显大于正常组;在两个组的肾和脑组织中,CA 的含量存在差异;NCA 在SHR 模型体内肾、肠、睾丸含量与正常组相比存在差异。 PCA、GA、PG、PDG 在SHR 模型体内胃中的含量明显大于正常组,说明疾病状态对这几种成分在胃中的分布有影响。 本实验的研究结果表明杜仲提取物中的原儿茶酸、京尼平苷酸、松脂醇二葡萄糖苷、新绿原酸和绿原酸5 种降压活性成分在大鼠体内的药动学和蓄积情况会受到自发性高血压病理状态的影响,这将为指导杜仲临床长期合理用药提供一定的参考依据。
