金钗石斛对MPTP 诱导PD 小鼠的神经保护作用及机制研究
2022-02-21王孟迪魏山山姜宁AlbertoCarlosPiresDias刘新民
王孟迪魏山山姜 宁Alberto Carlos Pires Dias刘新民*王 琼*
(1.西南医科大学附属中医医院中葡中医药国际合作中心药学院,四川泸州 646000;2.中国农业科学院农产品加工研究所,北京 100193;3.中国医学科学院北京协和医学院药用植物研究所药理毒理研究中心,北京 100193;4.葡萄牙米尼奥大学分子和环境生物学中心生物系中葡食药资源研究中心,葡萄牙布拉加, 4710-057)
帕金森病(Parkinson’s diseases, PD),又称震颤麻痹(paralysis agitans),是一种常见的神经退行性疾病,其典型的临床表现包括静止性震颤、运动迟缓、姿势失衡和步态障碍等[1]。 黒质多巴胺能神经元的变性坏死以及α-突触核蛋白(α-Synuclein,α-Syn)为主要成分的路易小体(lewy’s body,LB)的形成是PD 的特征性病理表现[2]。 目前关于PD 发病的具体分子机制尚不清楚,已有的研究认为PD与氧化应激、炎症反应以及细胞凋亡密切相关[3-5]。至今,PD 的临床治疗仍然以药物为主,主要包括左旋多巴、单胺氧化酶B(monoamine oxidase-B,MAOB)抑制剂、NMDA 受体阻滞剂和抗胆碱能药物等[6]。 这类药物可有效缓解PD 症状,但长期治疗仍会引起诸多副作用,如姿势不稳、自主神经功能紊乱等,严重危害身体健康[7]。 因此迫切需要研发安全、有效、副作用小的防治PD 药物。
中医药在防治 PD 方面有着丰富的临床经验[8],且中药具有多环节、多靶点的药理特点,可为PD 治疗提供新思路。 PD 在中医学理论中,症见头摇、手足动摇为主者可属“颤证”范畴[9]。 金钗石斛(Dendrobium nobileLindl,DNL)又名金钗石、扁金钗、扁黄草等,味甘、微咸、无毒,主要以新鲜或干燥茎入药,主产于贵州、云南等地[10]。 2010 年版《中国药典》中已明确将金钗石斛作为药用石斛的首要来源[11]。 现代药理研究分析,金钗石斛的主要化学成分为生物碱、多糖、氨基酸、酚类、挥发油等,尤其是生物碱和多糖在抗肿瘤、降血糖以及对神经系统疾病等方面都具有显著的改善作用[12]。 金钗石斛提取物能有效改善小鼠抑郁模型的行为学表现,显著提高小鼠脑内的DA 和5-HT[13],金钗石斛生物总碱可以改善脂多糖诱导大鼠海马tau 蛋白的高度磷酸化和炎症反应,减轻海马周围神经细胞的凋亡[14];此外,段灿灿等[15]通网络药理分析途径,筛选到金钗石斛活性成分47 个,作用靶点88 个,富集帕金森、阿尔茨海默症及精神、记忆障碍等神经系统疾病,从系统层面揭示了金钗石斛治疗神经系统疾病的药效物质基础及分子机制。 因此,金钗石斛在防治帕金森病中具有很大的潜力。
在本研究中,我们采用1-甲基-4 苯基-1,2,3,6-四氨吡啶(MPTP) 制备经典的亚急性 PD 小鼠模型,探究金钗石斛提取物对 PD 小鼠的作用及其机制。
1 材料和方法
1.1 实验动物
66 只 8 ~ 10 周龄,体重 18 ~ 20 g,SPF 级C57BL/6J 雄性小鼠购自北京维通利华实验动物技术有限公司[SCXK(京)2021-0006]。 实验期间喂养于中国医学科学院药用植物研究所SPF 级实验动物房[SYXK(京)2017-0020],自由供给标准饲料和纯净水,保持 12 h 光照(9:00 ~21:00)和 12 h 黑暗(21:00~次日9:00)交替循环,室温20℃~23℃,湿度(55±10)%。 动物适应环境5 d 后开始实验。实验过程严格遵守3R 原则,并遵循本所实验动物伦理委员会相关规定(SLXD-2021052119)。
1.2 主要试剂与仪器
金钗石斛生药购自四川泸州合江凤鸣,由中国医学科学院药用植物研究所张本刚研究员鉴定为金钗石斛。
MPTP 购自美国 Sigma 公司(规格:100 mg);美多芭购自上海罗氏制药有限公司(规格:0.25 g,产品批号:SH5146);小鼠肿瘤坏死因子(TNF)-α、白细胞介素(IL)-6 和 IL-1β 酶联免疫吸附测定(ELISA)试剂盒均购自上海酶联生物公司;caspase-3、 caspase-9 和 β-Actin 抗 体 均 购 自 CST 公 司(caspase-3 产品编号:9664,caspase-9 产品编号:9509,β-Actin 产品编号:4967);HRP 羊抗兔 IgG、HRP 羊抗鼠IgG 等二抗购自Jackson 公司。
步态计算机图像实时检测分析处理系统(中国医学科学院药用植物研究所、中国航天员科研训练中心、北京鑫海仪技术公司联合研制);小鼠自主活动实时检测分析系统(中国医学科学院药用植物研究所、中国航天员中心、北京康森益友科技有限公司共同研制作);AL104 电子天平(上海梅特勒-托利多仪器有限公司);高速匀浆机(上海净信);台式高速冷冻离心机(湘立离心机);全自动酶标仪(美国,BIOTEK 有限公司);自制小鼠爬杆等。
1.3 方法
1.3.1 金钗石斛提取物的制备
称取金钗石斛茎干粉与80%酸性乙醇按1 ∶10的料液比混合浸泡1 夜,85℃条件下回流提取3 次后合并提取液,浓缩得到浸膏,干燥、粉碎后的褐色粉末即为金钗石斛提取物。
1.3.2 帕金森小鼠模型的建立及分组
适应期结束后,将小鼠随机分为6 组:对照组、模型组、美多芭组(112.5 mg/kg)、DNL 低剂量(100 mg/kg)组、DNL 中剂量(200 mg/kg)组和 DNL 高剂量(300 mg/kg)组,各组小鼠分笼群养,每笼4 只,每组10~12 只。 除对照组以外,各组小鼠每天在固定时间进行腹腔注射(i.p)MPTP 30 mg/kg,每天1 次,连续7 d,建立亚急性PD 模型。 对照组小鼠i.p 给予相同体积生理盐水。 美多芭组与DNL(100、200、300 mg/kg)组造模前14 d 进行灌胃(i.g)预给药,造模期间持续每天灌胃给药直到取材结束,对照组和模型组灌胃予以相同体积纯水。 造模完成后次日进行行为学检测,实验流程见图1。

图1 实验流程Figure 1 Experimental procedure
1.3.3 步态分析实验(gait analysis,GA)
步态分析实验主要用于动物运动能力及运动协调性的评价[16]。 开始实验前5 d,每天对小鼠进行不少于3 次训练,以确保动物可从检测通道的一端不间断地跑到另一端。 正式检测前调试软件参数,保证小鼠足印在采集图像窗口中清晰可见。 检测时,将小鼠的足部沾水,使小鼠连续通过跑台,此时高频摄像机记录下步态录像。 录制完成的视频通过计算机分析软件进行分析,并统计步态指标。每只小鼠重复测量3 次,取平均值进行分析。
1.3.4 爬杆实验
爬杆实验主要用于模型动物运动能力评价[17]。自制一根长69 cm,直径为1 cm 的铁杆作为小鼠实验爬杆,将直径25 cm 的软木质小球固定在爬杆顶部,爬杆上缠上医用胶带以防打滑。 检测时,将每只小鼠头朝上放置在球顶使其自动爬下,以小鼠双前肢接触爬杆底部平台为爬完全长,记录以下时间:小鼠头向上至头向下的时间(调头时间),小鼠爬完杆子上半部分所需时间,小鼠爬完杆子下半部分所需时间,爬完全杆所需的总时间。 每只小鼠重复测量3 次,取平均值进行分析。
1.3.5 悬挂实验
悬挂实验参照Kuribara 等[18]的操作方法,准备一根离地面约36 cm 的电线,将小鼠前肢悬挂于水平电线上,评分方法如下:小鼠四爪抓住电线则记3分,用一后爪抓住电线记2 分,如果小鼠两后爪均抓不住电线则记1 分,无法抓住而掉落记0 分。
1.3.6 空场实验(the open-feild test, OFT)
空场实验用于检测小鼠的自主活动情况[19]。先将小鼠背对测试箱壁轻轻放入测试箱(30 cm×30 cm×35 cm),适应3 min 后开始检测,计算机自动监测记录小鼠10 min 内在测试箱中的自发活动情况,如总路程、运动时间、运动速度等指标。
1.3.7 小鼠脑组织分离
末次行为学实验结束后,小鼠处死后迅速断头,于冰上取脑,分离纹状体、皮层脑组织,-80℃条件下保存。
1.3.8 ELISA 法检测纹状体、皮层部位炎症因子TNF-α、IL-1β、IL-6 的含量
将脑组织进行冰上匀浆裂解,12000 r/min 离心30 min,收集上清。 ELISA 操作按试剂盒说明书进行。
1.3.9 Western blot 法检测纹状体中 caspase-3 和caspase-9 蛋白的表达
将各组脑组织加入蛋白裂解液匀浆,4℃条件下12000 r/min 离心 15 min 后,取上清液,按 BCA 蛋白浓度测定试剂盒测定蛋白浓度,分装,-80℃冻存待用。 按每孔30 μg 蛋白上样量配制样品,加入SDSPAGE 上样缓冲液配置最终样品。 凝胶蛋白电泳条件:浓缩胶恒压90 V,约20 min;分离胶恒压120 V。转膜条件:300 mA 恒流;0.45 μm 孔径 PVDF 膜,转膜时间60 min。 室温封闭1 h 后用抗体稀释液稀释caspase-3 和 caspase-9 一抗(1 ∶1000),4℃水平摇床孵育过夜。 用抗体稀释液稀释山羊抗兔IgG(H+L)HRP(1 ∶0 ∶10),室温孵育 1 h。 用 ECL 化学发光液进行检测观察,使用IPP 6.0 图像分析软件进行分析。
1.4 统计学方法
采用SPSS 21. 0 对实验数据进行统计分析,数据以平均数±标准差(ˉx±s)表示,图形以GraphPad Prism 6.02 软件制作。 组间差异的显著性采用单因素方差分析(one-way ANOVA),P<0.05 认为差异具有统计学意义。
2 结果
2.1 金钗石斛对PD 小鼠步态功能的影响
结果如表1 所示,在步宽指标中,各组之间的前肢步宽和后肢步宽没有显著性差异(P>0.05)。 在推进指数和支撑时相指标中,模型组与对照组相比,左后推进指数、右前推进指数,右后推进指数、左后支撑时相、右前支撑时相、右后支撑时相等步态指标均有显著差异(P<0.01,P<0.001),而左前推进指数和左前支撑时相均没有显著性差异(P>0.05)。 与模型组比较,美多芭组、DNL(100、200、300 mg/kg)剂量组在左后推进指数均有明显恢复(P<0.001),DNL(100、200、300 mg/kg)剂量组在右前推进指数(P<0.05,P<0.01)和右后推进指数均有明显恢复(P<0.01)。 与模型组相比,美多芭组、DNL(200、300 mg/kg)剂量组在左后支撑时相和右前支撑时相中有明显减少(P<0.05,P<0.01)。 与模型组相比,美多芭组在右后支撑时相中有明显改善(P<0.05,P<0.01),DNL(100、200、300 mg/kg)剂量组与模型组相比有一定程度的改善趋势但无显著性差异(P>0.05)。
表1 DNL 对PD 小鼠步态功能的影响(,n=10~11)Table 1 Effect of DNL on gait function in PD mice
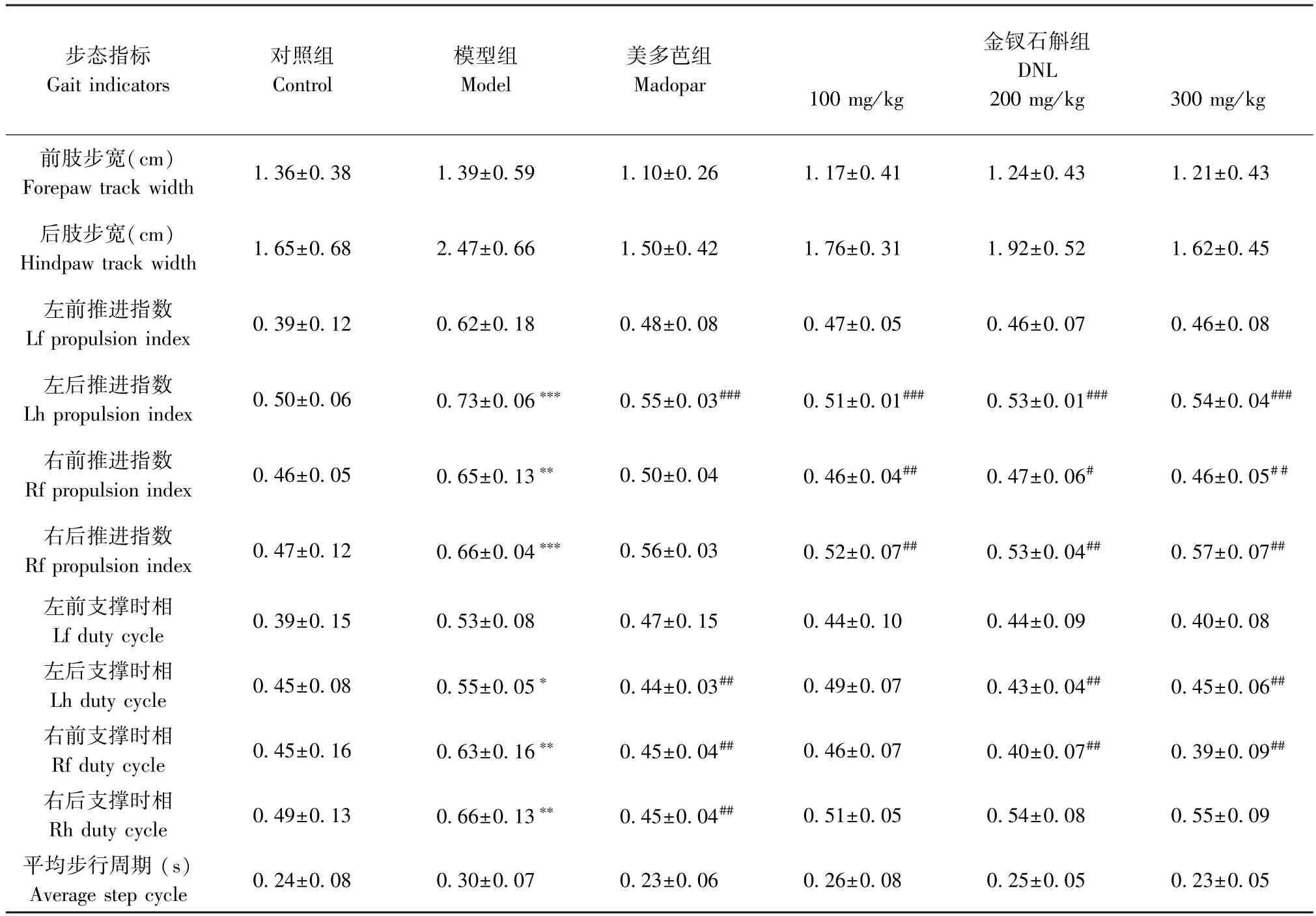
表1 DNL 对PD 小鼠步态功能的影响(,n=10~11)Table 1 Effect of DNL on gait function in PD mice
注:与对照组相比,*P<0.05,**P<0.01,***P<0.001;与模型组相比,#P<0.05,##P<0.01,###P<0.001。Note. Compared with control group,*P<0.05,**P<0.01,***P<0.001. Compared with model group,#P<0.05,##P<0.01,###P<0.001.
步态指标Gait indicators对照组Control模型组Model美多芭组Madopar金钗石斛组DNL 100 mg/kg 200 mg/kg 300 mg/kg前肢步宽(cm)Forepaw track width 1.36±0.38 1.39±0.59 1.10±0.26 1.17±0.41 1.24±0.43 1.21±0.43后肢步宽(cm)Hindpaw track width 1.65±0.68 2.47±0.66 1.50±0.42 1.76±0.31 1.92±0.52 1.62±0.45左前推进指数Lf propulsion index 0.39±0.12 0.62±0.18 0.48±0.08 0.47±0.05 0.46±0.07 0.46±0.08左后推进指数Lh propulsion index 0.50±0.06 0.73±0.06*** 0.55±0.03### 0.51±0.01### 0.53±0.01### 0.54±0.04###右前推进指数Rf propulsion index 0.46±0.05 0.65±0.13** 0.50±0.04 0.46±0.04## 0.47±0.06# 0.46±0.05##右后推进指数Rf propulsion index 0.47±0.12 0.66±0.04*** 0.56±0.03 0.52±0.07## 0.53±0.04## 0.57±0.07##左前支撑时相Lf duty cycle 0.39±0.15 0.53±0.08 0.47±0.15 0.44±0.10 0.44±0.09 0.40±0.08左后支撑时相Lh duty cycle 0.45±0.08 0.55±0.05* 0.44±0.03## 0.49±0.07 0.43±0.04## 0.45±0.06##右前支撑时相Rf duty cycle 0.45±0.16 0.63±0.16** 0.45±0.04## 0.46±0.07 0.40±0.07## 0.39±0.09##右后支撑时相Rh duty cycle 0.49±0.13 0.66±0.13** 0.45±0.04## 0.51±0.05 0.54±0.08 0.55±0.09平均步行周期(s)Average step cycle 0.24±0.08 0.30±0.07 0.23±0.06 0.26±0.08 0.25±0.05 0.23±0.05
在平均步行周期指标中,模型组与对照组相比有上升趋势,各给药组与模型组相比有下降趋势,但无显著性差异(P>0.05)。
2.2 金钗石斛对PD 小鼠爬杆时间和悬挂评分的影响
如表2 所示,在爬杆实验中,与对照组比较,模型组的上半段时间、总时间均增加(P<0.01,P<0.001),掉头时间和下半段时间无明显变化(P>0.05)。 与模型组相比,DNL(300 mg/kg)组的爬杆上半段时间指标下降(P<0.01),下半段时间、掉头时间和总时间无显著性差异(P>0.05)。 在悬挂评分实验中,模型组与对照组比较,悬挂评分明显下降(P<0.05)。 与模型组相比,DNL(300 mg/kg)组的评分增加具有显著性差异(P<0.05),美多芭组、DNL(100、200 mg/kg)组评分有一定的增加趋势但无显著性差异(P>0.05)。
表2 金钗石斛对PD 小鼠爬杆时间和悬挂评分的影响(,n=10~11)Table 2 Effects of DNL on climbing time and the score of the suspension test of PD mice

表2 金钗石斛对PD 小鼠爬杆时间和悬挂评分的影响(,n=10~11)Table 2 Effects of DNL on climbing time and the score of the suspension test of PD mice
注:与对照组相比,*P<0.05,**P<0.01,***P<0.001;与模型组相比,#P<0.05,##P<0.01。Note. Compared with control group,*P<0.05,**P<0.01,***P<0.001. Compared with model group,#P<0.05,##P<0.01.
组别Groups调头时间(s)Turn round time上半段时间(s)First half of time下半段时间(s)Second half of time总时间(s)Total time悬挂评分Score对照组 Control 0.97±0.04 4.03±0.83 5.93±0.81 9.96±1.10 2.70±0.48模型组 Model 0.98±0.03 6.13±0.99*** 6.73±0.91 12.86±1.16** 1.70±0.48*美多芭组 Madopar 0.98±0.02 5.74±0.79 6.66±1.07 12.40±1.18 2.11±0.78金钗石斛组DNL 100 mg/kg 0.96±0.04 5.39±1.24 6.12±1.68 11.51±2.66 2.45±0.68 200 mg/kg 0.98±0.03 5.15±0.88 5.66±1.17 10.81±1.66 2.55±0.52 300 mg/kg 0.99±0.01 5.02±1.00# 6.63±0.70 11.66±1.42 2.63±0.67##
2.3 金钗石斛对PD 小鼠空场实验的影响
在空场实验中,如表3 所示,与对照组相比,模型组在运动总路程、运动时间、平均速度、僵滞时间比率上均有显著性差异(P<0.05)。 与模型组相比,美多芭组,DNL(100、200、300 mg/mL)组各项指标均无显著性差异(P>0.05)。
表3 金钗石斛对PD 小鼠空场实验的影响(,n=10~11)Table 3 Effects of DNL on the open-feild test of PD mice
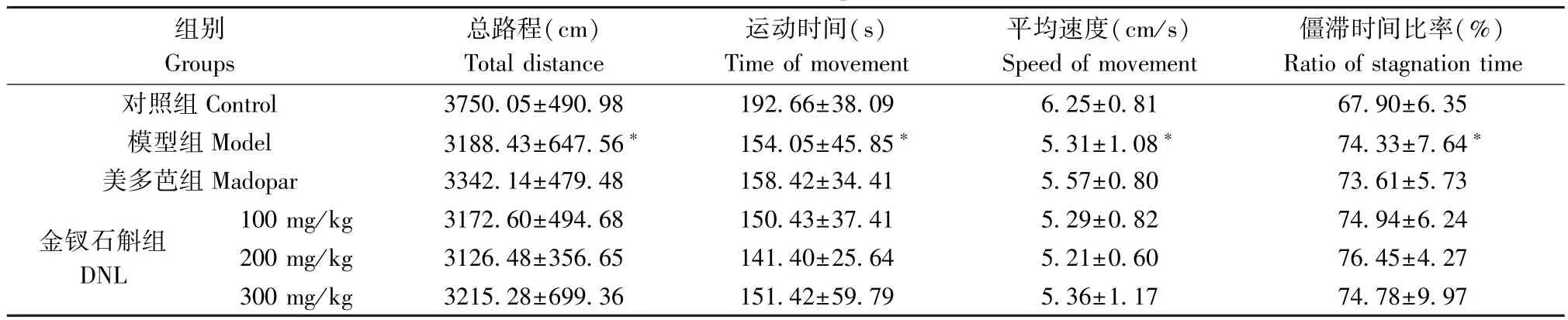
表3 金钗石斛对PD 小鼠空场实验的影响(,n=10~11)Table 3 Effects of DNL on the open-feild test of PD mice
注:与对照组相比,*P<0.05。Note. Compared with control group,*P<0.05.
组别Groups总路程(cm)Total distance运动时间(s)Time of movement平均速度(cm/s)Speed of movement僵滞时间比率(%)Ratio of stagnation time对照组 Control 3750.05±490.98 192.66±38.09 6.25±0.81 67.90±6.35模型组 Model 3188.43±647.56* 154.05±45.85* 5.31±1.08* 74.33±7.64*美多芭组 Madopar 3342.14±479.48 158.42±34.41 5.57±0.80 73.61±5.73金钗石斛组DNL 100 mg/kg 3172.60±494.68 150.43±37.41 5.29±0.82 74.94±6.24 200 mg/kg 3126.48±356.65 141.40±25.64 5.21±0.60 76.45±4.27 300 mg/kg 3215.28±699.36 151.42±59.79 5.36±1.17 74.78±9.97
2.4 金钗石斛对PD 小鼠脑组织炎症因子水平的影响
通过前期的行为学实验,我们认为DNL 各剂量中300 mg/kg 剂量效果最佳,因此仅选择DNL(300 mg/kg)进行后续的研究。 ELISA 检测结果如图2所示,与对照组相比, 模型组小鼠纹状体区炎症因子 TNF-α、IL-1β 和 IL-6 水平升高 (P<0.001) 。 与模型组相比,美多芭、DNL(300 mg/kg)各指标显著下降(P<0.05,P<0.01)。 在皮层区,各组间炎症因子水平的差异无统计学意义(P>0.05)。
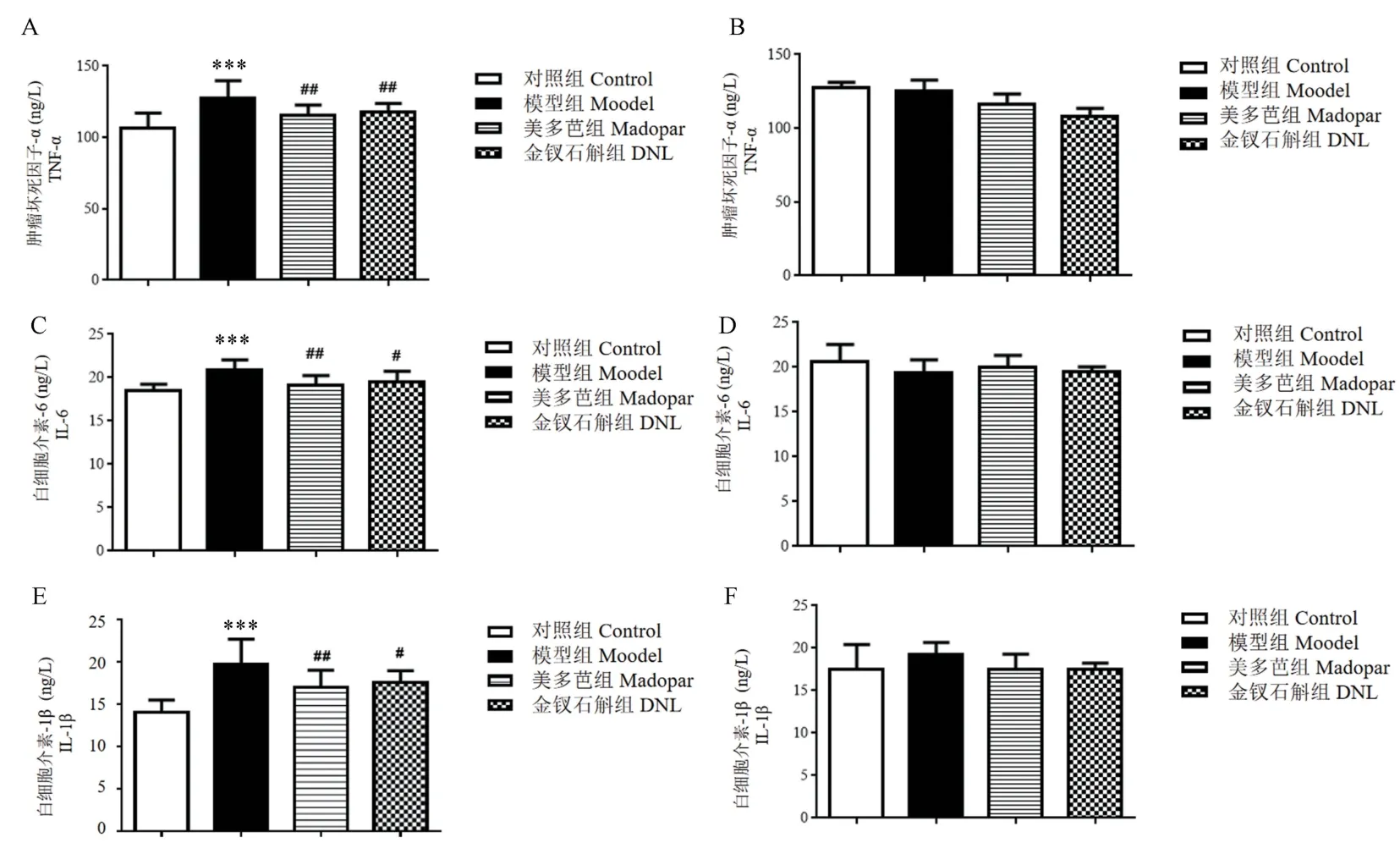
图2 金钗石斛对PD 小鼠脑组织TNF-α、IL-6、IL-β 水平的影响(,n=7)Note. A,TNF-α levels in striatum. B,TNF-α levels in cortex. C,IL-6 levels in striatum. D,IL-6 levels in cortex. E,IL-β levels in striatum. F,IL-β levels in cortex. Compared with control group,***P<0.001. Compared with model group,#P<0.05,##P<0.01.Figure 2 Effects of DNL on TNF-α,IL-6,IL-β levels in PD mice brain
2.5 金钗石斛对小鼠纹状体中 caspase-3 和caspase-9 蛋白的表达的影响
免疫印迹结果如图3 所示,对照组中caspase-3和caspase-9 蛋白的表达量较少,与对照组相比,模型组中caspase-3 和caspase-9 蛋白的表达量明显增多(P<0.001);与模型组相比,美多芭组和 DNL(300 mg/kg)组中 caspase-3 和 caspase-9 蛋白的表达均有显著下降(P<0.05,P<0.01,P<0.001)。

图3 金钗石斛对PD 小鼠纹状体中caspase-3 和caspase-9 蛋白的表达的影响(,n=3)Note. Compared with control group,***P<0.001. Compared with model group,#P<0.05,##P<0.01,###P<0.001.Figure 3 Effects of DNL on the expression of caspase-3 and caspase-9 proteins in the striatum of PD mice
3 讨论
帕金森病是一种由多种环境因素、生物因素介导的慢性神经退行性疾病,在60 岁以上人群中患病率达1%[20]。 为了深入研究 PD 的病因及治疗方法,研究者们根据疾病的病理特点制作了不同的动物模型,其中MPTP 模型是目前最常用的神经毒素模型之一,具有较长的研究历史。 MPTP 能够引起黑质致密部多巴胺能神经元的变性,氧化应激反应和线粒体功能障碍,能够较好地模拟PD 的临床表现和病理学特征[21]。 因此,在本研究我们采用腹腔注射给与MPTP 30 mg/kg 连续7 d 诱导的小鼠亚急性PD 模型来评价DNL 的药效。 造模小鼠均在膜腔注射给予MPTP 后5~30 min 出现静止性震颤、立毛、弓背、行动减缓、聚集成团等现象,与参考文献[22]报道一致,提示腹腔注射给与MPTP 可成功建构PD 模型。
现代药理学研究表明,金钗石斛生物碱具有显著的神经保护作用,Li 等[23]发现金钗石斛生物碱可以显著改善6-OHDA 诱导的PD 大鼠中脑黑质DA神经元丢失以及降低6-OHDA 诱导的原代大鼠中脑神经元-胶质细胞中促炎因子的释放。 石斛碱是金钗石斛中含量最高的倍半萜类生物碱,具有显著的生物活性[24],可显著改善PD 症状保护DA 能神经元。 此外,研究表明金钗石斛中的有效活性成分槲皮素可保护机体免受神经毒性化学物质的侵害,并可防止神经元损伤和神经变性的进化和发展[25]。Singh 等[26]发现给予槲皮素可减轻链脲佐菌素(STZ)诱导的动物认知障碍。 槲皮素还可以通过激活PINK1-Parkin 线粒体吞噬通路改善6-OHDA 诱导的PD 模型的线粒体质量控制并保护DA 神经元,改善6-OHDA 处理下PC12 细胞线粒体功能障碍,降低氧化应激水平[27]。 结合种种研究证据,我们认为金钗石斛在防治PD 药物研发方面具有较大的潜力,因此选择金钗石斛醇提物作为干预药物,探究其神经保护作用。
本研究选择爬杆实验、悬挂实验、步态分析实验和空场实验来评价动物的行为学指标。 爬杆实验和悬挂实验是PD 动物模型公认、经典、常用的行为学检测方法,对动物的协调性具有较好的检测效果[18,28]。 在爬杆实验中,小鼠在爬杆顶部调头至爬杆上半段时,需要调整姿势和方向,该动作能反映肢体的抓握调遣和协调能力,总时间可评估动物总体的运动速度和四肢协调性,因此常用于评价 PD小鼠的运动功能。 本实验中发现,MPTP 模型组小鼠在爬杆上半段时间、总时间与对照组相比均有显著延长,表明腹腔注射给与MPTP 使小鼠肢体运动协调能力受到一定程度的损害,而300 mg/kg 的DNL 对这种损伤起到了一定的恢复作用。 同样,模型组悬挂评分显著降低,提示小鼠肢体运动协调能力受损,DNL(300 mg/kg)同样可以显著恢复这种受损现象。
步态分析实验是一种评价神经系统运动行为高度敏感的检测方法[16],本研究采用自主研制的大小鼠步态分析系统,已在前期的课题中得到验证[29],目前国内已有文献报道将该系统应用于小鼠帕金森步态行为的研究[30]。 推进指数是指推进时长/支撑时长,用来描述动物肢体离地,在行走过程中足迹面积逐渐变小的过程。 该指标在一定程度上能反映动物行走时肢体肌力的情况。 在本实验中,模型组的推进指数出现异常,提示模型动物的肢体推动能力下降,需要靠更大的肌力代偿。 步行周期分为支撑相和摆动相,支撑时相指一个步行周期里,动物肢体支撑时长与步行周期的比例,步行周期的异常提示动物行走整体功能出现障碍,导致步行时间减少,肢体与地面接触时间增加。 在本实验中,与对照组相比,虽然模型组的步行周期没有显著性差异,但有增高趋势,提示该模型已经出现步行异常,步行速度下降从而使动物各肢体支撑时长上升,美多芭和DNL(300 mg/kg)均可不同程度地改善PD 小鼠步态指标的异常。
近年来研究表明,炎症反应参与了PD 的发生发展[31]。 MPTP 腹腔注射可使小鼠纹状体内TNF-α[32]、IL-6[33]、IL-1β[34]等促炎因子表达量增加, 并伴有胶质细胞的增生[35]。 反应性小胶质细胞增生是PD 炎症假说中的关键环节,有研究发现PD 模型小鼠黒质致密部小胶质细胞出现明显增生,并产生了大量 TNF-ɑ 和 IL-1β,后两者加速了 DA 神经元的变性和死亡,继而引起了神经递质DA 的生成的减少[36-37],因此,恢复因过度炎性反应引起的DA 神经元损伤是改善PD 的一个重要途径。 本研究结果显示,在 MPTP 模型组纹状体中 TNF-α、IL-6、IL-1β水平及表达与对照组相比组显著升高,DNL(300 mg/kg)给药组小鼠纹状体中的炎性因子指标相对于模型组均有所下降,说明DNL 对MPTP 引起的纹状体神经炎症同样发挥抑制作用。 而在皮层区却并未观察到这一现象,这提示不同脑区对MPTP 可能存在不同的免疫反应。
PD 的发生发展还与神经细胞凋亡密切相关,过度的细胞凋亡会严重影响神经功能。 caspase 家族基因是控制凋亡的重要原件之一,当细胞凋亡途径激活,caspase-3 蛋白磷酸化,细胞凋亡进入不可逆阶段[38]。 在本实验中,与对照相比,模型组小鼠caspase-3 和caspase-9 蛋白表达量增高,表明MPTP使小鼠脑组织的神经细胞发生凋亡;相比模型组,美多芭、DNL(300 mg/kg)给药组小鼠caspase-3 和caspase-9 蛋白表达水平均显著降低,提示DNL 可能是通过降低caspase-3 和 caspase-9 蛋白表达水平的途径来抑制细胞凋亡对PD 动物模型的影响,更具体的作用机理有待我们下一步的研究。
综上所述,金钗石斛提取物对MPTP 诱导的PD模型小鼠具有一定的神经保护作用,可缓解运动障碍,降低 TNF-α、IL-6、IL-1β、caspase-3 和 caspase-9蛋白表达水平,其作用机制可能是通过抑制炎症反应, 减少神经细胞凋亡的途径来实现的。
